医薬品情報
| 総称名 | メサラジン |
|---|---|
| 一般名 | メサラジン |
| 欧文一般名 | Mesalazine |
| 製剤名 | メサラジン注腸1%製剤 |
| 薬効分類名 | 潰瘍性大腸炎治療剤 |
| 薬効分類番号 | 2399 |
| ATCコード | A07EC02 |
| KEGG DRUG |
D00377
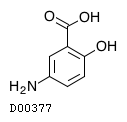
メサラジン
|
| KEGG DGROUP |
DG01504
非ステロイド性抗炎症薬 (NSAID)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年5月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メサラジン注腸1g「ケンエー」 | Mesalazine Enema 1g「KENEI」 | 健栄製薬 | 2399715X1040 | 426.5円/個 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
潰瘍性大腸炎(重症を除く)
5. 効能または効果に関連する注意
脾彎曲部より口側の炎症には効果が期待できない。[16.8参照]
6. 用法及び用量
通常、成人には1日1個(メサラジンとして1g)を、直腸内注入する。なお、年齢、症状により適宜減量する。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 メサラジンにより過敏症状(発熱1)、腹痛2)3)4)5)6)、下痢2)4)、好酸球増多7)等)が発現することがあり、また、潰瘍性大腸炎が悪化8)9)することがあるため、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。[2.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 サラゾスルファピリジンに対する過敏症のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。メサラジンの動物実験(ラット)では催奇形性は認められていない28)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど慎重に投与すること。一般に生理機能(腎機能、肝機能等)が低下している。[7.1参照]
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 間質性肺疾患(頻度不明)
胸水、胸部痛、心電図異常等があらわれた場合には、投与を中止するなど適切な処置を行うこと。
11.1.4 再生不良性貧血、汎血球減少、無顆粒球症、血小板減少症(いずれも頻度不明)[8.3参照]
11.1.5 肝炎、肝機能障害、黄疸(いずれも頻度不明)
肝炎、AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.4参照]
11.1.6 膵炎(頻度不明)[8.5参照]
11.1.7 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.1.8 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
副作用頻度は、国内のペンタサ錠250mg・500mgの臨床成績及び市販後調査結果、又は外国における市販後調査結果(経口剤、注腸剤、坐剤を区別していない)
11.2 その他の副作用
| 1%以上 | 0.01〜1%未満 | 0.01%未満 | 頻度不明 | |
| 皮膚 | 発疹、丘疹、蕁麻疹、紅斑 | 脱毛48) | そう痒感 | |
| 消化器 | 下痢、腹痛、嘔気、嘔吐 | 血便注1)、下血注1)、アミラーゼ上昇、腹部膨満感注1)、便秘注1)、粘液便注1) | 食欲不振、口内炎、便の変色(黒色等) | |
| 肝臓 | AST・ALT・γ-GTP・Al-P・ビリルビンの上昇等の肝機能異常 | |||
| 腎臓 | 尿着色注1) | クレアチニン・尿中NAG・尿中ミクログロブリンの上昇・尿蛋白等の腎機能異常 | ||
| 血液 | 白血球減少、貧血、好酸球増多7) | |||
| その他 | 頭痛 | CK上昇注1) | 筋肉痛、関節痛、ループス様症候群49)50) | 発熱、浮腫、全身倦怠感、めまい、末梢神経障害51)、肛門部位疼痛、肛門部位のかゆみ、不快感、便意切迫、胸部痛、頚部痛、CRP上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 本剤はポリエチレン製の容器に入った液剤で、脱酸素剤とともにアルミの袋に入っている。使用直前に袋から取り出して使用するよう患者に指導すること。[20.参照]
14.1.2 使用方法
(1)アルミ袋から取り出し、カテーテルの目盛りを目安にして、ストッパーをスライドさせ挿入深度を合わせ、容器をよく振る。
(2)カテーテルをしっかり持ち、キャップを回すように取りはずす。
(3)左側臥位になり、カテーテルをストッパーの位置まで肛門からゆっくりと挿入する(直腸粘膜を傷つけるおそれがあるので、慎重に挿入すること)。
(4)カテーテルを挿入後、薬液をゆっくりと注入する。
(5)薬液を注入後、ゆっくりとカテーテルを抜き取る。
14.1.3 メサラジンは光及び酸素の影響で分解されやすいため、アルミ袋を開封したものは保存できない。[20.参照]
14.1.4 本品は白色〜微黄色の懸濁液である。メサラジンは酸化により分解されやすく有色の分解物を生成するため、上澄液が無色〜微黄色の範囲を超えて着色したものは使用しないこと。
14.2 薬剤投与後の注意
メサラジン又はその代謝物を含む尿は、次亜塩素酸塩を含有する漂白剤と接触することにより赤褐色に変色することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
潰瘍性大腸炎患者9例にメサラジン注腸剤100mL(メサラジンとして1g含有)を単回経直腸投与したとき、血漿中未変化体及び代謝物であるN-アセチルメサラジン(アセチル体)は投与後3時間にそれぞれ0.35μg/mL(中央値、範囲0.1〜1.77μg/mL)及び0.55μg/mL(中央値、範囲0.33〜1.49μg/mL)の最高血漿中濃度に達した(外国人データ)52)。
16.1.2 生物学的同等性試験
メサラジン注腸1g「ケンエー」とペンタサ注腸1gを、クロスオーバー法によりそれぞれ1個(メサラジンとして1g)健康成人男子に絶食単回直腸投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された53)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | |
| メサラジン注腸1g「ケンエー」 | 10.81±6.91 | 1.12±0.54 | 2.5±1.8 | 6.3±3.6※1 |
| ペンタサ注腸1g | 10.21±5.82 | 1.14±0.51 | 2.5±1.8 | 6.1±3.8※2 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.4 代謝
メサラジンは全身に分布するN-アセチルトランスフェラーゼによって生体内でアセチル体に代謝される54)。
16.5 排泄
潰瘍性大腸炎患者9例にメサラジン注腸剤100mL(メサラジンとして1g含有)を単回経直腸投与したときの投与後48時間までの排泄率は、尿中では未変化体は検出せず、アセチル体が35%(中央値、範囲20〜79%)であり、糞中では未変化体が26%(中央値、範囲18〜43%)、アセチル体が2%(中央値、範囲0.1〜6%)であった(外国人データ)52)。
16.8 その他
99mTcで標識したメサラジン注腸剤1g/100mLを健康成人8名に経直腸投与したときの腸内での最遠到達部位と移行量を調べた。1名では直腸とS状結腸に滞留し、7名では脾彎曲部まで達し、そのうち4名は横行結腸まで到達した(外国人データ)55)。[5.参照]
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 ステロイド注腸剤との比較試験(海外第III相試験)
デンマークの7施設で活動期の軽〜中等症の潰瘍性大腸炎患者を対象に、プレドニゾロン注腸剤との二重盲検比較試験(解析症例114例)が実施された。メサラジン注腸剤の用量は1g/100mL、プレドニゾロン注腸剤は25mg/100mLで1日1回、4週間投与した56)。
(1)有効性
臨床判定及びS状結腸鏡判定を総合した概括判定において、寛解又は改善率はメサラジン群77%、プレドニゾロン群72%であり、両薬剤間の有効性は同等であった。
(2)安全性
本臨床試験に参加した123例において、メサラジン群13例(21.3%)、プレドニゾロン群6例(9.7%)に副作用が報告されたが、この差異は統計学的に有意ではなかった。メサラジン群で発現した副作用では腹部膨満及び仙痛が各3例(4.9%)と高頻度であった。
17.1.2 用量(濃度)比較試験(海外第II相試験)
アメリカの18施設で活動期の軽〜中等症の潰瘍性大腸炎患者を対象に、プラセボ対照の二重盲検比較試験(解析症例計287例)が実施された。メサラジン注腸剤の用量は1、2、4g/100mL注)で、1日1回、8週間投与した57)。
(1)有効性
・医師による概括判定
改善効果を認めた患者がプラセボ群では27%であったのに対し、1g/100mL群では67%、2g/100mL群では65%、4g/100mL群では75%であり、いずれの用量でもプラセボに対し有意に高い治療効果を示した。しかし、メサラジン注腸剤群間での有意な差は認められなかった。
・内視鏡スコア
プラセボ群では1.8ポイントの改善であったのに対し、1g/100mL群では5.8ポイント、2g/100mL群では5.9ポイント、4g/100mL群では6.4ポイントの改善といずれも有意な改善効果を示した。しかし、メサラジン注腸剤群間には有意な差は認められなかった。
(2)安全性
副作用がプラセボ群で10%に見られたのに対し、メサラジン注腸剤群では14%であり、用量依存的な変動も認められなかった。
注)本剤の承認用量は1日1個(メサラジンとして1g)である。
18. 薬効薬理
18.1 作用機序
メサラジンの主な作用機序として炎症性細胞から放出される活性酸素を消去し、炎症の進展と組織の障害を抑制すること、及びロイコトリエンB4(LTB4)の生合成を抑制し、炎症性細胞の組織への浸潤を抑制することが考えられる58)。
18.2 活性酸素に対する作用
in vitroにおいてフリーラジカル(DPPHL)還元作用、過酸化水素消去作用、次亜塩素酸イオン消去作用、過酸化脂質抑制作用(in vitro、in vivo)が認められた58)。
18.3 LTB4に対する作用
ラット好中球でのLTB4生合成を抑制した(in vitro)58)。
18.4 動物モデルに対する効果
19. 有効成分に関する理化学的知見
19.1. メサラジン
20. 取扱い上の注意
22. 包装
100mL[ボトル(アルミ袋内に脱酸素剤入り)]×7
23. 主要文献
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2585-S2605, (1994)
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2509-S2530, (1994)
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2531-S2554, (1994)
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2555-S2583, (1994)
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2607-S2624, (1994)
- Miner,P.et al., Dig.Dis.Sci., 40 (2), 296-304, (1995) »PubMed
- Morice,A.H.et al., Lancet., 350, 1105, (1997) »PubMed
- Kapur,K.C.et al., Gut., 37, 838-839, (1995) »PubMed
- 竹下宗範,他, 第74回日本消化器病学会九州支部例会抄録, 74, 65, (1999)
- Mehta,R.P., CMAJ., 143 (10), 1031-1032, (1990) »PubMed
- Witte,T.et al., Nephron., 67, 481-482, (1994) »PubMed
- Smilde,T.J.et al., Ned.Tijdschr.Geneeskd., 138 (51), 2557-2561, (1994) »PubMed
- Otsubo,H.et al., Int.J.Hematol., 68, 445-448, (1998) »PubMed
- Kotanagi,H.et al., J.Gastroenterol., 33, 571-574, (1998) »PubMed
- Casellas,F.et al., J.Clin.Gastroenterol., 22 (2), 160-161, (1996) »PubMed
- Daneshmend,T.K., Lancet., 337, 1297-1298, (1991) »PubMed
- Jick,H.et al., Pharmacotherapy., 15 (2), 176-181, (1995) »PubMed
- Committee on Safety of Medicines, Current Problems in Pharmacovigilance., 21, 5-6, (1995)
- Bodin,F.et al., Therapie., 46, 341, (1991) »PubMed
- Wyatt,S.et al., Lancet., 341, 1476, (1993) »PubMed
- Hautekeete,M.L.et al., Gastroenterology., 103, 1925-1927, (1992) »PubMed
- Stoschus,B.et al., J.Hepatol., 26, 425-428, (1997) »PubMed
- Deltenre,P.et al., Gut., 44, 886-888, (1999) »PubMed
- Besseau,M.et al., Gastroenterol.Clin.Biol., 15, 174-175, (1991)
- Sachedina,B.et al., Ann.Intern.Med., 110 (6), 490-492, (1989) »PubMed
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2625-S2638, (1994)
- Mulder,C.J.J.et al., Ann.Intern.Med., 106 (6), 911-912, (1988)
- 太田隆雄,他, 応用薬理, 47 (6), 513-522, (1994)
- 田中和彦,他, 応用薬理, 48 (4), 225-238, (1994)
- de Boer,N.K.H.et al., Am.J.Gastroenterol., 102, 2747-2753, (2007) »PubMed
- Szumlanski,C.L.et al., Br.J.Clin.Pharmacol., 39, 456-459, (1995) »PubMed
- Dewit,O.et al., Aliment.Pharmacol.Ther., 16, 79-85, (2002) »PubMed
- Honeybourne,D., BMJ., 308, 533-534, (1994) »PubMed
- Welte,T.et al., Lancet., 338, 1273, (1991) »PubMed
- Lagler,U.et al., Schweiz.Med.Wochenschr., 122, 1332-1334, (1992) »PubMed
- Bitton,A.et al., Am.J.Gastroenterol., 91, 1039-1040, (1996) »PubMed
- Declerck,D.et al., Rev.Mal.Respir., 11, 292-293, (1994) »PubMed
- Muzzi,A.et al., Chest., 108 (4), 1181, (1995) »PubMed
- Reinoso,M.A.et al., Chest., 101 (5), 1469-1471, (1992) »PubMed
- le Gros,V.et al., BMJ., 302, 970, (1991) »PubMed
- Kristensen,K.S.et al., Lancet., 335, 605, (1990) »PubMed
- Agnholt,J.et al., Lancet., 1, 1135, (1989) »PubMed
- 増谷 学,他, 日本消化器病学会雑誌, 96 (5), 524-529, (1999) »DOI
- Heresbach D.et al., Gastroenterol.Clin.Biol., 18, 782-785, (1994)
- Gujral,N.et al., Dig.Dis.Sci., 41 (3), 624-626, (1996) »PubMed
- Iaquinto,G.et al., Ital.J.Gastroenterol., 26, 145-147, (1994) »PubMed
- Skhiri,H.et al., Nephron., 79, 236, (1998) »PubMed
- Netzer,P., Schweiz.Med.Wochenschr., 125, 2438-2442, (1995) »PubMed
- Dent,M.T., BMJ., 305, 159, (1992)
- Timsit.M.A.et al., Rev.Rhum.Engl.Ed., 64 (10), 586-588, (1997)
- Woodward,D.K., BMJ., 299, 1224, (1989) »PubMed
- Bondesen,S.et al., Scand.J.Gastroenterol., 19, 677-682, (1984) »PubMed
- 社内資料:メサラジン注腸1g「ケンエー」の生物学的同等性について
- 第十八改正日本薬局方解説書, 5626-5633, (2021), (廣川書店)
- Brown,J.et al., Aliment.Pharmacol.Ther., 11, 685-691, (1997) »PubMed
- Danish 5-ASA Group., Dig.Dis.Sci., 32 (6), 598-602, (1987)
- Hanauer,S.B., Inflamm.Bowel.Dis., 4, 79-83, (1998) »PubMed
- 中丸幸一,他, 日本薬理学雑誌, 104, 447-457, (1994) »PubMed
- 小島僚太郎,他, 日本薬理学雑誌, 118, 123-130, (2001) »PubMed
- ペンタサ注腸1g:2002年10月8日承認、審査報告書ホ.薬理作用に関する資料
24. 文献請求先及び問い合わせ先
文献請求先
健栄製薬株式会社
学術情報部
〒541-0044
大阪市中央区伏見町2丁目5番8号
電話:06-6231-5822
FAX:06-6204-0750
製品情報問い合わせ先
健栄製薬株式会社
学術情報部
〒541-0044
大阪市中央区伏見町2丁目5番8号
電話:06-6231-5822
FAX:06-6204-0750
26. 製造販売業者等
26.1 製造販売元
健栄製薬株式会社
大阪市中央区伏見町2丁目5番8号