医薬品情報
| 総称名 | オンジェンティス |
|---|---|
| 一般名 | オピカポン |
| 欧文一般名 | Opicapone |
| 製剤名 | オピカポン錠 |
| 薬効分類名 | 末梢COMT阻害剤 |
| 薬効分類番号 | 1169 |
| ATCコード | N04BX04 |
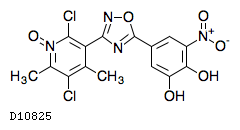
| KEGG DRUG |
D10825
オピカポン
|
| KEGG DGROUP |
DG01967
抗パーキンソン病薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オンジェンティス錠25mg | ONGENTYS Tablets | 小野薬品工業 | 1169019F1024 | 946.6円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
レボドパ・カルビドパ又はレボドパ・ベンセラジド塩酸塩との併用によるパーキンソン病における症状の日内変動(wearing-off現象)の改善
5. 効能または効果に関連する注意
5.1 本剤は症状の日内変動(wearing-off現象)が認められるパーキンソン病患者に対して使用すること。
5.2 本剤はレボドパ・カルビドパ又はレボドパ・ベンセラジド塩酸塩による治療において、十分な効果の得られない患者に対して使用すること。
6. 用法及び用量
本剤は、レボドパ・カルビドパ又はレボドパ・ベンセラジド塩酸塩と併用する。通常、成人にはオピカポンとして25mgを1日1回、レボドパ・カルビドパ又はレボドパ・ベンセラジド塩酸塩の投与前後及び食事の前後1時間以上あけて経口投与する。
7. 用法及び用量に関連する注意
7.1 本剤はレボドパ含有製剤と併用することで効果がみられる薬剤であり、単剤で使用しても効果は認められない。
7.2 本剤はレボドパの生物学的利用率を高めるため、レボドパによるドパミン作動性の副作用(ジスキネジア、幻覚、悪心、嘔吐及び起立性低血圧)があらわれる場合がある。このため、本剤の投与開始時は患者の状態を十分観察し、ドパミン作動性の副作用がみられた場合は、レボドパ含有製剤を調節すること。[8.1参照]
8. 重要な基本的注意
8.1 本剤はレボドパの生物学的利用率を高めるため、レボドパによるドパミン作動性の副作用(ジスキネジア、幻覚、悪心、嘔吐及び起立性低血圧)があらわれる場合がある。このため、抗パーキンソン剤を併用する場合には、これらの投与量を調節するなど、患者の状態を注意深く観察しながら投与すること。[7.2参照]
8.2 前兆のない突発的睡眠、傾眠、起立性低血圧、めまいがあらわれることがあるので、本剤投与中の患者には自動車の運転、高所での作業等、危険を伴う作業には従事させないように注意すること。[11.1.3参照]
8.3 本剤は常にレボドパ含有製剤と併せて経口投与されるため、使用前に必ずこれらの電子添文に留意すること。
8.4 本剤とレボドパの併用療法においても、レボドパ又はドパミン受容体作動薬を投与された患者と同様に、病的賭博(個人的生活の崩壊等の社会的に不利な結果を招くにもかかわらず、持続的にギャンブルを繰り返す状態)、病的性欲亢進、強迫性購買、暴食等の衝動制御障害が起こる可能性があるので、このような症状が発現した場合には、投与を中止するなど適切な処置を行うこと。また、患者及び家族等にこのような衝動制御障害の症状について説明すること。
8.5 本剤の投与中止により、パーキンソン病患者でみられる悪性症候群や横紋筋融解症が発現する可能性があるので、投与を中止する場合は、患者の状態を十分観察すること。
8.6 起立性低血圧又は低血圧があらわれることがあるので、患者の状態を十分観察し、めまい、立ちくらみ、ふらつき等の症状が認められた場合には、投与を中止するなど適切な処置を行うこと。また、パーキンソン病患者では運動機能障害による転倒リスクが高く、起立性低血圧があらわれた場合には、転倒により骨折や外傷に至るおそれがあるため、十分に注意すること。[15.1参照]
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重度肝機能障害(Child-Pugh分類C)のある患者
9.3.2 肝機能障害のある患者(重度肝機能障害(Child-Pugh分類C)のある患者を除く)
本剤の血中濃度が上昇する可能性がある。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎盤を通過すること、COMT遺伝子を欠損させたマウスでは胎児死亡数の増加及び胎盤重量の減少が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能(肝機能等)が低下している。
10. 相互作用
相互作用序文
本剤はカテコール-O-メチルトランスフェラーゼ(COMT)阻害剤である。
薬物代謝酵素用語
カテコール-O-メチルトランスフェラーゼ(COMT)
10.2 併用注意
| COMTにより代謝される薬剤 アドレナリン(別名エピネフリン) ノルアドレナリン(別名ノルエピネフリン) dl-イソプレナリン塩酸塩 ドパミン塩酸塩等 | 心拍数増加、不整脈、血圧変動があらわれるおそれがある。 吸入を含めて投与経路にかかわらず注意すること。 | カテコール基を有するこれらの薬剤はCOMTにより代謝されるが、本剤はこれらの薬剤の代謝を阻害し、作用を増強させる可能性がある。 |
| MAO-B阻害剤 セレギリン塩酸塩 ラサギリンメシル酸塩等 | 血圧上昇等を起こすおそれがある。 | これら薬剤のMAO-Bの選択的阻害効果が低下した場合、非選択的MAO阻害による危険性があるため、本剤との併用により、生理的なカテコールアミンの代謝が阻害される可能性がある。 |
| 鉄剤 | 同時に服用すると鉄剤及び本剤の効果が減弱する可能性がある。 | 本剤は消化管内で鉄とキレートを形成する可能性がある。 |
| 三環系・四環系抗うつ薬、ノルアドレナリン再取込み阻害薬、ノルアドレナリン・セロトニン作動性抗うつ剤 アミトリプチリン塩酸塩 マプロチリン塩酸塩 ベンラファキシン塩酸塩 デュロキセチン塩酸塩 ミルタザピン等 | 使用経験が限られており、血圧上昇等を起こすおそれがある。 | これらの薬剤はノルアドレナリン取込み阻害作用あるいは放出促進作用を有する。本剤はノルアドレナリン等のカテコールアミンの代謝を阻害するため、併用によりノルアドレナリン等の作用を増強させる可能性がある。 |
| キニジン [16.7.4参照] | 本剤の効果が減弱する可能性がある。 | 機序は不明であるが、併用により本剤の血中濃度が低下する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど、適切な処置を行うこと。
11.1.1 ジスキネジア(17.3%)
このような症状があらわれた場合にはレボドパ含有製剤あるいは抗パーキンソン剤の減量、あるいはそれでもコントロール困難な場合は本剤の中止等の適切な処置を行うこと。
11.1.2 幻覚(4.4%)、幻視(2.8%)、幻聴(0.7%)、譫妄(0.5%)
このような症状があらわれた場合にはレボドパ含有製剤あるいは抗パーキンソン剤の減量、あるいはそれでもコントロール困難な場合は本剤の中止等の適切な処置を行うこと。
11.1.3 傾眠(2.1%)、突発的睡眠(1.2%)
傾眠、前兆のない突発的睡眠があらわれることがあるので、このような症状があらわれた場合にはレボドパ含有製剤あるいは抗パーキンソン剤の減量、あるいはそれでもコントロール困難な場合は本剤の中止等の適切な処置を行うこと。[8.2参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 精神・神経系障害 | 浮動性めまい、睡眠障害 | 不眠症、体位性めまい、ジストニア、頭痛、感覚鈍麻、うつ病、落ち着きのなさ、失神、パーキンソン病、味覚異常、悪夢、不安 | 異常な夢、運動過多 | |
| 胃腸障害 | 便秘 | 悪心、口渇 | 腹部不快感、腹部膨満、腹痛、嘔吐、胃炎、大腸ポリープ、消化不良 | |
| 心臓障害 | 動悸、頻脈 | |||
| 代謝及び栄養障害 | 食欲減退 | 脱水、血中トリグリセリド増加、高アルカリホスファターゼ血症 | ||
| 全身障害 | 発熱、異常感、浮腫 | |||
| 筋骨格系障害 | 関節痛、筋肉痛、四肢痛、筋痙縮、変形性脊椎症、筋骨格硬直 | 筋攣縮 | ||
| 血液障害 | 貧血、白血球減少 | |||
| 肝胆道系障害 | 肝機能障害、ALT増加 | |||
| 腎及び尿路障害 | 腎機能障害、着色尿、排尿困難、頻尿、血尿、膀胱炎 | |||
| 皮膚障害 | 発疹、湿疹、接触皮膚炎 | |||
| 血管障害 | 起立性低血圧、高血圧 | 低血圧、血圧変動 | ||
| その他 | 体重減少、CK増加、転倒、挫傷 | 裂傷、呼吸困難、咽頭炎、肺炎、回転性めまい、創傷、足部白癬 | 耳閉、ドライアイ |
13. 過量投与
13.1 症状
ジスキネジア、浮動性めまい等が予想される。
14. 適用上の注意
14.1 薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
COMT阻害剤はレボドパ誘発性の起立性低血圧を増悪させるおそれがあるので、起立性低血圧を引き起こすおそれのある薬剤(α遮断剤、α・β遮断剤、交感神経末梢遮断剤等)を服用している場合には注意すること。[8.6参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性にオピカポンの錠剤25mg又は50mgを空腹時に単回経口投与したとき、血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。1)
| 投与量(mg) | Cmax(ng/mL) | Tmax(hr) | AUC0-24h(ng・hr/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) |
| 25 (N=24) | 970±212 | 2.00(1.00-5.00) | 2480±586 | 2530±581※ | 0.729±0.173※ |
| 50 (N=23) | 2070±552 | 2.00(0.750-4.00) | 5170±1520 | 5200±1530 | 1.42±0.664 |
(注)本剤の承認された用法・用量は「通常、成人にはオピカポンとして25mg(錠)を1日1回、レボドパ・カルビドパ又はレボドパ・ベンセラジド塩酸塩の投与前後及び食事の前後1時間以上あけて経口投与する。」である。
16.1.2 反復投与
健康成人(13例)にオピカポンのカプセル25mgを空腹時に1日1回10日間反復経口投与したとき、反復投与による累積はほとんど認められず、累積係数は1.20であった。2)
16.2 吸収
16.2.1 食事の影響
健康成人男性(12例)にオピカポンの錠剤50mgを食後(標準食)に単回経口投与したとき、Cmax及びAUC0-∞は、空腹時に単回経口投与したときと比べて、それぞれ0.53倍及び0.57倍であった。3)
(注)本剤の承認された用法・用量は「通常、成人にはオピカポンとして25mg(錠)を1日1回、レボドパ・カルビドパ又はレボドパ・ベンセラジド塩酸塩の投与前後及び食事の前後1時間以上あけて経口投与する。」である。
16.2.2 国内外の臨床試験における薬物動態の評価(併合解析)
日本人健康成人(24例)及び非日本人健康成人(27例)にそれぞれオピカポンの錠剤及びカプセル25mgを空腹時に単回経口投与したとき、日本人に錠剤を投与したときのCmax及びAUC0-tは、非日本人にカプセルを投与したときと比べて、2.23倍及び2.11倍高かった。また、日本人健康成人(23例)及び非日本人健康成人(84例)にそれぞれオピカポンの錠剤及びカプセル50mgを空腹時に単回経口投与したとき、日本人に錠剤を投与したときのCmax及びAUC0-tは、非日本人にカプセルを投与したときと比べて、2.57倍及び2.26倍高かった。4)
(注)本剤の承認された一日用量は25mg(錠)である。また、海外では25mg及び50mg(カプセル)が承認され、推奨一日用量は50mgである。
16.3 分布
オピカポンの血漿蛋白結合率は99.9%であり、血球への移行性は低かった。5)(in vitro)
16.4 代謝
オピカポンの代謝には、SULT(硫酸転移酵素)1A1、UGT(グルクロン酸転移酵素)1A7、UGT1A9、UGT1A1、UGT2B7、還元酵素、COMT及びCYP3A4が関与していると考えられた。6)(in vitro及びin vivo)
16.5 排泄
健康成人男性(7例)に14C-オピカポン100mgを空腹時に単回経口投与したとき、投与した放射能量の70.4%が糞中に、5.3%が尿中に、20.5%が呼気中に排泄された。7)(外国人データ)
健康成人男性(12例)に、オピカポンのカプセル800及び1,200mgを空腹時に単回経口投与したとき、投与量の0.02〜0.05%が尿中に排泄された。8)(外国人データ)
(注)本剤の承認された一日用量は25mg(錠)である。また、海外では25mg及び50mg(カプセル)が承認され、推奨一日用量は50mgである。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
16.7 薬物相互作用
16.7.1 オピカポンはOATP1B3、BCRP及びP-gpの基質である。10)(in vitro)
16.7.2 ワルファリン
健康成人(20例)にオピカポンのカプセルを反復経口投与後[オピカポンの負荷用量(475mg)を1日1回2日間反復経口投与後、オピカポン50mgを1日1回5日間反復経口投与]、オピカポンのカプセル50mgとCYP2C9の基質であるワルファリン25mgを併用投与したとき、ワルファリン単独投与時と比べて、S-ワルファリンのCmax及びAUC0-∞は1.01倍及び0.88倍であり、R-ワルファリンのCmax及びAUC0-∞は0.98倍及び0.87倍であった。11)(外国人データ)
16.7.3 ラサギリン
健康成人(24例)にオピカポンのカプセル50mgの投与1時間後又は同時にラサギリン1mgを併用投与したとき、ラサギリン単独投与時と比べて、ラサギリンのCmaxは、1.00倍及び1.01倍、AUC0-∞は1.02倍及び1.02倍であった。12)(外国人データ)
健康成人(25例)にラサギリン1mgの投与1時間前又は同時にオピカポンのカプセル50mgを併用投与したとき、オピカポン単独投与時と比べて、オピカポンのCmaxは、1.12倍及び1.00倍、AUC0-∞は1.07倍及び1.05倍であった。13)(外国人データ)
16.7.4 キニジン
16.7.5 レボドパDCI
健康成人男性(20例)にオピカポンの錠剤25mgを1日1回11日間就寝前反復経口投与する前後にレボドパ/カルビドパ100/10mgを1日3回経口投与したとき、オピカポン投与前と比べ、オピカポン投与後でのレボドパのAUC0-24hは1.51倍上昇した。1)
(注)本剤の承認された一日用量は25mg(錠)である。また、海外では25mg及び50mg(カプセル)が承認され、推奨一日用量は50mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
レボドパ・カルビドパ又はレボドパ・ベンセラジド塩酸塩で治療中のwearing-off現象を有するパーキンソン病患者437例を対象とした二重盲検比較試験において、オピカポンの錠剤25mgを1日1回就寝前に14-15週間投与した際、プラセボと比較して、1日の症状日誌におけるOFF時間を有意に短縮した。15)国内第II相試験の安全性評価対象428例中、215例(50.2%)に副作用(臨床検査値異常を含む)が認められた。主な副作用(2%以上)は、ジスキネジア74例(17.3%)、便秘24例(5.6%)、幻覚19例(4.4%)、起立性低血圧18例(4.2%)、体重減少16例(3.7%)、悪心15例(3.5%)、幻視12例(2.8%)、口渇9例(2.1%)、傾眠9例(2.1%)であった。(非盲検期を含む)[7.3参照]
<各時点におけるベースラインからのOFF時間変化量>
| 解析対象集団:FAS | プラセボ N=147 | オピカポン25mg N=143 |
| LS Mean(SE)a) | −25.04(12.77) | −69.72(12.94) |
| [95%Cl]a) | [−50.14,0.06] | [−95.16,−44.28] |
| LS Mean Difference(SE)a) | −44.68(18.20) | |
| [95%Cl]a) | [−80.45,−8.91] | |
| P値a),b) | p=0.0145* | |
17.1.2 国内第II相試験
18. 薬効薬理
18.1 作用機序
本剤は、末梢で作用する長時間作用型COMT阻害剤であり、血中でのレボドパから3-O-メチルドパへの代謝を持続的に阻害し、レボドパの脳内移行を向上させる。
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. オピカポン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
30錠[10錠(PTP)×3]
100錠[10錠(PTP)×10]
100錠[瓶、バラ]
23. 主要文献
- 小野薬品工業:国内臨床(ONO-2370-01)試験成績(社内資料:CTD2.7.6.4)
- 小野薬品工業:海外臨床(BIA-91067-126)試験成績(社内資料:CTD2.7.6.15)
- 小野薬品工業:国内臨床(ONO-2370-03)試験成績(社内資料:CTD2.7.6.1)
- 小野薬品工業:国内外の臨床試験における薬物動態の評価(社内資料:CTD2.7.2.3.5.9)
- 小野薬品工業:In vitro血漿蛋白結合及び血球移行性(社内資料:CTD2.6.4.4.2.1)
- 小野薬品工業:In vitro及びin vivo代謝(社内資料:CTD2.6.4.5)
- 小野薬品工業:海外マスバランス(BIA-91067-130)試験成績(社内資料:CTD2.7.6.12)
- 小野薬品工業:海外臨床(BIA-91067-101)試験成績(社内資料:CTD2.7.6.9)
- 小野薬品工業:肝機能障害者における海外臨床(BIA-91067-106)試験成績(社内資料:CTD2.7.6.14)
- 小野薬品工業:トランスポーター基質検討(社内資料:CTD2.6.4.7.3.1)
- 小野薬品工業:海外臨床(BIA-91067-127)試験成績(社内資料:CTD2.7.6.30)
- 小野薬品工業:海外臨床(BIA-91067-112)試験成績(社内資料:CTD2.7.6.20)
- 小野薬品工業:海外臨床(BIA-91067-113)試験成績(社内資料:CTD2.7.6.21)
- 小野薬品工業:海外臨床(NBI-OPC-1707)試験成績(社内資料:CTD2.7.2.2.5.19)
- 小野薬品工業:国内臨床(ONO-2370-02)試験成績(社内資料:CTD2.7.6.34)
- 小野薬品工業:オピカポンのヒトCOMT阻害作用(社内資料:CTD2.6.2.2.1.1)
- Bonifacio MJ.et al., Br.J.Pharmacol., 172, 1739-1752, (2015)
- Kitajima T.et al., Neuropharmacology, 143, 282-288, (2018)
- Rocha JF.et al., Eur.J.Clin.Pharmacol., 70, 1059-1071, (2014)
- Bonifacio MJ.et al., Neuropharmacology, 77, 334-341, (2014)
- Bonifacio MJ.et al., Eur.J.Pharmacol., 892, 173742-173751, (2021)
24. 文献請求先及び問い合わせ先
文献請求先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
製品情報問い合わせ先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
26. 製造販売業者等
26.1 製造販売
小野薬品工業株式会社
大阪市中央区久太郎町1丁目8番2号