医薬品情報
| 総称名 | タブレクタ |
|---|---|
| 一般名 | カプマチニブ塩酸塩水和物 |
| 欧文一般名 | Capmatinib Hydrochloride Hydrate |
| 製剤名 | カプマチニブ塩酸塩水和物錠 |
| 薬効分類名 | 抗悪性腫瘍剤 MET阻害剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01EX17 |
| KEGG DRUG |
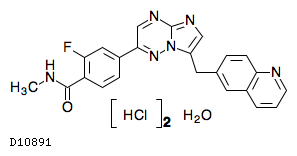
D10891
カプマチニブ塩酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タブレクタ錠150mg | TABRECTA tablets | ノバルティスファーマ | 4291067F1023 | 5055.5円/錠 | 劇薬, 処方箋医薬品注) |
| タブレクタ錠200mg | TABRECTA tablets | ノバルティスファーマ | 4291067F2020 | 6573.5円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
MET遺伝子エクソン14スキッピング変異陽性の切除不能な進行・再発の非小細胞肺癌
5. 効能または効果に関連する注意
5.1 十分な経験を有する病理医又は検査施設における検査により、MET遺伝子エクソン14スキッピング変異が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.2 本剤の術後補助療法における有効性及び安全性は確立していない。
6. 用法及び用量
通常、成人にはカプマチニブとして1回400mgを1日2回経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.1 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2 副作用が発現した場合は、以下の基準を考慮して、本剤を休薬、減量又は中止すること。[1.2、8.1、8.2、9.1.1、11.1.1-11.1.4参照]
| 減量レベル | 投与量 |
| 通常投与量 | 1回400mg(1日2回) |
| 1段階減量 | 1回300mg(1日2回) |
| 2段階減量 | 1回200mg(1日2回) |
| 中止 | 1回200mg(1日2回)で忍容不能な場合、投与を中止する。 |
| 副作用 | 基準注1) | 本剤の投与量調節 |
| 間質性肺疾患 | Grade1以上 | 投与を中止する。 |
| AST又はALT増加かつ 総ビリルビン増加注2) | AST又はALT増加>3.0×ULN かつ 総ビリルビン増加>2.0×ULN | 投与を中止する。 |
| AST又はALT増加 | Grade3 | Grade1以下又はベースラインに回復するまで休薬する。 7日以内に回復した場合は、同一用量で投与を再開する。 7日を過ぎてから回復した場合は、1段階減量して投与を再開する。 |
| Grade4 | 投与を中止する。 | |
| 総ビリルビン増加 | Grade2 | Grade1以下に回復するまで休薬する。 7日以内に回復した場合は、同一用量で投与を再開する。 7日を過ぎてから回復した場合は、1段階減量して投与を再開する。 |
| Grade3 | Grade1以下に回復するまで休薬する。 7日以内に回復した場合は、1段階減量して投与を再開する。 7日以内に回復しない場合は、投与を中止する。 | |
| Grade4 | 投与を中止する。 | |
| 上記以外の副作用 | Grade2 | 管理困難で忍容不能な場合は、Grade1以下に回復するまで休薬する。 休薬後に投与を再開する際には、1段階減量して投与を再開する。 |
| Grade3 | Grade2以下に回復するまで休薬する。 休薬後に投与を再開する際には、1段階減量して投与を再開する。 | |
| Grade4 | 投与を中止する。 |
8. 重要な基本的注意
8.1 間質性肺疾患があらわれることがあるので、初期症状(息切れ、呼吸困難、咳嗽、発熱等)の確認及び定期的な胸部画像検査の実施等、観察を十分に行うこと。また、患者に対して、初期症状があらわれた場合には、速やかに医療機関を受診するよう指導すること。[1.2、7.2、9.1.1、11.1.1参照]
8.3 腎機能障害があらわれることがあるので、本剤投与開始前及び投与中は定期的に腎機能検査を行い、患者の状態を十分に観察すること[11.1.4参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.4 生殖能を有する者
9.4.1 妊娠可能な女性には、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠している又は妊娠する可能性のある男性には、本剤投与中及び投与終了後一定期間はバリア法(コンドーム)を用いるよう指導すること。精液を介して胎児に悪影響を及ぼす可能性がある。[9.5参照]
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。乳汁移行に関するデータはないが、乳児が乳汁を介して本剤を摂取した場合、乳児に重大な副作用が発現するおそれがある。[9.5参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は、主にCYP3Aによって代謝される。また、本剤はCYP1A2、P-gp及びBCRPの阻害作用を示す。[16.4参照]
薬物代謝酵素用語
CYP3A
薬物代謝酵素用語
CYP1A2
薬物代謝酵素用語
P-gp
薬物代謝酵素用語
BCRP
10.2 併用注意
| 強力な又は中等度のCYP3A誘導剤 リファンピシン カルバマゼピン エファビレンツ等 [16.7.1、16.7.2参照] | 本剤の有効性が減弱するおそれがあるので、CYP3A誘導作用のない又はCYP3A誘導作用の弱い薬剤への代替を考慮すること。 | これらの薬剤がCYP3Aを誘導することにより、本剤の血中濃度が低下する可能性がある。 |
| 強力なCYP3A阻害剤 イトラコナゾール リトナビル クラリスロマイシン等 [16.7.3参照] | 本剤の副作用が増強されるおそれがあるので、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | これらの薬剤がCYP3Aを阻害することにより、本剤の血中濃度が増加する可能性がある。 |
| CYP1A2の基質となる薬剤 テオフィリン チザニジン ピルフェニドン等 [16.7.4参照] | これらの薬剤の副作用が増強されるおそれがあるので、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | 本剤がCYP1A2を阻害することにより、これらの薬剤の血中濃度が増加する可能性がある。 |
| P-gpの基質となる薬剤 ジゴキシン フェンタニル タクロリムス等 [16.7.5参照] | これらの薬剤の副作用が増強されるおそれがあるので、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | 本剤がP-gpを阻害することにより、これらの薬剤の血中濃度が増加する可能性がある。 |
| BCRPの基質となる薬剤 ロスバスタチン アトルバスタチン メトトレキサート等 [16.7.6参照] | これらの薬剤の副作用が増強されるおそれがあるので、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | 本剤がBCRPを阻害することにより、これらの薬剤の血中濃度が増加する可能性がある。 |
| 胃内pHを上昇させる薬剤 プロトンポンプ阻害剤 ラベプラゾール ランソプラゾール オメプラゾール等 [16.7.7参照] | 本剤の有効性が減弱するおそれがあるので、これらの薬剤との併用は可能な限り避けること。 | これらの薬剤が胃内pHを上昇させるため、本剤の吸収が低下し、本剤の血中濃度が低下する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 間質性肺疾患
11.1.2 体液貯留(54.6%)
末梢性浮腫(52.6%)、低アルブミン血症(7.2%)、胸水(頻度不明)、心嚢液貯留(1.0%)等の体液貯留があらわれることがある。急激な体重の増加、呼吸困難等の異常が認められた場合には本剤の投与を中止するなど適切な処置を行うこと。[7.2参照]
11.1.3 肝機能障害(10.3%)
11.1.4 腎機能障害(25.8%)
11.2 その他の副作用
| 10%以上 | 10%未満 | 頻度不明 | |
| 感染症および寄生虫症 | − | 蜂巣炎 | − |
| 代謝および栄養障害 | 食欲減退 | 低リン酸血症 | 低ナトリウム血症 |
| 呼吸器、胸郭および縦隔障害 | − | 呼吸困難、咳嗽 | − |
| 胃腸障害 | 悪心(37.1%)、嘔吐、下痢、リパーゼ増加 | 便秘、アミラーゼ増加 | 急性膵炎 |
| 肝胆道系障害 | − | 血中ビリルビン増加 | − |
| 皮膚および皮下組織障害 | − | そう痒症、蕁麻疹、発疹 | − |
| 一般・全身障害および投与部位の状態 | 疲労 | 発熱、体重減少 | 背部痛、非心臓性胸痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 ラットにおいて、臨床曝露量の1.2〜1.9倍に相当する用量で中枢神経系への影響(振戦、痙攣、脳(視床又は線条体)の空胞化等)が認められた。
16. 薬物動態
16.1 血中濃度
日本人の進行固形癌患者にカプマチニブ200mg注)又は400mgを空腹時に1日2回反復経口投与したときのカプマチニブのPKパラメータ及び血漿中濃度推移は以下のとおりであった。カプマチニブ400mgを空腹時に1日2回反復経口投与したときの投与15日目におけるカプマチニブの蓄積率は1.99であった1)。
| 投与量(mg) | 投与 | Cmax(ng/mL) | Tmax※(h) | AUClast(ng・h/mL) | AUC0-12h(ng・h/mL) |
| 200 | 1日目(n=3) | 2190(118.0) | 0.950(0.917-0.967) | 8200(61.0) | 8170(61.3) |
| 15日目(n=3) | 2850(59.6) | 0.967(0.967-2.00) | 11000(56.2) | 11000(56.2) | |
| 400 | 1日目(n=12) | 3230(80.8) | 1.00(0.467-3.95) | 12500(74.0) | 12500(73.8) |
| 15日目(n=9) | 6450(67.0) | 1.00(0.500-2.00) | 26400(70.4) | 26300(70.2) |
日本人患者にカプマチニブ200mg及び400mgを1日2回反復経口投与したときの1日目(上図)と15日目(下図)の血漿中濃度推移(平均値±標準偏差)
また、国際共同第II相試験で非小細胞肺癌患者に400mgを空腹時に1日2回反復経口投与してカプマチニブの薬物動態を評価した結果、累積率(1.39)から算出した有効半減期は6.54時間と推定され、反復投与後3日までに定常状態に達すると考えられる2)。
16.2 吸収
16.2.1 食事の影響
健康成人(24例)に本剤600mg注)を単回経口投与したとき、空腹時投与に対する低脂肪食投与におけるカプマチニブのCmax及びAUCinfの幾何平均値の比は、それぞれ1.11及び1.20であった。また、空腹時投与に対する高脂肪食投与におけるカプマチニブのCmax及びAUCinfの幾何平均値の比は、それぞれ1.15及び1.46であった3)(外国人データ)。
16.3 分布
カプマチニブのヒト血漿タンパク結合率は96%であった。血液/血漿濃度比は、濃度範囲10〜1,000ng/mLで1.5、高濃度10,000ng/mLでは0.9であった4)(in vitro)。
16.4 代謝
16.5 排泄
健康成人(6例)に[14C]カプマチニブ600mg注)を単回経口投与したとき、投与168時間後までの尿及び糞中において、それぞれ投与放射能の21.8及び77.9%が排泄された。また、投与96時間までの尿中及び糞中において、それぞれ主にM16及び未変化体が検出された(投与放射能に対する割合は、それぞれ2.9及び42.1%)5)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
カプマチニブ200mg注)を単回経口投与したとき、肝機能正常被験者(9例)に対する軽度(Child-Pugh分類A)の肝機能障害患者(6例)のカプマチニブのCmax及びAUCinfの幾何平均値の比は、それぞれ0.724及び0.767であった。また、肝機能正常被験者(9例)に対する中等度(Child-Pugh分類B)の肝機能障害患者(8例)のカプマチニブのCmax及びAUCinfの幾何平均値の比は、それぞれ0.828及び0.914であった。肝機能正常被験者(9例)に対する重度(Child-Pugh分類C)の肝機能障害患者(6例)のカプマチニブのCmax及びAUCinfの幾何平均値の比は、それぞれ1.02及び1.24であった6)(外国人データ)。
16.7 薬物相互作用
16.7.1 リファンピシン
16.7.2 エファビレンツ
16.7.3 イトラコナゾール
16.7.4 カフェイン
16.7.5 ジゴキシン
16.7.6 ロスバスタチン
16.7.7 ラベプラゾール
16.7.8 その他
(1)MET遺伝子変異等を有する進行固形癌患者(31例)にカプマチニブ400mgを1日2回9日間反復経口投与し、ミダゾラム(CYP3Aの基質)2.5mgを単回経口投与したとき、ミダゾラム単独投与時に対するカプマチニブ併用投与時のミダゾラムのCmax及びAUCinfの幾何平均値の比は、それぞれ1.22及び1.09であった9)(外国人データ)。
(2)カプマチニブはP-gpの基質であり、CYP2C8、MATE1及びMATE2-Kを阻害した(IC50値は、それぞれ1.7、0.28及び0.29μmol/L)。また、M16(酸化体)はMATE1及びMATE2-Kを阻害した(IC50値は、それぞれ0.38及び0.63μmol/L)12)(in vitro)。
注)本剤の承認用法・用量は「カプマチニブとして1回400mgを1日2回経口投与」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第II相試験(A2201/GEOMETRY-mono 1試験)
MET遺伝子エクソン14スキッピング変異陽性の切除不能な進行・再発の非小細胞肺癌患者を対象としたコホートにおいて、[1]化学療法歴のない患者28例(日本人患者2例を含む)及び[2]化学療法歴のある患者69例(日本人患者11例を含む)に本剤1回400mgを1日2回経口投与した。主要評価項目である独立画像判定機関の評価による奏効率(RECIST ver 1.1基準に基づく)は、それぞれ[1]67.9%(95%信頼区間:47.6-84.1)及び[2]40.6%(95%信頼区間:28.9-53.1)であった2)。
副作用は、97例中87例(89.7%)に認められ、主な副作用は、末梢性浮腫52.6%(51/97例)、悪心37.1%(36/97例)、血中クレアチニン増加25.8%(25/97例)、嘔吐18.6%(18/97例)、疲労16.5%(16/97例)、食欲減退15.5%(15/97例)、下痢11.3%(11/97例)、リパーゼ増加11.3%(11/97例)及びALT増加10.3%(10/97例)であった。
18. 薬効薬理
18.1 作用機序
カプマチニブは、間葉上皮転換因子(MET)に対する阻害作用を有する低分子化合物であり、METのリン酸化を阻害し、下流のシグナル伝達を阻害することにより、腫瘍増殖抑制作用を示すと考えられている。
18.2 抗腫瘍効果
カプマチニブは、MET遺伝子エクソン14スキッピング変異を有する非小細胞肺癌患者由来腫瘍組織片を皮下移植した非肥満型糖尿病/重症複合型免疫不全マウスにおいて、腫瘍増殖抑制作用を示した13)(in vivo)。
19. 有効成分に関する理化学的知見
19.1. カプマチニブ塩酸塩水和物
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
<タブレクタ錠150mg>
28錠[14錠(PTP)×2]
<タブレクタ錠200mg>
28錠[14錠(PTP)×2]
23. 主要文献
- 社内資料:国内第I相試験(X1101試験)(2020年6月29日承認、CTD2.7.2-2.3.1)
- 社内資料:国際共同第II相試験(A2201試験)(2020年6月29日承認、CTD2.7.6-4.2.1)
- 社内資料:健康被験者での食事の影響に関する検討(X2107試験)(2020年6月29日承認、CTD2.7.1-2.1.2)
- 社内資料:血球分布と血漿タンパク結合率(2020年6月29日承認、CTD2.7.2-2.1.1)
- 社内資料:放射性標識体を用いたADME試験(2020年6月29日承認、CTD2.7.2-2.2.1)
- 社内資料:肝機能障害の影響(2020年6月29日承認、CTD2.7.2-2.3.8)
- 社内資料:リファンピシン及びイトラコナゾールとの薬物相互作用(2020年6月29日承認、CTD2.7.2-2.2.3)
- 社内資料:CYP3Aを介した薬物相互作用に関するシミュレーション(2020年6月29日承認、CTD2.7.2-3.3.1)
- 社内資料:ミダゾラム及びカフェインとの薬物相互作用(2020年6月29日承認、CTD2.7.2-2.3.6)
- 社内資料:ジゴキシン及びロスバスタチンとの薬物相互作用(2020年6月29日承認、CTD2.7.2-2.3.7)
- 社内資料:ラべプラゾールとの薬物相互作用(2020年6月29日承認、CTD2.7.2-2.2.2)
- 社内資料:代謝酵素及びトランスポーターに関する検討(2020年6月29日承認、CTD2.7.2-2.1)
- Baltschukat,S.et al., Clin.Cancer Res., 25 (10), 3164-3175, (2019) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金9:00〜17:30(祝日及び当社休日を除く)
製品情報問い合わせ先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金9:00〜17:30(祝日及び当社休日を除く)
26. 製造販売業者等
26.1 製造販売
ノバルティスファーマ株式会社
東京都港区虎ノ門1-23-1