医薬品情報
| 総称名 | マグコロール |
|---|---|
| 一般名 | クエン酸マグネシウム |
| 欧文一般名 | Magnesium citrate |
| 製剤名 | クエン酸マグネシウム散 |
| 薬効分類名 | 大腸検査・腹部外科手術前処置用下剤 |
| 薬効分類番号 | 7213 |
| ATCコード | A06AD19 B05CB03 |
| KEGG DRUG |
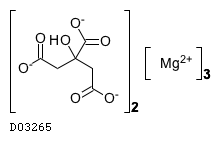
D03265
クエン酸マグネシウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| マグコロール散68%分包50g | MAGCOROL Powder | 堀井薬品工業 | 7213005B1028 | 377.4円/包 | 処方箋医薬品注) |
| マグコロール散68%分包100g | MAGCOROL Powder | 堀井薬品工業 | 7213005B2024 | 768.9円/包 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
○大腸検査(X線・内視鏡)前処置における腸管内容物の排除
○腹部外科手術時における前処置用下剤
6. 用法及び用量
<大腸X線検査前処置、腹部外科手術時における前処置の場合>
高張液投与
クエン酸マグネシウムとして、34g(本剤50g)を水に溶解し、全量約180mLとする。通常成人1回144〜180mLを検査予定時間の10〜15時間前に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
<大腸内視鏡検査前処置の場合>
高張液投与
クエン酸マグネシウムとして、34g(本剤50g)を水に溶解し、全量約180mLとする。通常成人1回144〜180mLを検査予定時間の10〜15時間前に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
等張液投与
クエン酸マグネシウムとして、68g(本剤100g)を水に溶解し、全量約1,800mLとする。通常成人1回1,800mLを検査予定時間の4時間以上前に200mLずつ約1時間かけて経口投与する。
なお、年齢、症状により適宜増減するが、2,400mLを越えての投与は行わない。
なお、年齢、症状により適宜増減するが、2,400mLを越えての投与は行わない。
7. 用法及び用量に関連する注意
7.1 等張液を投与する場合には、次の事項に注意すること。[8.1.2参照]
7.1.1 200mLを投与するごとに排便、腹痛等の状況を確認しながら、慎重に投与するとともに、腹痛等の消化器症状があらわれた場合は投与を中断し、腹部の診察や画像検査(単純X線、超音波、CT等)を行い、投与継続の可否について、慎重に検討すること。
7.1.2 1,800mLを投与しても排便がない場合は、投与を中断し、腹痛、嘔吐等がないことを確認するとともに、腹部の診察や画像検査(単純X線、超音波、CT等)を行い、投与継続の可否について、慎重に検討すること。
7.1.3 高齢者では特に時間をかけて投与すること。[9.8.1参照]
7.2 高張液を投与する場合には、次の事項に注意すること。
7.2.1 体内水分を吸収し脱水状態があらわれることがあるので、水分を十分に摂取させること。
8. 重要な基本的注意
8.1 まれに腸管穿孔、腸閉塞、虚血性大腸炎及び高マグネシウム血症を起こすことがある。腸管穿孔、腸閉塞及び虚血性大腸炎は腸管内容物の増大、蠕動運動の亢進による腸管内圧の上昇により発症し、高マグネシウム血症は、腸閉塞により本剤が腸管内に貯留しマグネシウムの吸収が亢進することにより発症するので、投与に際しては次の点に留意すること。[2.1、11.1.1-11.1.3参照]
8.1.1 患者の日常の排便の状況を確認し、本剤投与前日あるいは投与前にも通常程度の排便があったことを確認した後投与すること。
8.1.2 等張液を投与する場合には、短時間での投与は避けるとともに、腸管の狭窄あるいは便秘等で腸管内に内容物が貯留している場合には注意して投与すること。[7.1参照]
8.1.3 本剤の投与により排便があった後も腹痛、嘔吐が継続する場合には、腹部の診察や画像検査(単純X線、超音波、CT等)を行い、腸管穿孔等がないか確認すること。
8.2 自宅で服用させる場合には、次の点に留意すること。
8.2.1 患者の日常の排便の状況を確認させるとともに、前日あるいは服用前に通常程度の排便があったことを確認させ、排便がない場合は相談するよう指導すること。
8.2.2 副作用があらわれた場合、対応が困難な場合があるので、一人での服用は避けるよう指導すること。
8.2.3 嘔気、嘔吐、腹痛等の消化器症状やめまい、ふらつき、筋力低下、傾眠、血圧低下、皮膚潮紅等の本剤の副作用について事前に患者等に説明し、このような症状があらわれた場合は、直ちに受診する旨伝えること。また、服用後についても同様の症状があらわれた場合には、直ちに受診する旨伝えること。
8.3 薬剤の吸収に及ぼす影響
本剤による腸管洗浄が経口投与された薬剤の吸収を妨げる可能性があるので、投与時間等に注意すること。また、薬剤の吸収阻害が臨床上重大な問題となる薬剤を投与中の患者については、院内で十分観察しながら投与すること。
8.4 小腸の消化吸収を妨げ全身の栄養状態に影響を及ぼすことがあるので、連用を避けること。
8.5 排便に伴う腸管内圧の変動により、めまい、ふらつき、一過性の血圧低下等が発現することがあるので、十分に観察しながら投与すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心機能障害のある患者
血清マグネシウム濃度の上昇により心機能を抑制するおそれがある。
9.1.2 高マグネシウム血症の患者
血清マグネシウム濃度の上昇により症状を増悪するおそれがある。
9.1.3 胃切除の既往歴のある患者
一口ずつ時間をかけて服用させ、服用中にめまい、ふらつき等があらわれた場合には、直ちに服用を中止させること。ダンピング症候群があらわれることがある。
9.1.4 腹部外科手術の既往歴のある患者
術後の癒着がある場合、腸管内容物の増大や蠕動運動の亢進により、腸閉塞や腸管穿孔を起こすおそれがある。[11.1.1参照]
9.1.5 腸管狭窄及び高度な便秘の患者
腸管内容物の増大や蠕動運動の亢進により、腸閉塞や腸管穿孔を起こすおそれがある。[11.1.1参照]
9.1.6 腸管憩室のある患者
腸管穿孔を起こしたとの報告がある。
9.1.7 誤嚥を起こすおそれのある患者(高齢者、嚥下が困難な患者等)
誤嚥により、呼吸困難、肺炎を起こすことがある。
9.1.8 糖尿病用薬を投与中の患者
(1)本剤投与により血糖値が上昇したとの報告がある。本剤50g中に精製白糖10.5gを含有する。
(2)本剤投与に際して、糖尿病用薬を休薬した患者については、検査当日の食事摂取後より糖尿病用薬を投与すること。食事制限により低血糖を起こすおそれがある。
9.2 腎機能障害患者
投与しないこと。吸収されたマグネシウムの排泄が遅延し、血清マグネシウム濃度が上昇するおそれがある。また、多量の水分摂取は腎機能に負荷となり、症状を増悪するおそれがある。[2.3参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。子宮収縮を誘発して、流早産の危険性がある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等には投与しないことが望ましい。電解質異常等の副作用があらわれやすい。
9.8 高齢者
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 腸管穿孔、腸閉塞(いずれも頻度不明)
11.1.2 虚血性大腸炎(頻度不明)
11.1.3 高マグネシウム血症(頻度不明)
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、蕁麻疹、そう痒感等 | |||
| 消化器 | 腹部膨満感 | 腹痛、悪心、嘔吐、腹鳴等 | ||
| 循環器 | 熱感、潮紅、しびれ、顔面蒼白、血圧低下等 | |||
| 精神神経系 | めまい、ふらつき、脱力感、不快感等 | |||
| 内分泌 | 尿ケトン体の陽性化 | 尿酸値の上昇 | ||
| 肝臓 | 総ビリルビンの上昇 | AST、ALT、総コレステロールの上昇 | ||
| 腎・尿路系 | 尿pHの上昇 | BUNの低下、尿蛋白の陽性化 | ||
| 血液 | 白血球数の増加、単球数の増加・減少 | |||
| 代謝・電解質 | 血清マグネシウム上昇 | 血清カルシウム上昇・低下、血清ナトリウム上昇、血清カリウム上昇・低下、血清クロール低下 | 血清ナトリウム低下 |
12. 臨床検査結果に及ぼす影響
本剤投与により、尿pHがアルカリ性になることがあり、ブロムフェノールブルー系の試験紙法による尿蛋白試験で偽陽性を示すことがある。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 用時溶解して使用すること。
14.1.2 本剤の溶解液に他成分を添加しないこと。
14.2 薬剤投与時の注意
等張液投与は腸内残存水分が多いため注腸X線検査には適していない。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与(経口投与)
(1)高張液投与
健康成人男性5例にクエン酸マグネシウム34g(本剤50g)を水に溶解し、全量約180mLとした高張液を単回経口投与したときの薬物動態学的パラメーターを以下に示す。
| Cmax(mg/dL) | Tmax(hr) | AUC0-24(mg・hr/dL) |
| 2.58±0.28 | 4.20±4.49 | 58.26±4.94 |
(2)等張液投与
健康成人男性5例にクエン酸マグネシウム68g(本剤100g)を水に溶解し、全量約1,800mLとした等張液を単回経口投与したときの薬物動態学的パラメーターを以下に示す。
| Cmax(mg/dL) | Tmax(hr) | AUC0-48(mg・hr/dL) |
| 2.66±0.15 | 3.00±0.00 | 110.26±8.17 |
16.6 特定の背景を有する患者
大腸内視鏡検査を受ける患者34例に、本剤等張液1,800〜2,400mL(クエン酸マグネシウムとして68〜90g)を単回投与した時の血清マグネシウム濃度の変化及び尿中マグネシウム排泄量について、腎機能ならびに年齢による影響を検討した2)。
16.6.1 腎機能低下患者
Ccr70mL/min以上(70〜115)とCcr70mL/min未満(26〜69)の患者で比較した時、投与前後の血清マグネシウム濃度及び尿中マグネシウム排泄量を以下に示す。
| Ccr値(mL/min) | 血清マグネシウム(mg/dL) | ||||||
| 投与前 (平均) | 投与3時間後 | ||||||
| 不変 | 0.1上昇 | 0.2上昇 | 0.3上昇 | 0.4上昇 | 平均 | ||
| 70未満 (n=15) | 2.24±0.15 | 2例 | 4例 | 4例 (1) | 3例 | 2例 | 2.43±0.17 |
| 70以上 (n=19) | 2.23±0.11 | 0例 | 6例 | 9例 | 2例 | 2例 (2) | 2.43±0.13 |
| Ccr値(mL/min) | 尿中マグネシウム排泄量(mg) | |||
| 投与前日 14時〜2時 | 投与1日後 2時〜14時 | 投与2日後 2時〜14時 | 投与3日後 2時〜14時 | |
| 70未満 | 27±12.6 (n=13) | 63±24.9 (n=13) | 80±38.1 (n=13) | 47±16.5 (n=8) |
| 70以上 | 29±12.5 (n=16) | 72±37.7 (n=16) | 80±35.6 (n=16) | 62±39.8 (n=8) |
16.6.2 高齢者
65歳以上(66〜87歳)と65歳未満(38〜63歳)の患者で比較した時、投与前後の血清マグネシウム濃度及び尿中マグネシウム排泄量を以下に示す。
| 年齢 | 血清マグネシウム(mg/dL) | ||||||
| 投与前 (平均) | 投与3時間後 | ||||||
| 不変 | 0.1上昇 | 0.2上昇 | 0.3上昇 | 0.4上昇 | 平均 | ||
| 65歳未満 (n=20) | 2.24±0.11 | 0例 | 6例 | 6例 | 4例 | 4例 (2) | 2.47±0.13 |
| 65歳以上 (n=14) | 2.24±0.14 | 2例 | 4例 | 7例 (1) | 1例 | 0例 | 2.39±0.16 |
| 年齢 | 尿中マグネシウム排泄量(mg) | |||
| 投与前日 14時〜2時 | 投与1日後 2時〜14時 | 投与2日後 2時〜14時 | 投与3日後 2時〜14時 | |
| 65歳未満 | 25±9.7 (n=18) | 68±33.7 (n=18) | 72±38.5 (n=18) | 53±12.7 (n=9) |
| 65歳以上 | 33±15.0 (n=11) | 69±31.7 (n=11) | 92±29.0 (n=11) | 56±45.7 (n=7) |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(二重盲検並行群間比較試験)
大腸内視鏡検査の前処置において、本剤の等張液投与と高張液投与の大腸内洗浄効果を臨床的に比較検討した。評価は大腸部位別洗浄効果に基づき全般的有効度について行った。評価基準は、著効、有効、やや有効、無効の4段階評価とし、有効以上を有効率とした。その結果、有効率は等張液投与群87.5%(49例/56例)、高張液投与群61.5%(32例/52例)で、等張液の有効性が認められた。
副作用の発現頻度は、等張液投与群で8.8%(5例/57例)、高張液投与群で8.9%(5例/56例)であった。主な副作用症状としては、等張液投与群で腹部膨満感5例(8.8%)、腹痛、悪心が各1例(1.8%)、高張液投与群で腹部膨満感2例(3.6%)、腹痛、悪心が各3例(5.4%)、嘔気が1例(1.8%)であった3)。
副作用の発現頻度は、等張液投与群で8.8%(5例/57例)、高張液投与群で8.9%(5例/56例)であった。主な副作用症状としては、等張液投与群で腹部膨満感5例(8.8%)、腹痛、悪心が各1例(1.8%)、高張液投与群で腹部膨満感2例(3.6%)、腹痛、悪心が各3例(5.4%)、嘔気が1例(1.8%)であった3)。
18. 薬効薬理
18.1 作用機序
18.2 瀉下効果発現時間の比較
ラットを用い、高張液及び等張液(ともにクエン酸マグネシウムとして4.3g/kg)、並びに蒸留水(対照)を経口投与した。
その結果、50%瀉下効果発現時間は、高張液投与群では4.8時間、等張液投与群では2.6時間であり、対照群では48時間経過後も瀉下は認められなかった7)。
その結果、50%瀉下効果発現時間は、高張液投与群では4.8時間、等張液投与群では2.6時間であり、対照群では48時間経過後も瀉下は認められなかった7)。
19. 有効成分に関する理化学的知見
19.1. クエン酸マグネシウム
22. 包装
マグコロール散68%分包50g
ラミネート袋入り 10包
マグコロール散68%分包100g
パウチ入り 6包
23. 主要文献
- 厚生省薬務局企画課監修, 医薬品相互作用ハンドブック, (1992), (薬業時報社)
- 石川秀樹他, 新薬と臨牀, 49 (1), 88-100, (2000)
- 中村孝司他, 新薬と臨牀, 45 (3), 255-270, (1996)
- 熊谷 洋監修, 臨床薬理学大系, 8, 187, (1966), (中山書店)
- 羽野 寿, 新応用薬理学, 391, (1969), (永井書店)
- 上條一也他監訳, グッドマン・ギルマン薬理書 第5版, 1190-1191, (1980), (廣川書店)
- 社内資料:ラットを用いたマグコロールPの等張液と高張液経口投与における瀉下効果発現時間の比較
24. 文献請求先及び問い合わせ先
文献請求先
堀井薬品工業株式会社
安全性情報部
〒540-0038
大阪市中央区内淡路町1丁目2番6号
電話:06-6942-3487
FAX:06-6942-1505
製品情報問い合わせ先
堀井薬品工業株式会社
安全性情報部
〒540-0038
大阪市中央区内淡路町1丁目2番6号
電話:06-6942-3487
FAX:06-6942-1505
26. 製造販売業者等
26.1 製造販売元
堀井薬品工業株式会社
大阪市中央区内淡路町1丁目2番6号