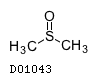医薬品情報
| 総称名 | ジムソ |
|---|---|
| 一般名 | ジメチルスルホキシド |
| 欧文一般名 | Dimethyl Sulfoxide |
| 製剤名 | ジメチルスルホキシド膀胱内注入液 |
| 薬効分類名 | 間質性膀胱炎治療剤 |
| 薬効分類番号 | 2590 |
| ATCコード | G04BX13 M02AX03 |
| KEGG DRUG |
D01043
ジメチルスルホキシド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年5月 改訂(第4版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジムソ膀胱内注入液50% | Zymso Intravesical Solution 50% | 杏林製薬 | 2590701X1027 | 11206.9円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
間質性膀胱炎(ハンナ型)の諸症状(膀胱に関連する慢性の骨盤部の疼痛、圧迫感及び不快感、尿意亢進又は頻尿等の下部尿路症状)の改善
5. 効能または効果に関連する注意
本剤を投与する際、十分な問診により臨床症状を確認するとともに、類似の症状を呈する疾患(尿路性器感染症、尿路結石、膀胱癌や前立腺癌などの下部尿路における新生物、過活動膀胱や前立腺肥大症等)があることに留意し、膀胱内視鏡、尿検査等により除外診断を実施すること。その上で、膀胱内視鏡検査によりハンナ病変が認められ、間質性膀胱炎(ハンナ型)の確定診断を受けた患者にのみ投与すること。
6. 用法及び用量
通常、成人には50%(w/w)ジメチルスルホキシド溶液を1回あたり1バイアル50mL(ジメチルスルホキシドとして27g)、2週間間隔で6回膀胱内に注入する。なお、膀胱内注入後、可能な限り15分間以上膀胱内に保持してから排出させる。
7. 用法及び用量に関連する注意
本剤による再治療は、本剤の治療により症状が改善した後、一定期間経過して治療を要する程度にまで症状が悪化した場合にのみ行うこと。
8. 重要な基本的注意
投与時反応(膀胱痛、尿道痛、膀胱刺激症状、膀胱不快感等)があらわれることがあるため、必要に応じて、本剤投与前に局所麻酔剤の膀胱内注入を行った上で投与すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のヒト乳汁中への移行は不明であるが、本剤の分子量は小さく、かつ血漿タンパク結合率が低いため、乳汁中に移行する可能性がある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 10%以上 | 5〜10%未満 | 5%未満 | |
| 泌尿器 | 膀胱痛(30.6%)、尿道痛、膀胱刺激症状 | 膀胱不快感、頻尿 | 排尿困難 |
| その他 | 呼気臭・皮膚臭異常(ニンニク様の臭い) |
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
日本人健康成人男性6例に本剤50mLを単回膀胱内投与したときの血漿中ジメチルスルホキシド濃度は、6例中5例において定量下限(19.6μg/mL)未満であった。定量下限を超えた1例は、投与後15分に最高血漿中濃度(72.1μg/mL)に達し、5.46時間のt1/2で消失した5)。
16.2 吸収
日本人健康成人男性6例に本剤50mLを単回膀胱内投与した後に膀胱から回収した投与残液には、投与液中に含まれるジメチルスルホキシドの83.7%(6例の平均値)が存在しており、16.3%が膀胱から体内へ吸収されたと考えられた5)。
16.3 分布
本剤のヒト血漿タンパク結合率は30%であった6)(in vitro)。
16.4 代謝
10%ジメチルスルホキシドを静脈内持続投与注)したときのヒトの血漿及び尿中には、ジメチルスルホン及びジメチルスルフィドが存在した7)。
注)本剤の承認された用法・用量は「1回あたり1バイアル50mL(ジメチルスルホキシドとして27g)、2週間間隔で6回膀胱内に注入する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
日本人間質性膀胱炎患者注1)96例を対象に、本剤又はプラセボ50mLを2週間に1回、計6回膀胱内注入注2)して有効性及び安全性を評価する無作為化、二重盲検、プラセボ対照、並行群間比較試験を実施した。主な組入れ基準は、1回排尿量50mL以上、残尿量100mL未満、1日排尿量3,000mL未満、1日平均排尿回数が8回以上、膀胱痛のNRS注3)が4以上、O’Leary&Sant間質性膀胱炎症状スコア(ICSI)が9点以上とした。主要評価項目である投与12週のICSIの変化量は表1のとおりであり、全体集団において本剤群はプラセボ群に対して有意な減少を認めた8)。また、病型別の部分集団における投与12週のICSIの変化量は表2のとおりであり、ハンナ型の部分集団における本剤群とプラセボ群の群間差は全体集団の結果と同程度であった。
全体集団における副作用発現頻度は、本剤投与群で59.2%(29/49例)であり、主な副作用は膀胱痛30.6%(15/49例)、尿道痛12.2%(6/49例)、膀胱刺激症状10.2%(5/49例)、膀胱不快感及び頻尿8.2%(4/49例)であった。
全体集団における副作用発現頻度は、本剤投与群で59.2%(29/49例)であり、主な副作用は膀胱痛30.6%(15/49例)、尿道痛12.2%(6/49例)、膀胱刺激症状10.2%(5/49例)、膀胱不快感及び頻尿8.2%(4/49例)であった。
| 投与群 | 例数 | ベースラインa) | 変化量b) | 群間差b) | P値 |
| 本剤50mL | 49例 | 13.9±3.1 | −5.2(−6.2,−4.2) | −1.8(−3.3,−0.3) | 0.0188 |
| プラセボ50mL | 47例 | 13.7±3.1 | −3.4(−4.5,−2.4) |
| 病型 | 投与群 | 例数 | ベースラインa) | 変化量b) | 群間差b) |
| ハンナ型 | 本剤50mL | 42例 | 13.9±3.2 | −5.6(−6.7,−4.4) | −2.2(−3.8,−0.6) |
| プラセボ50mL | 41例 | 13.8±3.2 | −3.4(−4.5,−2.2) | ||
| 非ハンナ型注4) | 本剤50mL | 7例 | 13.7±3.1 | −2.9(−5.4,−0.3) | 0.9(−2.8,4.7) |
| プラセボ50mL | 6例 | 13.2±2.7 | −3.8(−6.5,−1.1) |
注1)膀胱内視鏡検査でハンナ病変がある患者(ハンナ型)又はハンナ病変はないが点状出血のある患者(非ハンナ型)
注2)投与前処置として全例で局所麻酔剤の膀胱内投与を行った。
注3)Numerical Rating Scale(数値評価スケール)
注4)本剤の承認された効能・効果は「間質性膀胱炎(ハンナ型)の諸症状の改善」である。
18. 薬効薬理
18.1 作用機序
間質性膀胱炎に対するジメチルスルホキシドの作用機序は十分に解明されていないが、炎症抑制及び鎮痛等の関与が考えられている。
18.2 抗炎症作用
18.2.1 ラット硫酸プロタミン誘発間質性膀胱炎モデルにおいて、50%ジメチルスルホキシドの膀胱内投与は膀胱組織の浮腫及び血管充血を抑制した9)。
18.2.2 URO-OVAトランスジェニックマウスを用いた急性膀胱炎症モデルにおいて、50%ジメチルスルホキシドの膀胱内投与(3回/週)は膀胱組織の炎症及び浮腫を抑制し、膀胱炎症組織のCD8+ T細胞の浸潤、IFN-γ、MCP-1、NGF、TNF-α及びIL-6のmRNA増加を抑制した10)。
18.2.3 URO-OVA/OT-Iトランスジェニックマウスを用いた慢性膀胱炎症モデルにおいて、50%ジメチルスルホキシドの膀胱内投与(1回/週、3週)は膀胱組織の炎症及び浮腫を抑制した。このトランスジェニックマウスにナイーブT細胞を移入して生じる重篤な急性膀胱炎症は、ジメチルスルホキシドの膀胱内最終投与7日後に細胞移入しても観察されなかった。また、in vitroでジメチルスルホキシドはエフェクターT細胞の増殖を抑制し、アポトーシスを増加させた10)。これらのことから、ジメチルスルホキシド投与による内因性自己免疫OT-I CD8+ T細胞の除去が推察された。
18.3 鎮痛作用
除脳ラットにおいて、50%ジメチルスルホキシドの膀胱内投与は膀胱拡張に伴う脊髄後角の神経活動の増大(侵害反応)を抑制した11)。
19. 有効成分に関する理化学的知見
19.1. ジメチルスルホキシド
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
50mL[1バイアル]
23. 主要文献
- OECD SIDS.DMSO(Cas No.67-68-5), 225-237, (2000), ((Last update:2008))
- Caujolle,F.M.E.,et al., Ann.N.Y.Acad.Sci., 141, 110-125, (1967) »PubMed
- Noel,P.R.B.et al., Toxicology., 3, 143-169, (1975) »PubMed
- 大谷幹伸,他, 日泌尿会誌, 83, 1423-1428, (1992) »DOI
- Shimada,H.et al., Low.Urin.Tract Symptoms., 12, 150-154, (2020) »PubMed
- Gerhards,E.et al., Ann.N.Y.Acad.Sci., 141, 65-76, (1967) »PubMed
- Egorin.M.J.et al., J.Clin.Oncol., 16, 610-615, (1998)
- 社内資料:第III相検証的試験(2021年1月22日承認、CTD2.7.3.2)
- Soler,R.et al., Int.Braz.J.Urol., 34, 503-511, (2008) »PubMed
- Kim,R.et al., J.Biomed.Biotechnol., 2011, 937061, (2011) »PubMed
- Castroman,P.J.et al., J.Pain., 3, 394-400, (2002) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
杏林製薬株式会社
くすり情報センター
〒160-0017
東京都新宿区左門町20番地
電話:0120-409-341 受付時間 9:00〜17:30(土・日・祝日・会社休日を除く)
製品情報問い合わせ先
杏林製薬株式会社
くすり情報センター
〒160-0017
東京都新宿区左門町20番地
電話:0120-409-341 受付時間 9:00〜17:30(土・日・祝日・会社休日を除く)
26. 製造販売業者等
26.1 製造販売元
杏林製薬株式会社
東京都千代田区大手町一丁目3番7号