医薬品情報
| 総称名 | ヴァイトラックビ |
|---|---|
| 一般名 | ラロトレクチニブ硫酸塩 |
| 欧文一般名 | Larotrectinib Sulfate |
| 製剤名 | ラロトレクチニブ硫酸塩カプセル・ラロトレクチニブ硫酸塩内用液 |
| 薬効分類名 | 抗悪性腫瘍剤 トロポミオシン受容体キナーゼ阻害剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01EX12 |
| KEGG DRUG |
D11138
ラロトレクチニブ硫酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年5月 改訂(第10版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ヴァイトラックビカプセル25mg | VITRAKVI capsules 25mg | バイエル薬品 | 4291071M1029 | 4042.5円/カプセル | 劇薬, 処方箋医薬品注) |
| ヴァイトラックビカプセル100mg | VITRAKVI capsules 100mg | バイエル薬品 | 4291071M2025 | 14542.9円/カプセル | 劇薬, 処方箋医薬品注) |
| ヴァイトラックビ内用液20mg/mL | VITRAKVI oral solution 20mg/mL | バイエル薬品 | 4291071S1028 | 2908.6円/mL | 劇薬, 処方箋医薬品注) |
1. 警告
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に本剤の有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
NTRK融合遺伝子陽性の進行・再発の固形癌
5. 効能または効果に関連する注意
5.1 十分な経験を有する病理医又は検査施設における検査により、NTRK融合遺伝子陽性が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.2 本剤の手術の補助療法における有効性及び安全性は確立していない。
6. 用法及び用量
通常、成人にはラロトレクチニブとして1回100mgを1日2回経口投与する。なお、患者の状態により適宜減量する。
通常、小児にはラロトレクチニブとして1回100mg/m2(体表面積)を1日2回経口投与する。ただし、1回100mgを超えないこと。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.1 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2 原則として、経口液剤はカプセル剤の投与が困難な場合に使用し、カプセル剤と経口液剤の切換えを行う場合には患者の状態をより慎重に観察すること。[16.2.3参照]
7.3 本剤投与により副作用が発現した場合には、以下の基準を考慮して休薬・減量・中止すること。
| 用量調節段階 | 成人及び体表面積が1.0m2以上の小児の投与量 | 体表面積が1.0m2未満の小児の投与量 |
| 1段階減量 | 1回75mgを1日2回経口投与 | 1回75mg/m2(体表面積)を1日2回経口投与 |
| 2段階減量 | 1回50mgを1日2回経口投与 | 1回50mg/m2(体表面積)を1日2回経口投与 |
| 3段階減量 | 1回100mgを1日1回経口投与 | 1回25mg/m2(体表面積)を1日2回経口投与※2 |
| 程度 | 処置 |
| グレード2 | 慎重に経過観察し、休薬・減量を考慮する。 |
| グレード3又は4 | ベースライン又はグレード1以下に回復するまで休薬する。 ・4週間以内に回復した場合は、1段階減量して投与を再開できる。 ・4週間以内に回復しなかった場合は、投与を中止する。 |
8. 重要な基本的注意
8.1 肝機能障害があらわれることがあるので、本剤投与開始前及び投与中は定期的に肝機能検査を行い、患者の状態を十分に観察すること。[11.1.1参照]
8.2 骨髄抑制があらわれることがあるので、本剤投与開始前及び投与中は定期的に血液検査を行い、患者の状態を十分に観察すること。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 中等度以上の肝機能障害患者(Child-Pugh分類B又はC)
減量を考慮するとともに、患者の状態をより慎重に観察し、副作用の発現に十分注意すること。本剤の血漿中濃度が上昇し、副作用が増強されるおそれがある。[16.6.2参照]
9.4 生殖能を有する者
妊娠可能な女性には、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。乳汁移行に関するデータはないが、本剤はBCRPの基質であるため、乳汁移行の可能性がある。[15.2参照]
10. 相互作用
相互作用序文
本剤は、主にCYP3Aによって代謝される。また、CYP3Aに対して弱い阻害作用を示す。
薬物代謝酵素用語
CYP3A
10.2 併用注意
| 強力な又は中程度のCYP3A阻害剤 イトラコナゾール、クラリスロマイシン、ボリコナゾール等 グレープフルーツ含有食品 [16.7.1、16.7.2参照] | 本剤の副作用が増強されるおそれがあるので、これらの薬剤との併用は可能な限り避け、やむを得ず併用する場合には本剤の減量を考慮するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | これらの薬剤がCYP3Aを阻害することにより、本剤の血漿中濃度が上昇する可能性がある。 |
| 強力な又は中程度のCYP3A誘導剤 リファンピシン、フェニトイン、フェノバルビタール等 セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品 [16.7.3、16.7.4参照] | 本剤の有効性が減弱するおそれがあるので、これらの薬剤との併用は可能な限り避けること。 | これらの薬剤がCYP3Aを誘導することにより、本剤の血漿中濃度が低下する可能性がある。 |
| CYP3Aの基質となる薬剤 シクロスポリン、キニジン、タクロリムス等 [16.7.5参照] | これらの薬剤の副作用が増強されるおそれがあるので、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤がCYP3Aを阻害することにより、これらの薬剤の血漿中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害
ALT増加(28.0%)、AST増加(23.3%)等を伴う肝機能障害があらわれることがある。[8.1参照]
11.1.2 骨髄抑制
好中球減少(10.6%)、白血球減少(9.0%)、貧血(7.9%)、血小板減少(4.2%)、リンパ球減少(3.7%)等の骨髄抑制があらわれることがある。[8.2参照]
11.1.3 中枢神経系障害
浮動性めまい(17.5%)、錯感覚(2.6%)、歩行障害(1.6%)、運動失調(0.5%)、認知障害(0.5%)等があらわれることがある。
11.2 その他の副作用
| 5%以上 | 5%未満 | |
| 胃腸障害 | 悪心(10.6%)、便秘(10.1%)、味覚異常、嘔吐、下痢 | |
| 筋骨格系および結合組織障害 | 筋肉痛 | 筋力低下 |
| 一般・全身障害および投与部位の状態 | 疲労(14.3%)、浮腫 | |
| 神経系障害 | 頭痛 | |
| 皮膚および皮下組織障害 | 発疹 | |
| その他 | 体重増加 | Al-P増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
<内用液>
14.1.1 凍結を避け、2〜8℃で保存すること。
14.1.2 開封後30日以内に使用すること。
14.2 薬剤投与時の注意
<カプセル>
14.2.1 カプセルは開けたり、噛んだり、つぶしたりせず、そのまま多めの水で服用すること。
<内用液>
14.2.2 ピペットを用いて経口投与する。なお、経鼻又は胃栄養チューブを介して投与することもできる。
15. その他の注意
15.2 非臨床試験に基づく情報
幼若ラットにおいて、本剤を生後7日から反復経口投与した場合、生後9〜16日の間に小児患者の臨床曝露量に対して雄は2.5倍、雌は0.7倍で死亡がみられたことが報告されている。頭部傾斜及び平衡不全が認められた後に死亡した幼若ラットが認められたため、中枢神経系に対する本剤の影響が死亡に至る重篤な状態悪化に関連している可能性がある。[9.6参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人男性に、本剤100、200又は400mg(カプセル剤)を空腹時に単回経口投与注)したときのラロトレクチニブの血漿中濃度推移及びPKパラメータは以下のとおりであった。AUC及びCmaxは400mgまでの範囲で概ね用量に比例した増加を示した。
| 投与量(mg) | n | Cmax(μg/L) | tmax※(h) | AUC(μg・h/L) | t1/2(h) |
| 100 | 6 | 548(33.2) | 1.00(1.0-3.0) | 1220(23.9) | 1.88(14.8) |
| 200 | 6 | 1250(47.3) | 1.25(1.0-3.0) | 3280(33.8) | 2.55(18.6) |
| 400 | 6 | 2730(35.1) | 1.00(0.5-4.0) | 7210(42.2) | 2.78(14.1) |
16.1.2 反復投与
進行固形癌患者に、本剤100、150又は200mg(カプセル剤)を1日2回反復経口投与注)したときのラロトレクチニブのPKパラメータは以下のとおりであった。血漿中ラロトレクチニブ濃度は投与8日目までに定常状態に達した。本剤100mgを1日2回反復経口投与した際の投与8日目におけるラロトレクチニブの蓄積率は1.11であった(外国人データ)。
| 投与量(mg) | 測定日 | n | Cmax(μg/L) | tmax※1(h) | AUC12h(μg・h/L) | t1/2(h) |
| 100 | 第1日目 | 39 | 868(86.6) | 0.750(0.250-2.05) | 2040(92.6) | 1.68(32.3) |
| 第8日目 | 37 | 788(80.6) | 1.00(0.500-9.37) | 2180(97.2) | 2.73(50.8)※2 | |
| 150 | 第1日目 | 7 | 923(51.6) | 0.920(0.530-1.00) | 2240(47.0) | 1.55(16.0) |
| 第8日目 | 6 | 815(52.0) | 0.760(0.500-2.00) | 2370(59.6) | 2.16(39.5)※3 | |
| 200 | 第1日目 | 6 | 1210(122) | 0.760(0.500-1.95) | 3760(114)※4 | 1.67(25.6)※4 |
| 第8日目 | 6 | 929(175) | 1.03(0.500-4.00) | 3040(118) | 2.67(49.3)※5 |
16.2 吸収
16.2.1 バイオアベイラビリティ
健康成人6例に、本剤100mg(カプセル剤)を単回経口投与したときの絶対的バイオアベイラビリティは32〜37%であった(外国人データ)。
16.2.2 食事の影響
健康成人18例に、本剤100mg(カプセル剤)を単回経口投与したとき、空腹時投与に対する高脂肪食後投与におけるラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ0.656及び1.08であった(外国人データ)。
16.2.3 カプセル剤に対する液剤の相対的バイオアベイラビリティ
健康成人18例に、本剤100mg(液剤)を単回経口投与したとき、カプセル剤投与に対する液剤投与におけるラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.36及び1.04であった(外国人データ)。[7.2参照]
16.3 分布
16.3.1 分布容積
健康成人6例に、ラロトレクチニブ100mg単回経口投与1時間後に[14C]ラロトレクチニブ約7.58μgを単回静脈内投与したとき、ラロトレクチニブの分布容積は48Lであった(外国人データ)。
16.3.2 タンパク結合率
In vitro試験において、ラロトレクチニブのヒト血漿タンパク結合率は、約70%であった。
16.3.3 血液/血漿中濃度比
In vitro試験において、ラロトレクチニブの血液/血漿中濃度比は、約0.9であった。
16.4 代謝
In vitro試験において、ラロトレクチニブの代謝は主にCYP3A4/5が関与することが示された。
健康成人6例に、[14C]ラロトレクチニブ100mgを単回経口投与したとき、投与24時間後までの血漿中に主に未変化体及びo-グルクロン酸抱合体(ヒドロキシピロリジン−尿素部分の消失後に生成)が検出された(血漿中の総放射能AUCに対する割合は、それぞれ19及び26%)(外国人データ)。
健康成人6例に、[14C]ラロトレクチニブ100mgを単回経口投与したとき、投与24時間後までの血漿中に主に未変化体及びo-グルクロン酸抱合体(ヒドロキシピロリジン−尿素部分の消失後に生成)が検出された(血漿中の総放射能AUCに対する割合は、それぞれ19及び26%)(外国人データ)。
16.5 排泄
健康成人6例に、[14C]ラロトレクチニブ100mgを単回経口投与したとき、投与312時間後までに投与した放射能の58及び39%がそれぞれ糞中及び尿中に排泄された(外国人データ)。また、投与48時間後までに投与した放射能の20%が未変化体として尿中に排泄された(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
本剤100mgを単回経口投与したとき、腎機能が正常な被験者(8例)に対する血液透析を必要とする末期腎疾患を有する患者(8例)のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.25及び1.40であった(外国人データ)。
16.6.2 肝機能障害患者
本剤100mgを空腹時に単回経口投与したとき、肝機能が正常な被験者(11例)に対する軽度(Child-Pugh分類A)の肝機能障害患者(8例)のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.14及び1.31であった。肝機能が正常な被験者(11例)に対する中等度(Child-Pugh分類B)の肝機能障害患者(8例)のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.14及び1.98であった。肝機能が正常な被験者(11例)に対する重度(Child-Pugh分類C)の肝機能障害患者(8例)のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.52及び3.19であった(外国人データ)。[9.3.1参照]
16.6.3 小児
生後1ヵ月以上21歳以下の進行固形癌患者又は中枢神経系原発腫瘍患者15例に、本剤100mg/m2(最大100mg)(液剤又はカプセル剤)を1日2回反復経口投与したときのラロトレクチニブのPKパラメータは以下のとおりであった。小児患者のCmax及びAUCは、本剤100mgを1日2回反復経口投与された成人患者と同程度であった(外国人データ)。
| 測定日 | n | Cmax(μg/L) | tmax※1(h) | AUC12h(μg・h/L) | t1/2(h) |
| 第1サイクル 第1日目 | 15 | 867(51.1) | 1.00(0.03-2.22) | 2220(76.4) | 2.12(35.9)※2 |
| 第4サイクル 第1日目 | 6 | 854(43.9) | 0.500(0.480-1.98) | 1470(28.1) | 2.30(15.4)※3 |
16.7 薬物相互作用
16.7.1 イトラコナゾール
健康成人12例に、イトラコナゾール(強力なCYP3A阻害剤)200mgを1日1回7日間反復経口投与し、本剤100mgを単回経口投与したとき、本剤単独投与時に対するイトラコナゾール併用投与時のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ2.81及び4.33であった(外国人データ)。[10.2参照]
16.7.2 フルコナゾール、ジルチアゼム
生理学的薬物動態モデルに基づいたシミュレーションにおいて、癌患者での本剤(100mgを1日2回投与)単独投与時に対するフルコナゾール(中程度のCYP3A阻害剤)(400mg投与後に200mgを1日1回投与)併用時のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.86及び2.72であった。また、癌患者での本剤(100mgを1日2回投与)単独投与時に対するジルチアゼム(中程度のCYP3A阻害剤)(60mgを1日3回投与)併用時のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.78及び2.55であった。[10.2参照]
16.7.3 リファンピシン(反復投与)
健康成人12例にリファンピシン(強力なCYP3A誘導剤)600mgを1日1回11日間反復経口投与し、本剤100mgを単回経口投与したとき、本剤単独投与時に対するリファンピシン併用投与時のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ0.293及び0.192であった(外国人データ)。[10.2参照]
16.7.4 エファビレンツ
生理学的薬物動態モデルに基づいたシミュレーションにおいて、癌患者での本剤(100mgを1日2回投与)単独投与時に対するエファビレンツ(中程度のCYP3A誘導剤)(600mgを1日1回投与)併用時のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ0.40及び0.28であった。[10.2参照]
16.7.5 ミダゾラム
健康成人16例に本剤100mgを1日2回10日間反復経口投与し、ミダゾラム(CYP3Aの基質)2mgを単回経口投与したとき、ミダゾラム単独投与時に対する本剤併用投与時のミダゾラムのCmax及びAUClastの幾何平均値の比は、それぞれ1.68及び1.77であった(外国人データ)。[10.2参照]
16.7.6 その他
In vitro試験において、ラロトレクチニブは、P-gp及びBCRPの基質であることが示された。
健康成人12例にリファンピシン(P-gp及びBCRP阻害剤)600mgを単回経口投与し、本剤100mgを単回経口投与したとき、本剤単独投与時に対するリファンピシン併用投与時のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.79及び1.68であった(外国人データ)。
健康成人12例にリファンピシン(P-gp及びBCRP阻害剤)600mgを単回経口投与し、本剤100mgを単回経口投与したとき、本剤単独投与時に対するリファンピシン併用投与時のラロトレクチニブのCmax及びAUClastの幾何平均値の比は、それぞれ1.79及び1.68であった(外国人データ)。
注)本剤の承認用法及び用量は、成人にはラロトレクチニブとして1回100mgを1日2回経口投与、小児には1回100mg/m2(体表面積)を1日2回経口投与(ただし、1回100mgを超えない)である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第II相試験
12歳以上のNTRK融合遺伝子陽性の進行・再発の固形癌患者を対象とした国際共同第II相試験において、NTRK融合遺伝子陽性の進行・再発の固形癌患者116例(うち日本人3例)に本剤100mgを1日2回経口投与した結果、有効性解析集団におけるRECIST ver.1.1に基づく独立評価判定による奏効率は65.2%(58/89※例)(80%信頼区間:57.9〜71.9%)であった。
注)独立評価判定により15例(16.9%)が完全奏効と判定され、うち1例は外科的処置を受け病理学的完全奏効が確認された。
※:NTRK融合遺伝子が検出された検査機関のCLIA認証取得の有無が未確認であった2例(甲状腺癌及び膵癌)を含む
| 癌腫 | 奏効例数/評価可能例数 | 奏効率(%)(80%信頼区間) |
| 非小細胞肺癌 | 7/9 | 77.8(51.0、93.9) |
| 甲状腺癌 | 13/19 | 68.4(51.1、82.5) |
| 肉腫 | 15/19 | 78.9(62.2、90.5) |
| 結腸直腸癌 | 3/8 | 37.5(14.7、65.5) |
| 唾液腺癌 | 14/16 | 87.5(70.0、96.6) |
| 胆道癌 | 0/2 | 0※1 |
| 中枢神経系原発腫瘍 | 1/7 | 14.3(1.5、45.3)※2 |
| 固形癌 | 6/14 | 42.9(24.3、63.1) |
副作用発現頻度は、81.9%(95/116例)であった。主な副作用は、浮動性めまい32例(27.6%)、ALT増加31例(26.7%)、AST増加27例(23.3%)、疲労22例(19.0%)、体重増加14例(12.1%)、筋肉痛13例(11.2%)、便秘12例(10.3%)、悪心12例(10.3%)であった。[5.3参照]
17.1.2 国際共同第I/II相試験
21歳以下の進行・再発の固形癌患者を対象とした国際共同第I/II相試験において、73例に本剤100mg/m2を1日2回経口投与(ただし、1回100mgを超えない)した。第II相パートで有効性解析集団としたNTRK融合遺伝子陽性患者36例において、RECIST ver.1.1に基づく独立評価判定による奏効率は88.9%(32/36例)(95%信頼区間:73.9〜96.9%)であった。
注)独立評価判定により8例(22.2%)が完全奏効と判定された。独立評価判定により部分奏効と判定された24例(66.7%)のうち4例及び安定と判定された3例(8.3%)のうち1例は外科的処置を受け病理学的完全奏効が確認された。
| 癌腫 | 奏効例数/評価可能例数 | 奏効率(%)(95%信頼区間) |
| 乳児線維肉腫 | 22/22 | 100.0(84.6、100.0) |
| 軟部肉腫 | 8/11 | 72.7(39.0、94.0) |
| 中枢神経系原発腫瘍 | 3/8 | 37.5(8.5、75.5)※1 |
| 骨肉腫 | 1/1 | 100.0※2 |
| 先天性間葉芽腎腫 | 1/1 | 100.0※2 |
| 悪性黒色腫 | 0/1 | 0※2 |
副作用発現頻度は、66%(48/73例)であった。主な副作用は、ALT増加22例(30%)、AST増加17例(23%)、好中球減少16例(22%)、白血球減少10例(14%)、貧血9例(12%)、悪心8例(11%)、血中ALP増加7例(10%)、便秘7例(10%)であった。[5.3参照]
18. 薬効薬理
18.1 作用機序
ラロトレクチニブは、NTRK遺伝子がコードするトロポミオシン受容体キナーゼ(TRK)ファミリータンパクのチロシンキナーゼに対する阻害作用を有する低分子化合物である。ラロトレクチニブは、TRK融合タンパクのリン酸化を阻害し、下流のシグナル伝達分子のリン酸化を阻害することにより、腫瘍増殖抑制作用を示すと考えられている。
18.2 抗腫瘍効果
ラロトレクチニブは、in vitroにおいて、TRK融合タンパクを発現するヒト非小細胞肺癌由来CUTO-3.29細胞株、ヒト結腸・直腸癌由来KM12細胞株等に対して増殖抑制作用を示した。また、ラロトレクチニブは、in vivoにおいて、KM12、CUTO-3.29細胞株等を皮下移植したヌードマウスにおいて、腫瘍増殖抑制作用を示した。
19. 有効成分に関する理化学的知見
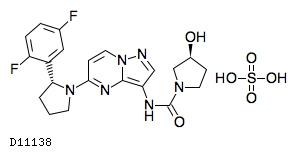
19.1. ラロトレクチニブ硫酸塩
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
<ヴァイトラックビカプセル25mg>
56カプセル[プラスチックボトル、バラ]
<ヴァイトラックビカプセル100mg>
28カプセル[プラスチックボトル、バラ]
56カプセル[プラスチックボトル、バラ]
<ヴァイトラックビ内用液20mg/mL>
50mL[1瓶]
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
バイエル薬品株式会社
メディカルインフォメーション
〒530-0001
大阪市北区梅田二丁目4番9号
文献請求先
製品情報問い合わせ先
バイエル薬品株式会社
電話:0120-106-398
バイエル医療用医薬品のお問い合わせ先
26. 製造販売業者等
26.1 製造販売元
バイエル薬品株式会社
大阪市北区梅田二丁目4番9号