医薬品情報
| 総称名 | タズベリク |
|---|---|
| 一般名 | タゼメトスタット臭化水素酸塩 |
| 欧文一般名 | Tazemetostat Hydrobromide |
| 製剤名 | タゼメトスタット臭化水素酸塩製剤 |
| 薬効分類名 | 抗悪性腫瘍剤(EZH2阻害剤) |
| 薬効分類番号 | 4291 |
| ATCコード | L01XX72 |
| KEGG DRUG |
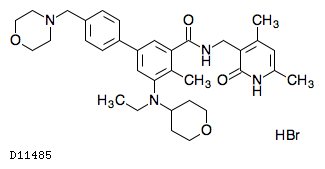
D11485
タゼメトスタット臭化水素酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第6版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タズベリク錠200mg | Tazverik tablets | エーザイ | 4291073F1029 | 3004円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
本剤は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。また、本剤による治療開始に先立ち、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
再発又は難治性のEZH2遺伝子変異陽性の濾胞性リンパ腫(標準的な治療が困難な場合に限る)
5. 効能または効果に関連する注意
5.1 十分な経験を有する病理医又は検査施設により、EZH2遺伝子変異陽性が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.2 本剤による治療は、少なくとも2つの標準的な治療が無効又は治療後に再発した患者を対象とすること。
6. 用法及び用量
通常、成人にはタゼメトスタットとして1回800mgを1日2回経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.1 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2 本剤の投与中に副作用が発現した場合は、以下の基準を参考に、本剤を休薬、減量又は中止すること。[11.1.1参照]
| 段階 | 投与量 |
| 通常投与量 | 1回800mgを1日2回 |
| 1段階減量 | 1回600mgを1日2回 |
| 2段階減量 | 1回400mgを1日2回 |
| 3段階減量 | 投与中止 |
| 副作用 | 程度* | 処置 |
| 好中球減少 | 好中球数750/mm3未満 | 好中球数750/mm3以上に回復するまで休薬する。回復後は1段階減量して再開することができる。 |
| 上記以外の副作用 | 以下のいずれかの場合(ただし、臨床的に意義のない臨床検査値異常を除く) ・忍容性がないGrade 2 ・Grade 3 | Grade 1以下又はベースラインに回復するまで休薬する(ただし、悪心、嘔吐、下痢の場合は、適切な処置を行い、コントロールできない場合に休薬する)。 回復後は1段階減量して再開することができる。 |
| Grade 4(生命を脅かさない臨床検査値異常の場合は、Grade 3の副作用と同じ処置とする) | 投与を中止する。 |
8. 重要な基本的注意
骨髄抑制があらわれることがあるので、本剤の投与開始前及び投与期間中は定期的に血液学的検査を行うなど、患者の状態を十分に観察すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 中等度以上の肝機能障害のある患者
本剤は主に肝臓で代謝されるため、中等度以上の肝機能障害のある患者では本剤の血中濃度が上昇する可能性がある。なお、中等度以上(National Cancer Institute-Organ Dysfunction Working Group(NCI-ODWG)基準)の肝機能障害のある患者を対象とした臨床試験は実施していない。
9.4 生殖能を有する者
妊娠可能な女性に対しては、本剤の投与期間中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は主として薬物代謝酵素CYP3A4で代謝され、CYP3A4を誘導する。また、本剤はCYP2C8の阻害作用を有する。[16.4参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2C8
10.2 併用注意
| CYP3A阻害剤 イトラコナゾール フルコナゾール クラリスロマイシン 等 グレープフルーツジュース [16.7.1、16.7.2参照] | 本剤の副作用が増強されるおそれがあるので、CYP3A阻害作用のない薬剤への代替を考慮し、併用は可能な限り避けること。やむを得ず併用する場合には、本剤の減量を考慮するとともに、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | これらの薬剤等がCYP3Aを阻害することにより、本剤の血中濃度が上昇する可能性がある。 |
| CYP3A誘導剤 リファンピシン フェニトイン カルバマゼピン 等 セイヨウオトギリソウ(St.John's Wort:セント・ジョーンズ・ワート)含有食品 [16.7.3参照] | 本剤の効果が減弱するおそれがあるので、CYP3A誘導作用のない薬剤への代替を考慮すること。 | これらの薬剤等がCYP3Aを誘導することにより、本剤の血中濃度が低下する可能性がある。 |
| CYP3Aの基質となる薬剤 ミダゾラム 経口避妊薬(エチニルエストラジオール等) トリアゾラム 等 [16.7.4参照] | これらの薬剤の効果が減弱するおそれがある。 | 本剤がCYP3Aを誘導することにより、これらの薬剤の血中濃度が低下する可能性がある。 |
| CYP2C8の基質となる薬剤 レパグリニド モンテルカスト ピオグリタゾン 等 [16.7.5参照] | これらの薬剤の副作用が増強されるおそれがあるので、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | 本剤がCYP2C8を阻害することにより、これらの薬剤の血中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制
血小板減少(11.3%)、好中球減少(9.7%)、リンパ球減少(8.1%)、貧血(6.5%)等があらわれることがある。[7.2、8.参照]
11.1.2 感染症(30.6%)
肺炎、ニューモシスチス肺炎、異型肺炎、肺感染(各1.6%)等があらわれることがある。
11.2 その他の副作用
| 15%以上 | 5〜15%未満 | 5%未満 | |
| 消化器 | 悪心(16.1%) | 下痢、口内炎、腹痛 | アミラーゼ増加、嘔吐、便秘、腹部不快感、口内乾燥、鼓腸、心窩部不快感 |
| 一般・全身症状 | 倦怠感、疲労、筋痙縮 | 筋肉痛、浮腫、転倒、四肢痛、出血、疼痛、発熱、非心臓性胸痛、ほてり、末梢冷感 | |
| 精神神経系 | 味覚異常(24.2%) | 頭痛、眩暈、記憶障害、不眠症、異常な夢、一過性全健忘、嗅覚錯誤、錯乱状態、嗜眠、振戦、認知障害、末梢性ニューロパチー | |
| 代謝 | 食欲減退、低リン酸血症 | 血中クレアチンホスホキナーゼ増加、高カリウム血症、高トリグリセリド血症 | |
| 呼吸器 | 咳嗽、上気道の炎症、喘息、肺塞栓症、発声障害 | ||
| 皮膚 | 脱毛症(19.4%) | 皮疹 | 爪の障害、皮膚乾燥、光線過敏症、紅斑、そう痒、粘膜乾燥、毛髪成長異常 |
| 腎臓 | 血中クレアチニン増加 | ||
| 循環器 | QT延長 | ||
| 肝臓 | ALT増加、AST増加、トランスアミナーゼ上昇 | ||
| その他 | 体重減少、外陰腟乾燥、血中免疫グロブリンG減少、失神寸前の状態、大赤血球症、低γグロブリン血症、寝汗、歯の障害、夜間頻尿 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
臨床試験において、急性骨髄性白血病、骨髄異形成症候群、B細胞性急性リンパ性白血病等の二次性悪性腫瘍が発現したとの報告がある。また、小児の低分化型脊索腫(承認外効能・効果)患者でT細胞リンパ芽球性リンパ腫が発現したとの報告がある。[9.6参照]
15.2 非臨床試験に基づく情報
15.2.1 In vitro光毒性試験において陽性結果が得られた。
15.2.2 ラットを用いた13週間反復投与毒性試験において、臨床曝露量の11〜18倍の曝露量に相当する用量でT細胞リンパ芽球性リンパ腫の発生が報告されている。[9.6参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回及び反復投与
再発又は難治性の濾胞性リンパ腫患者及びびまん性大細胞型B細胞リンパ腫患者7例に本剤800mgを単回経口投与し、4〜9日経過した後、本剤800mgを1日2回反復経口投与したときの、初回投与後及び反復投与15日目の血漿中タゼメトスタット濃度推移を図に、薬物動態パラメータを表に示した2)。また、反復投与第15日目におけるタゼメトスタットの累積率は1.09であった。
再発又は難治性の濾胞性リンパ腫患者及びびまん性大細胞型B細胞リンパ腫患者に本剤800mgを単回及び1日2回反復経口投与したときの血漿中タゼメトスタット濃度(平均値+標準偏差)
| 投与時期 | 例数 | Cmax(ng/mL) | tmax(h) | AUC(0-12h)(ng・h/mL) | t1/2a(h) |
| 単回投与 | 7 | 1150(787) | 2(1-4) | 4700(2810) | 7.59(1.24) |
| 反復投与 15日目 | 7 | 1290(582) | 1(1-2) | 4500(1570) | 4.59(1.93) |
16.2 吸収
16.2.1 食事の影響
再発又は難治性のB細胞リンパ腫患者又は進行固形がん患者13例に本剤200mg注1)を単回経口投与したときのタゼメトスタットのCmax及びAUC(0-t)の幾何平均値の比(摂食下/絶食下)とその90%信頼区間は、0.62(0.41、0.93)及び0.69(0.44、1.08)であり、絶食下と比較して摂食下では、tmaxが3時間遅延した3)(外国人データ)。
16.2.2 絶対バイオアベイラビリティ
本剤800mgを1日2回14日以上反復投与している再発又は難治性のB細胞リンパ腫患者3例に本剤800mgを単回経口投与し、1時間後に約12μgの14C標識−タゼメトスタットを急速単回静脈内投与したときの、絶対バイオアベイラビリティの平均値は34%であった4)(外国人データ)。
16.3 分布
血漿蛋白結合率(in vitro、ヒト血漿)は87.7%〜91.1%(検討濃度:1〜30μmol/L)であった。タゼメトスタットは、アルブミン、α1-酸性糖蛋白質及びγ-グロブリンのうち、アルブミンに対して最も強い結合を示した5)。
16.4 代謝
16.5 排泄
16.7 薬物相互作用
16.7.1 イトラコナゾール
再発又は難治性のB細胞リンパ腫患者又は進行固形がん患者21例にイトラコナゾール(強いCYP3A阻害剤)200mgを1日1回19日間反復投与し、4日目から本剤400mg注1)を1日2回16日間反復投与(16日目のみ1日1回投与)したとき、本剤を単独で1日2回13日間反復投与したときと比較して、タゼメトスタットのCmax及びAUC(0-12h)の幾何平均値の比(イトラコナゾール併用時/本剤単独投与時)とその90%信頼区間は、1.86(1.49、2.31)及び2.47(2.02、3.02)であった9)。また、イトラコナゾール200mgを1日1回4日間反復投与時に本剤400mgを単回投与したとき、本剤を単独で単回投与したときと比較して、タゼメトスタットのCmax及びAUC(0-12h)の幾何平均値の比(イトラコナゾール併用時/本剤単独投与時)とその90%信頼区間は、2.00(1.60、2.48)及び3.12(2.44、3.99)であった9)(外国人データ)。[10.2参照]
16.7.2 フルコナゾール
16.7.3 リファンピシン
16.7.4 ミダゾラム
16.7.5 レパグリニド
16.7.6 その他
(1)再発又は難治性のB細胞リンパ腫患者又は進行固形がん患者16例に本剤800mgを1日2回18日間反復投与中に、16日目からオメプラゾール(胃酸分泌抑制剤)20mgを1日1回4日間朝に反復投与したときのタゼメトスタットの16日目(単独投与)と19日目(併用時)のCmax及びAUC(0-t)の幾何平均値の比(オメプラゾール併用時/本剤単独投与時)とその90%信頼区間は、1.06(0.70、1.58)及び1.17(0.80、1.69)であった10)(外国人データ)。
(2)再発又は難治性のB細胞リンパ腫患者又は進行固形がん患者16例に本剤800mgを1日2回15日間反復投与時にオメプラゾール(CYP2C19の基質)20mgを単回投与したときのオメプラゾールのCmax及びAUC(0-t)の幾何平均値の比(本剤併用時/オメプラゾール単独投与時)とその90%信頼区間は、0.84(0.49、1.44)及び0.80(0.51、1.27)であった10)(外国人データ)。
注1)本剤の承認された用法及び用量は、タゼメトスタットとして1回800mgを1日2回経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験(コホート1)
1つ以上の化学療法又は抗体療法の治療歴を有し、かつ標準的な治療選択肢がない再発又は難治性のEZH2遺伝子変異陽性の濾胞性リンパ腫患者17例を対象に、本剤800mgを1日2回経口投与した。その結果、中央判定による奏効率(%)は76.5(90%信頼区間:53.9、91.5)(13/17例)であった。
17.1.2 海外第I/II相試験(第II相パートコホート4)
2つ以上の前治療歴注2)を有する再発又は難治性のEZH2遺伝子変異陽性の濾胞性リンパ腫患者45例を対象に、本剤800mgを1日2回経口投与した。その結果、中央判定による奏効率(%)は68.9(95%信頼区間:53.4、81.8)(31/45例)であった。
注2)少なくとも1つの抗CD20抗体を含む治療レジメン、及びアルキル化剤(シクロホスファミド水和物、ベンダムスチン塩酸塩等)を含む治療レジメンを含む、2つ以上の標準的な治療による治療歴を有し、治癒的治療の選択肢がない患者
18. 薬効薬理
18.1 作用機序
タゼメトスタットは、ヒストン等のメチル基転移酵素であるEZH2の酵素活性に対する阻害作用を有する低分子化合物である。タゼメトスタットは、変異型EZH2(Y646F等)のメチル化活性を阻害することで、ヒストンH3の27番目のリジン残基等のメチル化を阻害し、細胞周期停止及びアポトーシス誘導を生じさせることにより、腫瘍増殖抑制作用を示すと推測されている16)。しかし、詳細な作用機序は解明されていない。
19. 有効成分に関する理化学的知見
19.1. タゼメトスタット臭化水素酸塩
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
56錠[14錠(PTP)×4]
23. 主要文献
- 社内資料:胚及び胎児発生に関する試験(2021年6月23日承認、CTD2.6.6.6.1)
- 社内資料:国内106試験(2021年6月23日承認、CTD2.7.6.4)
- 社内資料:外国101試験:食事の影響(2021年6月23日承認、CTD2.7.6.3.6.2)
- 社内資料:外国103試験:バイオアベイラビリティ(2021年6月23日承認、CTD2.7.6.1.3.1)
- 社内資料:In vitro血漿タンパク結合率(2021年6月23日承認、CTD2.6.4.4.2)
- 社内資料:代謝に関与するCYP(2021年6月23日承認、CTD2.6.4.5.4)
- 社内資料:外国103試験:排泄(2021年6月23日承認、CTD2.7.6.1.3.2)
- 社内資料:外国103試験:代謝物(2021年6月23日承認、CTD2.7.6.1.3.3)
- Chen Y.et al., Clin.Pharmacol.Drug Dev., 14 (7), 520-527, (2025)
- 社内資料:外国105試験(2021年6月23日承認、CTD2.7.6.2.3)
- 社内資料:外国101試験:薬物相互作用(2021年6月23日承認、CTD2.7.6.3.6.3)
- 社内資料:トランスポーターの基質性及び阻害能(2021年6月23日承認、CTD2.6.4.8)
- 社内資料:CYP阻害及び誘導(2021年6月23日承認、CTD2.6.4.5.5)
- 社内資料:国内206試験(2021年6月23日承認、CTD2.7.6.5)
- 社内資料:外国101試験:第2相パート(2021年6月23日承認、CTD2.7.6.3.7及び2.7.6.3.8)
- 社内資料:非臨床試験:作用機序(2021年6月23日承認、CTD2.6.2.2.1)
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売元
エーザイ株式会社
東京都文京区小石川4-6-10