医薬品情報
| 総称名 | ハイヤスタ |
|---|---|
| 一般名 | ツシジノスタット |
| 欧文一般名 | Tucidinostat |
| 製剤名 | ツシジノスタット錠 |
| 薬効分類名 | 抗悪性腫瘍剤 ヒストン脱アセチル化酵素(HDAC)阻害剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01XH06 |
| KEGG DRUG |
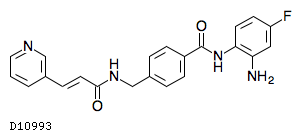
D10993
ツシジノスタット
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年4月 改訂(第8版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ハイヤスタ錠10mg | Hiyasta tablets | Meiji Seikaファルマ | 4291074F1023 | 20028.4円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
本剤の投与は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される患者のみに行うこと。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
○再発又は難治性の成人T細胞白血病リンパ腫
○再発又は難治性の末梢性T細胞リンパ腫
5. 効能または効果に関連する注意
<再発又は難治性の成人T細胞白血病リンパ腫>
5.1 臨床試験に組み入れられた患者の病型及び予後不良因子の有無等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.1参照]
<再発又は難治性の末梢性T細胞リンパ腫>
5.2 本剤投与の適応となる疾患の診断は、病理診断に十分な経験を持つ医師又は施設により行うこと。
5.3 臨床試験に組み入れられた患者の病理組織型等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.2参照]
6. 用法及び用量
通常、成人にはツシジノスタットとして1日1回40mgを週2回、3又は4日間隔で食後に経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.1 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2 本剤の投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量又は中止すること。[8.1、9.1.1参照]
| 開始用量 | 40mg |
| ステップ1(1段階減量) | 30mg |
| ステップ2(2段階減量) | 20mg |
| ステップ3 | 投与中止 |
| 副作用注) | 処置 | |
| 好中球減少 | 下記以外の1,000/mm3未満の好中球数減少 | 好中球数が1,500/mm3以上に回復するまで休薬する。回復後は、休薬前の用量で再開することができる。再開した後に再び発現した場合、回復するまで休薬し、回復後は1段階減量して投与を再開することができる。 |
| 7日間を超えて持続する500/mm3未満の好中球数減少 発熱又は感染症を伴う1,000/mm3未満の好中球数減少 | 好中球数が1,500/mm3以上に回復するまで休薬する。回復後は、1段階減量して投与を再開することができる。 | |
| 血小板減少 | 下記以外の50,000/mm3未満の血小板数減少 | 血小板数が75,000/mm3以上に回復するまで休薬する。回復後は、休薬前の用量で再開することができる。再開した後に再び発現した場合、回復するまで休薬し、回復後は1段階減量して投与を再開することができる。 |
| 臨床的に重大な出血を伴う又は血小板輸血を要する50,000/mm3未満の血小板数減少 | 血小板数が75,000/mm3以上に回復するまで休薬する。回復後は、1段階減量して投与を再開することができる。 | |
| 非血液学的事象 (臨床的意義のない無症候性の検査値異常を除く) | Grade 3 | Grade 1以下に回復するまで休薬する。回復後は、1段階減量して投与を再開することができる。 |
| Grade 4 | 投与を中止する。 | |
8. 重要な基本的注意
8.2 間質性肺疾患があらわれることがあるので、本剤の投与にあたっては、初期症状(発熱、咳嗽、呼吸困難等)の確認及び胸部X線検査の実施等、観察を十分に行うこと。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄機能低下のある患者
9.1.2 不整脈のある患者又はその既往歴のある患者
9.1.3 QT間隔延長又はその既往歴のある患者
9.3 肝機能障害患者
本剤は主に肝臓で代謝されるため、血中濃度が上昇する可能性がある。なお、肝機能障害患者を対象とした臨床試験は実施していない。
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、本剤投与中及び最終投与後5日間において避妊する必要性及び適切な避妊法について説明すること。[9.5参照]
9.4.2 男性には、本剤投与中及び最終投与後5日間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[9.5参照]
9.4.3 生殖可能な年齢の患者に投与する必要がある場合には、生殖機能の低下があらわれる可能性があることを考慮すること。動物試験(ラット及びイヌ)では、ヒトの臨床用量を下回る用量で、雄雌の生殖器所見が認められている(精巣の縮小、精巣重量の低下、精巣の精細管萎縮及び卵巣・子宮の萎縮)1)。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。本剤のヒト乳汁中への移行は不明である。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は主にCYP3A4により代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| 強いCYP3A阻害剤 イトラコナゾール、ボリコナゾール、クラリスロマイシン等 グレープフルーツ含有食品 [16.7.1参照] | 本剤の副作用が増強されるおそれがあるので、併用する場合には、本剤の減量を考慮するとともに、患者の状態をより慎重に観察し、副作用の発現に十分注意すること。 | これらの薬剤等の強いCYP3A阻害作用により、本剤の代謝が阻害され、本剤の血中濃度が上昇する可能性がある。 |
| 抗不整脈薬 アミオダロン、ジソピラミド、プロカインアミド等 QT間隔を延長させることが知られている他の薬剤 クラリスロマイシン、モキシフロキサシン、ベプリジル等 | QT間隔延長を増強するおそれがあるため、併用を避けることが望ましい。併用する場合には、患者の状態をより慎重に観察すること。 | これらの薬剤ではQT間隔を延長するとの報告があり、相加的なQT間隔延長を起こすことがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制
11.1.2 間質性肺疾患
肺臓炎(5.1%)、間質性肺疾患(2.6%)等があらわれることがある。異常が認められた場合には、胸部X線、胸部CT等の検査を実施すること。間質性肺疾患が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。[8.2参照]
11.1.3 感染症
ニューモシスチス・イロベチイ肺炎(2.6%)、尿路感染(1.3%)、肺炎(1.3%)等の重篤な感染症があらわれることがある。
11.1.4 不整脈、QT間隔延長
11.2 その他の副作用
| 10%以上 | 5%〜10%未満 | 5%未満 | |
| 血液及びリンパ球系障害 | 好酸球増加 | 再生不良性貧血 | |
| 胃腸障害 | 下痢、悪心 | 腹痛、腹部不快感、便秘、齲歯、消化不良、心窩部不快感、胃炎、口内炎、嘔吐 | |
| 一般・全身障害 | 倦怠感 | 疲労、発熱 | 末梢性浮腫、悪寒、無力症、胸部不快感、歩行障害 |
| 臨床検査 | γ-GTP増加 | ALP増加、体重減少、AST増加、ALT増加 | 血中クレアチニン増加、C-反応性蛋白増加、リパーゼ増加、血中クレアチンホスホキナーゼMB増加、血中クレアチンホスホキナーゼ増加、血中免疫グロブリンA減少、脳性ナトリウム利尿ペプチド増加、心胸郭比増加、心電図T波逆転 |
| 代謝 | 食欲減退 | 低アルブミン血症、低ナトリウム血症 | 低カリウム血症、低カルシウム血症、糖尿病、低リン酸血症 |
| 筋骨格系 | 筋痙縮、関節痛、関節炎、背部痛、関節腫脹、筋肉疲労、筋骨格硬直、四肢痛 | ||
| 神経系 | 味覚異常 | 頭痛、味覚消失、浮動性めまい、傾眠 | |
| 腎泌尿器 | 蛋白尿、尿瘻 | ||
| 呼吸器 | 呼吸困難、鼻出血、咳嗽、胸水 | ||
| 皮膚 | 発疹 | 蕁麻疹、多形紅斑、全身性そう痒症、紫斑、ざ瘡様皮膚炎、全身性剥脱性皮膚炎、紅斑、点状出血、光線過敏性反応、そう痒症、斑状丘疹状皮疹、皮膚潰瘍 | |
| その他 | 高血圧、回転性めまい、結膜出血、末梢性T細胞リンパ腫・非特定型、心嚢液貯留 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤は使用前にPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回及び反復投与
非ホジキンリンパ腫患者14例に本剤30又は40mgを週2回注)、3又は4日間隔で食後に反復経口投与したときの薬物動態パラメータ及び血漿中濃度推移を示す。本剤40mgを投与したときの投与25日目における本剤の蓄積比は1.24であった4)。
| 用量(mg) | 30 | 40 | ||
| 投与日(日) | 1 | 25 | 1 | 25 |
| N | 7 | 6 | 7 | 4 |
| Cmax(ng/mL) | 199±105 | 240±79.6 | 590±464 | 385±218 |
| tmax*(h) | 3.98 (2.50,11.9) | 5.00 (2.47,12.0) | 2.42 (1.52,5.95) | 4.19 (0.78,12.0) |
| AUCtau(ng・h/mL) | 3,740±1,210 | 4,870±1,320 | 6,760±3,650 | 6,010±3,500 |
| t1/2(h) | 17.1±3.15 | 21.6±5.27 | 19.4±6.51 | 18.7±2.05 |
図 本剤の血漿中濃度推移(平均値±標準偏差)
16.2 吸収
16.2.1 食事の影響
健康成人16例に本剤20mgを単回経口投与注)したとき、空腹時投与に対する高脂肪食後投与における本剤のCmax及びAUCinfの幾何平均値の比[90%信頼区間]は、それぞれ0.757[0.615,0.932]及び1.094[0.968,1.237]であり、空腹時投与と比較して食後投与でtmaxは2.5時間遅延した5)(外国人データ)。
16.3 分布
本剤のヒト血漿タンパク結合率は88.9〜89.4%であり、ヒト血球移行率は59.2〜76.0%であった6)(in vitro)。
16.4 代謝
16.5 排泄
非ホジキンリンパ腫患者における本剤40mgの単回投与時注)には、本剤の総投与量の25%が投与後72時間までに尿中に未変化体として排泄された4)。
16.7 薬物相互作用
16.7.1 イトラコナゾール
16.7.2 その他
本剤はP-gp、BCRP及びMRP2の基質であり、CYP2C19及び3Aを阻害した9)(in vitro)。
注)本剤の承認用法・用量は「1回40mgを週2回経口投与」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<再発又は難治性の成人T細胞白血病リンパ腫>
17.1.1 国内第IIb相試験(HBI-8000-210試験)
再発又は難治性の成人T細胞白血病リンパ腫患者注1)を対象に、本剤1日1回40mgを週2回、3又は4日間隔で食後に経口投与したときの有効性及び安全性を検討した。その結果、奏効率は、下表のとおりであった。組み入れられた患者の病型別での奏効率は、急性型46.2%(6/13例)、リンパ腫型12.5%(1/8例)、予後不良因子を有する慢性型0%(0/2例)であった10)。
| 最良総合効果 | 例数(%) 23例 |
| 完全奏効 | 1(4.3) |
| 不確定完全奏効 | 0(0) |
| 部分奏効 | 6(26.1) |
| 安定 | 5(21.7) |
| 病勢進行 | 11(47.8) |
| 奏効(奏効率[95%信頼区間]) | 7(30.4[13.2,52.9]) |
安全性評価症例23例中23例(100%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、血小板減少18例(78.3%)、好中球減少12例(52.2%)、白血球減少10例(43.5%)、貧血9例(39.1%)、食欲減退8例(34.8%)及び倦怠感7例(30.4%)であった10)。[5.1参照]
注1)HBI-8000-210試験対象患者の詳細
・モガムリズマブ(遺伝子組換え)治療歴がある又はモガムリズマブ(遺伝子組換え)に不耐容の患者
・急性型、リンパ腫型又は予後不良因子(血中尿素窒素高値、乳酸脱水素酵素高値又は血清アルブミン低値のいずれか)を有する慢性型
<再発又は難治性の末梢性T細胞リンパ腫>
17.1.2 国際共同第IIb相試験(HBI-8000-203試験)
再発又は難治性の末梢性T細胞リンパ腫患者注2)を対象に、本剤1日1回40mgを週2回、3又は4日間隔で食後に経口投与したときの有効性及び安全性を検討した。その結果、有効性評価症例46例(日本人患者34例を含む)での奏効率は、45.7%(21/46例)(95%信頼区間:30.9〜61.0%)であった。組み入れられた患者の病理組織型別の奏効率は、下表のとおりであった11)。
| 病理組織型 | 例数 | 最良総合効果 | 奏効 (奏効率(%)) | |||
| 完全奏効 | 部分奏効 | 安定 | 病勢進行 | |||
| 合計 | 46 | 5 | 16 | 12 | 13 | 21(45.7) |
| PTCL-NOS | 34 | 3 | 9 | 10 | 12 | 12(35.3) |
| AITL | 8 | 2 | 5 | 1 | 0 | 7(87.5) |
| ALCL ALK− | 3 | 0 | 1 | 1 | 1 | 1(33.3) |
| EATL | 1 | 0 | 1 | 0 | 0 | 1(100) |
安全性評価症例55例中51例(92.7%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、血小板減少42例(76.4%)、好中球減少31例(56.4%)、白血球減少21例(38.2%)、貧血12例(21.8%)、食欲減退12例(21.8%)及び悪心11例(20.0%)であった11)。[5.3参照]
注2)HBI-8000-203試験対象患者の病理組織型
・PTCL-NOS、AITL、ALCL ALK−、EATL、肝脾T細胞リンパ腫、皮下脂肪織炎様T細胞リンパ腫、ALK陽性未分化大細胞リンパ腫
18. 薬効薬理
18.1 作用機序
ツシジノスタットは、ヒストン脱アセチル化酵素(HDAC)の活性を阻害する12)。HDAC活性阻害によりヒストン等の脱アセチル化が阻害され、細胞周期停止及びアポトーシス誘導が生じることにより、腫瘍増殖が抑制されると推測されている。しかし、詳細な作用機序は解明されていない。
18.2 抗腫瘍作用
ツシジノスタットは、in vitroにおいて、成人T細胞白血病リンパ腫由来初代細胞に対して、増殖抑制作用を示した13)。
19. 有効成分に関する理化学的知見
19.1. ツシジノスタット
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
PTP包装
8錠(8錠×1)
23. 主要文献
- 社内資料:反復経口投与毒性試験(2021年6月23日承認、CTD2.6.6.6)
- Eikel,D.,et al., Chem.Res.Toxicol., 19 (2), 272-278, (2006) »PubMed
- Wise,L.D.,et al., Birth Defects Res.B Dev.Reprod.Toxicol., 80 (1), 57-68, (2007) »PubMed
- 社内資料:国内第I相試験(HBI-8000-201試験)(2021年6月23日承認、CTD2.7.2.2.2.1.1)
- 社内資料:食事の影響試験(HBI-8000-304試験)(2021年6月23日承認、CTD2.7.2.3.3.1)
- 社内資料:血漿タンパク結合(2021年6月23日承認、CTD2.7.2.2.1.3)
- 社内資料:代謝に関与するCYPフェノタイプの特定(2021年6月23日承認、CTD2.6.4.5.1)
- 社内資料:薬物相互作用試験(HBI-8000-304試験)(2021年6月23日承認、CTD2.7.2.3.3.2)
- 社内資料:トランスポータへの影響(2021年6月23日承認、CTD2.7.2.2.1.8)
- 社内資料:国内第IIb相試験(HBI-8000-210試験)(2021年6月23日承認、CTD2.7.3.3.2.1、2.7.4.2.1.2.1)
- 社内資料:国際共同第IIb相試験(HBI-8000-203試験)(2021年11月25日承認、CTD2.7.3.3.2.1、2.7.4.2.1.2.1)
- Ning,Z.-Q.,et al., Cancer Chemother.Pharmacol., 69, 901-909, (2012) »PubMed
- Hasegawa,H.,et al., Cancer Sci., 107, 1124-1133, (2016) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
Meiji Seikaファルマ株式会社
くすり相談室
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル 0120-093-396
03-3273-3539
03-3273-3539
FAX:03-3272-2438
製品情報問い合わせ先
Meiji Seikaファルマ株式会社
くすり相談室
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル 0120-093-396
03-3273-3539
03-3273-3539
FAX:03-3272-2438
26. 製造販売業者等
26.1 製造販売元
Meiji Seikaファルマ株式会社
東京都中央区京橋2-4-16