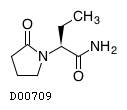
医薬品情報
| 総称名 | レベチラセタム |
|---|---|
| 一般名 | レベチラセタム |
| 欧文一般名 | Levetiracetam |
| 製剤名 | レベチラセタム錠 |
| 薬効分類名 | 抗てんかん剤 |
| 薬効分類番号 | 1139 |
| ATCコード | N03AX14 |
| KEGG DRUG |
D00709
レベチラセタム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年9月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| レベチラセタム錠250mg「日新」 (後発品) | Levetiracetam Tablets 250mg"NISSIN" | 日新製薬-山形 | 1139010F1113 | 26.3円/錠 | 処方箋医薬品注) |
| レベチラセタム錠500mg「日新」 (後発品) | Levetiracetam Tablets 500mg"NISSIN" | 日新製薬-山形 | 1139010F2110 | 41.6円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分又はピロリドン誘導体に対し過敏症の既往歴のある患者
4. 効能または効果
○てんかん患者の部分発作(二次性全般化発作を含む)
○他の抗てんかん薬で十分な効果が認められないてんかん患者の強直間代発作に対する抗てんかん薬との併用療法
6. 用法及び用量
成人
通常、成人にはレベチラセタムとして1日1000mgを1日2回に分けて経口投与する。なお、症状により1日3000mgを超えない範囲で適宜増減するが、増量は2週間以上の間隔をあけて1日用量として1000mg以下ずつ行うこと。
小児
通常、4歳以上の小児にはレベチラセタムとして1日20mg/kgを1日2回に分けて経口投与する。なお、症状により1日60mg/kgを超えない範囲で適宜増減するが、増量は2週間以上の間隔をあけて1日用量として20mg/kg以下ずつ行うこと。ただし、体重50kg以上の小児では、成人と同じ用法・用量を用いること。
7. 用法及び用量に関連する注意
7.1 本剤を強直間代発作に対して使用する場合には、他の抗てんかん薬と併用すること。強直間代発作に対する本剤単独投与での臨床試験は実施していない。
7.2 腎機能障害を有する成人患者に本剤を投与する場合は、下表に示すクレアチニンクリアランス値を参考として本剤の投与量及び投与間隔を調節すること。また、血液透析を受けている成人患者では、クレアチニンクリアランス値に応じた1日用量に加えて、血液透析を実施した後に本剤の追加投与を行うこと。なお、ここで示している用法及び用量はシミュレーション結果に基づくものであることから、患者ごとに慎重に観察しながら、用法及び用量を調節すること。また、腎機能障害を有する小児患者についても腎機能の程度に応じて、本剤の投与量及び投与間隔を調節するなど慎重に投与すること。[9.2.1、9.2.2、9.8、16.6.1、16.6.2参照]
| クレアチニンクリアランス(mL/min) | ≧80 | ≧50-<80 | ≧30-<50 | <30 | 透析中の腎不全患者 | 血液透析後の補充用量 |
| 1日投与量 | 1000〜3000mg | 1000〜2000mg | 500〜1500mg | 500〜1000mg | 500〜1000mg | / |
| 通常投与量 | 1回500mg 1日2回 | 1回500mg 1日2回 | 1回250mg 1日2回 | 1回250mg 1日2回 | 1回500mg 1日1回 | 250mg |
| 最高投与量 | 1回1500mg 1日2回 | 1回1000mg 1日2回 | 1回750mg 1日2回 | 1回500mg 1日2回 | 1回1000mg 1日1回 | 500mg |
8. 重要な基本的注意
8.1 連用中における投与量の急激な減量ないし投与中止により、てんかん発作の増悪又はてんかん重積状態があらわれることがあるので、投与を中止する場合には、少なくとも2週間以上かけて徐々に減量するなど慎重に行うこと。
8.2 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等、危険を伴う機械の操作に従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、以下のようなリスクを考慮し治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
・ヒトにおいて、妊娠中にレベチラセタムの血中濃度が低下したとの報告があり、第3トリメスター期間に多く、最大で妊娠前の60%となったとの報告がある。
・ラットにおいて胎児移行性が認められている。
・動物実験において、ラットではヒトへの曝露量と同程度以上の曝露で骨格変異及び軽度の骨格異常の増加、成長遅延、児の死亡率増加が認められ、ウサギでは、ヒトへの曝露量の4〜5倍の曝露で胚致死、骨格異常の増加及び奇形の増加が認められている。
9.5.2 本剤を投与した妊婦から出生した児において、新生児薬物離脱症候群があらわれることがある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
ヒト乳汁中へ移行することが報告されている。
ヒト乳汁中へ移行することが報告されている。
9.7 小児等
低出生体重児又は新生児を対象とした臨床試験は国内・海外ともに実施していない。
9.8 高齢者
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
発熱、紅斑、水疱・びらん、そう痒、咽頭痛、眼充血、口内炎等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.2 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること1)。
11.1.3 重篤な血液障害(頻度不明)
汎血球減少、無顆粒球症、白血球減少、好中球減少、血小板減少があらわれることがある。
11.1.4 肝不全、肝炎(いずれも頻度不明)
肝不全、肝炎等の重篤な肝障害があらわれることがある。
11.1.5 膵炎(頻度不明)
激しい腹痛、発熱、嘔気、嘔吐等の症状があらわれたり、膵酵素値の上昇が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.6 攻撃性、自殺企図(いずれも1%未満)
11.1.7 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.8 急性腎障害(頻度不明)
11.1.9 悪性症候群(頻度不明)
発熱、筋強剛、血清CK上昇、頻脈、血圧の変動、意識障害、発汗過多、白血球の増加等があらわれた場合には投与を中止し、体冷却、水分補給、呼吸管理等の適切な処置を行うこと。また、ミオグロビン尿を伴う腎機能の低下がみられることがある。
11.2 その他の副作用
| 3%以上 | 1〜3%未満 | 1%未満 | 頻度不明 | |
| 精神神経系 | 浮動性めまい(10.4%)、頭痛(11.8%)、不眠症、傾眠(27.9%) | 感覚鈍麻、気分変動、振戦、易刺激性、痙攣、抑うつ | 激越、健忘、注意力障害、幻覚、運動過多、記憶障害、錯感覚、思考異常、平衡障害、感情不安定、異常行動、協調運動異常、怒り、ジスキネジー、不安、体位性めまい、睡眠障害、緊張性頭痛、精神病性障害、パニック発作、譫妄 | 錯乱状態、敵意、気分動揺、神経過敏、人格障害、精神運動亢進、舞踏アテトーゼ運動、嗜眠、てんかん増悪、強迫性障害 |
| 眼 | 複視、結膜炎 | 霧視、眼精疲労、眼そう痒症、麦粒腫 | ||
| 血液 | 好中球数減少 | 貧血、血中鉄減少、鉄欠乏性貧血、血小板数減少、白血球数増加、白血球数減少 | ||
| 循環器 | 心電図QT延長、高血圧 | |||
| 消化器 | 腹痛、便秘、下痢、胃腸炎、悪心、口内炎、嘔吐、齲歯 | 歯肉炎、痔核、胃不快感、歯痛 | 消化不良、口唇炎、歯肉腫脹、歯周炎 | |
| 肝臓 | ALP増加 | 肝機能異常 | ||
| 泌尿・生殖器 | 膀胱炎、尿中ブドウ糖陽性、尿中血陽性、尿中蛋白陽性、月経困難症 | 頻尿 | ||
| 呼吸器 | 鼻咽頭炎(30.2%)、咽喉頭疼痛、上気道の炎症 | 気管支炎、咳嗽、鼻漏、咽頭炎、インフルエンザ、鼻炎 | 鼻出血、肺炎 | |
| 代謝及び栄養 | 食欲不振 | |||
| 皮膚 | 湿疹 | 皮膚炎、そう痒症、発疹、ざ瘡 | 脱毛症、単純ヘルペス、帯状疱疹、白癬感染 | 多形紅斑、血管性浮腫 |
| 筋骨格系 | 背部痛 | 肩痛、筋肉痛、筋骨格硬直、関節痛 | 頸部痛、四肢痛、筋力低下 | |
| 感覚器 | 耳鳴 | 回転性めまい | ||
| その他 | 倦怠感、発熱、体重減少 | 血中トリグリセリド増加、胸痛、体重増加 | 無力症、疲労、末梢性浮腫、抗痙攣剤濃度増加 | 事故による外傷(皮膚裂傷等) |
13. 過量投与
13.1 症状
外国の市販後報告において、レベチラセタムを一度に15〜140g服用した例があり、傾眠、激越、攻撃性、意識レベルの低下、呼吸抑制及び昏睡が報告されている。
13.2 処置
本剤は血液透析により除去可能であり、発現している症状の程度に応じて血液透析の実施を考慮すること。[16.6.2参照]
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外で実施された本剤を含む複数の抗てんかん薬における、てんかん、精神疾患等を対象とした199のプラセボ対照臨床試験の検討結果において、自殺念慮及び自殺企図の発現のリスクが、抗てんかん薬の服用群でプラセボ群と比較して約2倍高く(抗てんかん薬服用群:0.43%、プラセボ群:0.24%)、抗てんかん薬の服用群では、プラセボ群と比べ1000人あたり1.9人多いと計算された(95%信頼区間:0.6-3.9)。また、てんかん患者のサブグループでは、プラセボ群と比べ1000人あたり2.4人多いと計算されている。[8.3、8.4、11.1.6参照]
15.1.2 外国人成人てんかん患者1208例を対象としたプラセボ対照臨床試験の併合解析において、非精神病性行動症状の有害事象(攻撃性、激越、怒り、不安、無力感、離人症、抑うつ、情動不安定、敵意、運動過多、易刺激性、神経過敏、神経症、人格障害)の発現率は本剤群で13.3%、プラセボ群で6.2%であった。同様に、外国人小児てんかん患者(4〜16歳)198例を対象としたプラセボ対照臨床試験における当該有害事象の発現率は本剤群で37.6%、プラセボ群で18.6%であった。
また、外国人小児てんかん患者(4〜16歳)98例を対象とした認知機能及び行動に対する影響を評価するプラセボ対照臨床試験において、探索的な検討であるが、プラセボ群と比較して攻撃的行動の悪化が示唆された。
また、外国人小児てんかん患者(4〜16歳)98例を対象とした認知機能及び行動に対する影響を評価するプラセボ対照臨床試験において、探索的な検討であるが、プラセボ群と比較して攻撃的行動の悪化が示唆された。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
<レベチラセタム錠500mg「日新」>
レベチラセタム錠500mg「日新」とイーケプラ錠500mgを、クロスオーバー法によりそれぞれ1錠(レベチラセタムとして500mg)健康成人男子に絶食時単回経口投与して血漿中(S)-レベチラセタム濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された2)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-36(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | |
| レベチラセタム錠500mg「日新」 | 145.78±15.11 | 20.89±4.25 | 0.64±0.54 | 7.88±0.55 |
| イーケプラ錠500mg | 147.20±14.85 | 19.86±5.00 | 0.67±0.36 | 7.91±0.56 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能の程度の異なる成人被験者を対象に、レベチラセタムを単回経口投与したとき、見かけの全身クリアランスは腎機能正常者(CLCR:≧80mL/min/1.73m2)と比較して、軽度低下者(CLCR:50〜<80mL/min/1.73m2)では40%、中等度低下者(CLCR:30〜<50mL/min/1.73m2)で52%、重度低下者(CLCR:<30mL/min/1.73m2)で61%低下した。
レベチラセタムの腎クリアランスはクレアチニンクリアランスと有意に相関した3)。[7.2、9.2.1、9.8、16.6.4参照]
レベチラセタムの腎クリアランスはクレアチニンクリアランスと有意に相関した3)。[7.2、9.2.1、9.8、16.6.4参照]
| 薬物動態パラメータ | 腎機能の程度 | |||
| 正常 (N=6) | 軽度 (N=6) | 中等度 (N=6) | 重度 (N=6) | |
| CLCR(mL/min/1.73m2) | ≧80 | 50-<80 | 30-<50 | <30 |
| 投与量 | 500mg | 500mg | 250mg | 250mg |
| レベチラセタム | ||||
| Cmax(μg/mL) | 21.9[31.2] | 15.5[25.3] | 10.8[24.3] | 9.2[30.4] |
| tmax(h) | 0.5(0.5-2.0) | 1(0.5-2.0) | 0.5(0.5-1.0) | 0.5(0.5-1.0) |
| AUC0-t(μg・h/mL) | 166[16.5] | 248[16.9] | 169[16.5] | 212[19.1] |
| t1/2(h) | 7.6[6.9] | 12.6[11.3] | 15.5[17.5] | 19.7[26.5] |
| CL/F(mL/min/1.73m2) | 51.5[7.8] | 30.9[14.6] | 24.6[15.0] | 20.3[20.9] |
| CLR(mL/min/1.73m2) | 31.6[28.5]a) | 15.3[22.3] | 9.7[23.4] | 6.0[53.6] |
| ucb L057 | ||||
| Cmax(μg/mL) | 0.36[9.4] | 0.75[25.8] | 0.57[26.0] | 1.06[29.3] |
| tmax(h) | 5.0(2.0-8.0) | 8.0(6.0-12.0) | 12.0(8.0-12.0) | 24.0(12.0-24.0) |
| AUC0-t(μg・h/mL) | 5.9[9.7] | 22.6[45.9] | 18.7[53.4] | 57.8[57.3] |
| t1/2(h) | 12.4(11.3-15.3) | 19.0(17.3-19.9) | 20.3(19.7-23.6) | 26.8(17.2-33.3) |
16.6.2 血液透析を受けている末期腎機能障害患者
血液透析を受けている末期腎機能障害の成人被験者にレベチラセタム500mgを透析開始44時間前に単回経口投与したとき、レベチラセタムの非透析時の消失半減期は34.7時間であったが、透析中は2.3時間に短縮した。レベチラセタム及びucb L057の透析による除去効率は高く、81%及び87%であった3)。[7.2、9.2.2、13.2参照]
| 薬物動態パラメータ | レベチラセタム | ucb L057 |
| Cmax(μg/mL) | 18.7[8.1] | 8.84[7.0] |
| tmax(h) | 0.7(0.43-0.98) | 44.0(44.0-44.0) |
| t1/2(h) | 34.7(29.2-38.6) | − |
| AUC0-44h(μg・h/mL) | 462[10.5] | 230[7.8] |
| CL/F(mL/min/1.73m2) | 10.9(9.4-13.1) | − |
| ダイアライザーの除去効率(%) | 81[7.5] | 87[7.2] |
| 血液透析中の消失半減期(h) | 2.3(2.1-2.6) | 2.1(1.9-2.6) |
| 血液透析クリアランス(mL/min) | 115.4[8.1] | 122.9[7.1] |
16.6.3 肝機能障害患者
軽度及び中等度(Child-Pugh分類A及びB)の成人肝機能低下者にレベチラセタムを単回経口投与したとき、レベチラセタムの全身クリアランスに変化はみられなかった。重度(Child-Pugh分類C)の肝機能低下者では、全身クリアランスが健康成人の約50%となった4)5)(外国人データ)。[7.3、9.3.1参照]
| 薬物動態パラメータ | 健康成人 (N=5) | 肝機能低下者 | ||
| Child-Pugh分類A (N=5) | Child-Pugh分類B (N=6) | Child-Pugh分類C (N=5) | ||
| CLCR(mL/min/1.73m2)a) | 93.1±13.8 | 120.8±11.9 | 99.6±13.2 | 63.5±13.5 |
| レベチラセタム | ||||
| Cmax(μg/mL) | 23.1±1.2 | 23.6±4.9 | 24.7±3.3 | 24.1±3.8 |
| tmax(h) | 0.8±0.3 | 0.6±0.2 | 0.5±0.0 | 1.6±1.5 |
| AUC(μg・h/mL) | 234±49 | 224±25 | 262±58 | 595±220 |
| t1/2(h) | 7.6±1.0 | 7.6±0.7 | 8.7±1.5 | 18.4±7.2 |
| CL/F(mL/min/1.73m2) | 63.4±9.7 | 62.5±8.7 | 55.4±10.5 | 29.2±13.5 |
16.6.4 高齢者
16.8 その他
<レベチラセタム錠250mg「日新」>
レベチラセタム錠250mg「日新」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(令和2年3月19日 薬生薬審発0319第1号)」に基づき、レベチラセタム錠500mg「日新」を標準製剤としたとき、溶出挙動が同等と判断され、生物学的に同等とみなされた8)。
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. レベチラセタム
20. 取扱い上の注意
本剤は高温高湿を避けて保存すること。
22. 包装
<レベチラセタム錠250mg「日新」>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
100錠[バラ、乾燥剤入り]
<レベチラセタム錠500mg「日新」>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
100錠[バラ、乾燥剤入り]
23. 主要文献
- 厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
- 社内資料:生物学的同等性試験(錠500mg)
- Yamamoto J,et al., Clin Drug Investig., 34, 819-828, (2014) »PubMed
- Brockmoller J,et al., Clin Pharmacol Ther., 77, 529-541, (2005) »PubMed
- 肝機能低下者におけるレベチラセタムの薬物動態(イーケプラ錠:2010年7月23日承認、申請資料概要2.7.6.4.5)
- 高齢者(外国人)におけるレベチラセタム単回及び反復経口投与時の薬物動態(イーケプラ錠:2010年7月23日承認、申請資料概要2.7.6.4.1)
- 内因性要因を検討した薬物動態(イーケプラ錠:2010年7月23日承認、申請資料概要2.5.3.4(4))
- 社内資料:生物学的同等性試験(錠250mg)
- Noyer M,et al., Eur J Pharmacol., 286, 137-146, (1995) »PubMed
- Lynch B A,et al., Proc Nat Acad Sci U.S.A., 101, 9861-9866, (2004)
- Lukyanetz E A,et al., Epilepsia., 43, 9-18, (2002) »PubMed
- Pisani A,et al., Epilepsia., 45, 719-728, (2004) »PubMed
- Rigo J M,et al., Br J Pharmacol., 136, 659-672, (2002) »PubMed
- Margineanu D G,et al., Pharmacol Res., 42, 281-285, (2000) »PubMed
- Kaminski R M,et al., Neuropharmacology., 54, 715-720, (2008) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日新製薬株式会社
安全管理部
〒994-0069
山形県天童市清池東二丁目3番1号
電話:023-655-2131
FAX:023-655-3419
Email:d-info@yg-nissin.co.jp
製品情報問い合わせ先
日新製薬株式会社
安全管理部
〒994-0069
山形県天童市清池東二丁目3番1号
電話:023-655-2131
FAX:023-655-3419
Email:d-info@yg-nissin.co.jp
26. 製造販売業者等
26.1 製造販売元
日新製薬株式会社
山形県天童市清池東二丁目3番1号