医薬品情報
| 総称名 | ナロキソン塩酸塩 |
|---|---|
| 一般名 | ナロキソン塩酸塩 |
| 欧文一般名 | Naloxone Hydrochloride |
| 製剤名 | ナロキソン塩酸塩注射剤 |
| 薬効分類名 | 麻薬拮抗剤 |
| 薬効分類番号 | 2219 |
| ATCコード | V03AB15 |
| KEGG DRUG |
D01340
ナロキソン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年12月 作成(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ナロキソン塩酸塩静注0.2mg「AFP」 | NALOXONE HYDROCHLORIDE Intravenous Injection 0.2mg「AFP」 | アルフレッサファーマ | 2219402A1049 | 899円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 バルビツール系薬剤等の非麻薬性中枢神経抑制剤又は病的原因による呼吸抑制のある患者[無効のため]
4. 効能または効果
麻薬による呼吸抑制ならびに覚醒遅延の改善
6. 用法及び用量
ナロキソン塩酸塩として、通常成人1回0.2mgを静脈内注射する。
効果不十分の場合、さらに2〜3分間隔で0.2mgを1〜2回追加投与する。
なお、患者の状態に応じて適宜増減する。
効果不十分の場合、さらに2〜3分間隔で0.2mgを1〜2回追加投与する。
なお、患者の状態に応じて適宜増減する。
8. 重要な基本的注意
8.1 麻薬によっては作用時間が本剤より長いものがあるので、呼吸抑制の再発をみることがある。したがって本剤に十分反応する患者に対しては、常に監視し、必要により本剤を繰り返し投与すること。
8.2 麻薬等による呼吸抑制に対する拮抗作用の強さは、鎮痛作用に対する拮抗作用に比しかなり強い。したがって、通常鎮痛作用を減弱することなく、呼吸抑制を緩解し得るが、本剤が過量となった場合には、疼痛があらわれることがあるので、観察を十分に行い、慎重に投与すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 高血圧、心疾患のある患者
麻薬等による抑制が急激に拮抗されると血圧上昇、頻脈等を起こすことがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物(ラット、サル)において乳汁分泌に関与するプロラクチンの分泌を抑制することが報告されている。
9.7 小児等
9.7.1 小児等を対象とした臨床試験は実施していない。
9.7.2 麻薬依存患者及び麻薬依存又はその疑いのある母親から生まれた新生児に本剤を投与した場合、麻薬の作用が本剤により急激に拮抗されて、急性の退薬症候を起こすとの報告がある。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下していることが多い。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肺水腫(頻度不明)
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 循環器 | 血圧上昇(8.1%)、頻脈 | 胸部苦悶感 | − |
| 精神神経系 | 振戦、術後疼痛 | − | − |
| 消化器 | 悪心・嘔吐 | − | 腹痛 |
| 肝臓 | − | − | AST上昇、ALT上昇、肝機能障害 |
16. 薬物動態
16.1 血中濃度
健康成人9例にナロキソン塩酸塩0.4mg注)を単回静脈内注射しラジオイムノアッセイ法により測定した結果、5分後には投与量の97%は血清中に存在せず、投与後20分から2時間にかけての平均血中半減期(mean±SE)は64±12分であった1)(外国人データ)。
16.4 代謝
16.5 排泄
健康成人男性1例にナロキソン-7,8-3Hを単回静脈内注射した結果、最初の6時間で約38%が尿中へ排泄され、72時間までの尿中総排泄率は投与量の約65%であった4)(外国人データ)。
注)本剤の承認された用法及び用量は、ナロキソン塩酸塩として、通常成人1回0.2mgを静脈内注射である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
フェンタニルを投与した57例の術後呼吸抑制や覚醒遅延の改善を検討した。51例は0.2mg静脈内注射1回、6例は0.2mg静脈内注射2回投与であった。主な副作用は、血圧上昇12例(21.1%)、振戦2例(3.5%)、頻脈2例(3.5%)であった5)。
(1)呼吸抑制の改善
本剤投与直後から呼吸数、換気量の増加がみられ、投与前値に比し、呼吸数は150%、1回換気量は67%、分時換気量は200%それぞれ増加した。効果は30分後でも十分保持されていた。動脈血ガス分圧への影響については、本剤投与後6分でPaCO2は13%減少(47.5mmHg→41.5mmHg)、30分後においてもその効果は持続していた。
(2)覚醒遅延の改善
本剤を手術終了後に投与した場合、覚醒遅延の改善(病室へ帰ってもよいと判断する時間及び術後の呼びかけに反応を示さなかった症例への反応)が明らかに認められた。
17.1.2 国内臨床試験
モルヒネを投与した99例の術後呼吸抑制の改善を検討した。85例は0.2mg静脈内注射1回、14例は0.2mg静脈内注射複数回投与であった。呼吸数、1回換気量、分時換気量とも投与後のすべての値が投与前値に比べ有意に上昇しており、この傾向は特に15分までの値で著明であった。投与後5分で呼吸数は平均12.3±1.1回から17.1±0.6回(39%増)へ、1回換気量は平均323±26mLから500±29mL(52%増)、分時換気量は平均4.07±0.36Lから8.10±0.49L(99%増)へそれぞれ上昇し、120分値まで持続した。本剤の効果がピークを示すのは5〜15分であるとみられ、30分後より徐々に低下した。動脈血ガス分圧への影響については、本剤投与後5分で、PaCO2は9%減少(46.8±0.9mmHg→42.6±0.7mmHg)し、15分後にはピークに達し、120分後にもその効果は持続しており、有意な低下を示した。主な副作用は、血圧上昇3例(3.0%)、悪心2例(2.0%)であった6)。
17.1.3 国内臨床試験
内視鏡検査時のペチジン前投与によるふらつきの改善を検討した。内視鏡検査開始時に22例はペチジン35mg、7例はペチジン35mgとジアゼパム5mgを静脈内投与し、検査終了時全例に本剤0.2mg又は0.4mgを静脈内投与した。ふらつきの改善が認められた。副作用は認められなかった7)。
18. 薬効薬理
18.1 作用機序
ナロキソンは、オピオイド受容体において麻薬性鎮痛剤の作用を競合的に拮抗することにより、これらの薬剤に起因する呼吸抑制等の作用を改善すると言われている8)。
18.2 呼吸抑制に対する拮抗作用
18.3 麻薬様アゴニスト作用の有無
19. 有効成分に関する理化学的知見
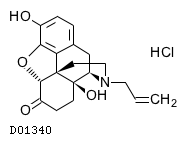
19.1. ナロキソン塩酸塩
22. 包装
1mL[10アンプル(褐色)]
23. 主要文献
- Ngai,SH.et al., Anesthesiology., 44 (5), 398-401, (1976) »PubMed
- Fujimoto,JM.et al., Proc Soc Exp Biolo Med., 133 (1), 317-319, (1970) »PubMed
- Weinstein,SH.et al., J Pharm Sci., 60 (10), 1567-1568, (1971) »PubMed
- Fishman,J.et al., J Pharmacol Exp Ther., 187 (3), 575-580, (1973) »PubMed
- 橘 直矢 他, 麻酔, 32 (1), 43-52, (1983) »PubMed
- 釘宮豊城 他, 麻酔, 31 (12), 1365-1375, (1982) »PubMed
- 川満富裕 他, お茶の水医学雑誌, 32 (2), 143-154, (1984)
- Martin,WR., Ann Intern Med., 85 (6), 765-768, (1976) »PubMed
- Blumberg,H.et al., Fed Proc., 24, 676, (1965)
- McGilliard,KL.et al., J Pharmacol Exp Ther., 207 (2), 494-503, (1978) »PubMed
- Kosterlitz,HW.et al., Br J Pharmacol Chemother., 33 (2), 266-276, (1968) »PubMed
- 飯塚宏美 他, 実中研・前臨床研究報, 8 (1), 1-10, (1982)
24. 文献請求先及び問い合わせ先
文献請求先
アルフレッサファーマ株式会社
製品情報部
〒540-8575
大阪市中央区石町二丁目2番9号
電話:06-6941-0306
FAX:06-6943-8212
製品情報問い合わせ先
アルフレッサファーマ株式会社
製品情報部
〒540-8575
大阪市中央区石町二丁目2番9号
電話:06-6941-0306
FAX:06-6943-8212
26. 製造販売業者等
26.1 製造販売元
アルフレッサファーマ株式会社
大阪市中央区石町二丁目2番9号