医薬品情報
| 総称名 | デスモプレシン |
|---|---|
| 一般名 | デスモプレシン酢酸塩水和物 |
| 欧文一般名 | Desmopressin Acetate Hydrate |
| 製剤名 | デスモプレシン酢酸塩水和物スプレー |
| 薬効分類名 | 中枢性尿崩症用剤 |
| 薬効分類番号 | 2419 |
| ATCコード | H01BA02 |
| KEGG DRUG |
D02235
デスモプレシン酢酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第4版)

|
4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| デスモプレシン点鼻スプレー2.5μg「フェリング」 | DESMOPRESSIN Nasal Spray 2.5μg[FERRING] | フェリング・ファーマ | 2419700R1030 | 2257.5円/瓶 | 劇薬, 処方箋医薬品注) |
4. 効能または効果
5. 効能または効果に関連する注意
多飲・多尿・低比重尿を示す疾患として中枢性尿崩症(バソプレシン感受性尿崩症)・心因性多飲症・腎性尿崩症・高カルシウム血症に基づく多尿症がある。これら各種疾患に基づく多尿を鑑別し、バソプレシン欠乏による尿崩症のみに使用すること。
6. 用法及び用量
小児
通常デスモプレシン酢酸塩水和物として1回2.5μg〜5μg〔1〜2噴霧〕を1日1〜2回鼻腔内に投与する。
成人
通常デスモプレシン酢酸塩水和物として1回5μg〜10μg〔2〜4噴霧〕を1日1〜2回鼻腔内に投与する。
投与量は患者の飲水量、尿量、尿比重、尿浸透圧により適宜増減する。
8. 重要な基本的注意
8.1 渇中枢異常を伴う症候性尿崩症の患者では水出納のバランスがくずれやすいので、本剤投与中は血清ナトリウム値に十分注意すること。
8.2 本剤投与中に水中毒症状を来すことがあるので、以下の点に注意すること。[11.1.1参照]
・過度の飲水を避け、点滴・輸液による水分摂取にも注意すること。
・適正な飲水量、適正な用法の習得並びに維持量を決定するまで、入院するなど必要な処置をとることが望ましい。
・本剤投与中は患者の状態を観察し、水中毒を示唆する症状(倦怠感、頭痛、悪心・嘔吐等)の発現に十分注意すること。
8.3 水中毒の発現を予防するために患者及びその家族に以下の点について十分説明・指導すること。[11.1.1参照]
・指示された飲水量、用法・用量を厳守すること。
・過度に飲水してしまった場合は本剤の投与を行わないこと。発熱、喘息等の飲水が増加する疾患を合併している場合は特に注意すること。
・水中毒を示唆する症状(倦怠感、頭痛、悪心・嘔吐等)があらわれた場合には直ちに投与を中断し、速やかに医師に連絡すること。
・他院や他科を受診する際には、本剤投与中である旨を担当医師に報告すること。
8.4 尿量が自然に減少する患者がいるので観察を十分にし漫然と投与しないこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 高血圧を伴う循環器疾患、高度動脈硬化症、冠動脈血栓症、狭心症の患者
血圧上昇により症状を悪化させるおそれがある。
9.1.2 下垂体前葉不全を伴う患者
病状が不安定なため、水中毒等が発現しやすい。[11.1.1参照]
9.1.3 アレルギー性鼻炎を起こしたことのある患者
9.1.4 鼻疾患を有する患者
鼻腔内投与のため吸収が安定しないおそれがある。
9.1.5 本剤の成分に対し過敏症の既往歴のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。アナフィラキシーが発現するおそれがある。[11.1.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
低出生体重児、新生児及び乳児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
症状を観察しながら慎重に投与すること。生理機能が低下している。
10. 相互作用
10.2 併用注意
| 三環系抗うつ剤 (イミプラミン塩酸塩等) [11.1.1参照] | 低ナトリウム血症性の痙攣発作の報告があるので、血清ナトリウム、血漿浸透圧等をモニターすること。 | 抗利尿ホルモンを分泌し、水分貯留のリスクを増すことがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 脳浮腫、昏睡、痙攣等を伴う重篤な水中毒(頻度不明)
11.1.2 アナフィラキシー(頻度不明)[9.1.5参照]
注)発現頻度は、デスモプレシン点鼻液0.01%協和の承認時までの臨床試験及び1982年4月までの副作用頻度調査、点鼻スプレー2.5μg「フェリング」の承認時までの臨床試験、点鼻スプレー10μg「フェリング」の承認時までの臨床試験及び使用成績調査に基づく。
11.2 その他の副作用
| 0.5〜5%未満 | 0.5%未満 | |
| 代謝 | 浮腫、低ナトリウム血症 | |
| 精神神経系 | 頭痛 | 強直性痙攣、眠気、めまい、不眠 |
| 過敏症 | 全身そう痒感、発疹、顔面浮腫、じん麻疹 | |
| 消化器 | 嘔気・嘔吐 | 食欲不振、腹痛 |
| 循環器 | 顔面蒼白、のぼせ | |
| その他 | 鼻粘膜刺激 | 鼻炎、発汗、全身倦怠感、鼻出血、発熱 |
13. 過量投与
13.1 症状
水分貯留並びに低ナトリウム血症のリスクが高まり、頭痛、冷感、嘔気、痙攣、意識喪失等があらわれることがある。
13.2 処置
投与を中止し、水分を制限する。症状がある場合は等張若しくは高張食塩水の注入、フロセミドの投与等適切な処置を行う。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 投与時
投与前には吸収を安定させるため鼻をかむなどの注意をすること。
14.1.2 スプレーによる鼻腔内投与法
製品に同封されている「デスモプレシン点鼻スプレー2.5μg「フェリング」のご使用にあたって」の説明文書も参照すること。
(1)容器から保護キャップを外す。
(2)容器からストッパーを外す。
(3)親指で底部を支え、人差指と中指でポンプを押さえて容器を持つ。
注意1
本剤を初めて使用するときには、ポンプを数回(4回程度)押してチューブに薬液が吸い上げられるようにし、薬液が霧状に出てくることを確認してから使用する。
また、長期間(1週間以上)使用していなかった場合等にもポンプを1回若しくは薬液が霧状に出てくるまで空打ちしてから使用する必要がある。
また、長期間(1週間以上)使用していなかった場合等にもポンプを1回若しくは薬液が霧状に出てくるまで空打ちしてから使用する必要がある。
注意2
スプレー使用時には、瓶の内側のチューブの先端が必ず薬液の中に入っている状態で使用する。
(4)頭を少し後ろに傾け、ノズルの先端を鼻腔に入れ、息を止めてスプレーする。スプレー回数が複数の場合は、左右の鼻腔に交互にスプレーする。
(5)スプレー後は薬液を鼻の奥まで行き渡らせるように、頭を後ろに傾けた状態で軽く鼻を押さえ、鼻から静かに息を吸うようにする。
(6)使用後はストッパーを取り付けノズルの先端をふいて、保護キャップをする。
14.1.3 保管
使用しないときは、冷蔵庫等で瓶を立てた状態にして保管する。
注意
ポケット等、体温が直接伝わるところに入れて携帯すると液漏れを起こすおそれがあるので、携帯時には収納ケースにおさめてバッグ等に入れて携帯する。
15. その他の注意
15.2 非臨床試験に基づく情報
動物実験(ラット)で泌乳低下(母乳の出が悪くなる)の可能性が示唆されている。
16. 薬物動態
16.1 血中濃度
健康成人男性19例に本剤5μg(2噴霧量)を鼻腔内投与したときのデスモプレシン酢酸塩水和物(DDAVP)の血漿中濃度推移及び薬物動態パラメータは以下のとおりである1)。
本剤を鼻腔内投与したときの血漿中濃度推移
| Cmax(pg/mL) | tmax(min) | AUC0-∞(pg・min/mL) | t1/2(min) |
| 10.53±6.20 | 42±31 | 1683±1146 | 153±122 |
16.3 分布
16.3.1 体組織への分布
ラットに125I-デスモプレシン0.2μgを点鼻投与したとき、30分後の放射能濃度は甲状腺>膀胱>腎臓>肝臓の順であった2)。
16.3.2 胎児への移行性
妊娠ラットに125I-デスモプレシン0.3μgを点鼻投与したとき、30分後の胎児における放射能濃度は母体血漿中の約1/10であった3)。
16.3.3 母乳中への移行性
授乳期のラットに125I-デスモプレシン0.3μgを点鼻投与したとき、30分後の乳汁中放射能濃度は母体血漿中の約1.4倍であった3)。
16.3.4 蛋白結合率
ヒト血清蛋白結合率は以下のとおりであった4)(in vitro)。
| 添加濃度(pg/mL) | 2 | 50 | 100 |
| 血清蛋白結合率(%) | 76.3±3.3 | 74.2±2.8 | 74.0±3.4 |
16.5 排泄
尿崩症患者の糸球体でろ過されたDDAVPの約60%が尿中に排泄された5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
中枢性尿崩症と診断され、デスモプレシン点鼻液にて治療中で安定した効果の得られている患者57例を対象として本剤を投与した結果、点鼻液と同等の有効性を示した6)。
副作用発現頻度は、5.5%(3/55例)であった。副作用は、めまい感3.6%(2/55例)、頭痛及び嘔気各1.8%(1/55例)であった。
副作用発現頻度は、5.5%(3/55例)であった。副作用は、めまい感3.6%(2/55例)、頭痛及び嘔気各1.8%(1/55例)であった。
18. 薬効薬理
18.1 作用機序
18.1.1 バソプレシンV2受容体に対する作用
本剤のラットにおけるバソプレシンV1、V2受容体及びオキシトシン受容体に対する結合親和性(Ki)はそれぞれ1748、1.04、481nmol/Lであり、バソプレシンV2受容体に選択的な結合親和性を示した(Ki:1.04nmol/L)。
またムスカリン受容体(M1、M2、M3)への結合親和性はほとんど認められなかった(Ki>1×105nmol/L)7)。
またムスカリン受容体(M1、M2、M3)への結合親和性はほとんど認められなかった(Ki>1×105nmol/L)7)。
18.1.2 水及び尿素透過性亢進作用
単離したゴールデンハムスター腎髄質内層部集合管において、管腔膜側から基底膜側への水及び尿素の透過性を、本剤はそれぞれ0.01nmol/L以上、0.1nmol/L以上の濃度で亢進した8)。
18.2 抗利尿作用
ラットに蒸留水を25mL/kg経口投与した後、本剤を皮下投与し、本剤投与後5時間までの尿量を測定したところ、0.1ng/kg以上で用量の増加に伴い尿量は減少した9)。
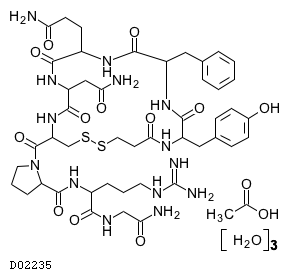
19. 有効成分に関する理化学的知見
19.1. デスモプレシン酢酸塩水和物
22. 包装
5mL[1瓶(褐色瓶、定量噴霧式点鼻容器、収納ケース)]
23. 主要文献
- 社内資料:酢酸デスモプレシン製剤の生物学的同等性試験
- 西垣淳子 他, 基礎と臨床, 29, 2517-2539, (1995)
- 西垣淳子 他, 基礎と臨床, 29, 2553-2560, (1995)
- 社内資料:125I-KW-8008のin vitro蛋白結合
- 清水倉一 他, 最新医学, 33, 1875-1882, (1978)
- 寺野隆 他, ホルモンと臨床, 44, 651-661, (1996)
- 社内資料:バソプレシンV2受容体に対する結合親和性(2003年1月31日承認、申請資料概要ホ-I-2、1))
- 社内資料:水及び尿素透過性亢進作用(2003年1月31日承認、申請資料概要ホ-I-2、2))
- 社内資料:尿排泄量に対する作用(2003年1月31日承認、申請資料概要ホ-I-1、1))
24. 文献請求先及び問い合わせ先
文献請求先
フェリング・ファーマ株式会社
くすり相談室
〒105-0001
東京都港区虎ノ門二丁目10番4号
電話:フリーダイヤル:0120-093-168
製品情報問い合わせ先
フェリング・ファーマ株式会社
くすり相談室
〒105-0001
東京都港区虎ノ門二丁目10番4号
電話:フリーダイヤル:0120-093-168
26. 製造販売業者等
26.1 製造販売元(輸入)
フェリング・ファーマ株式会社
東京都港区虎ノ門二丁目10番4号