医薬品情報
| 総称名 | ミネブロ |
|---|---|
| 一般名 | エサキセレノン |
| 欧文一般名 | Esaxerenone |
| 製剤名 | エサキセレノン製剤 |
| 薬効分類名 | 選択的ミネラルコルチコイド受容体ブロッカー |
| 薬効分類番号 | 2149 |
| KEGG DRUG |
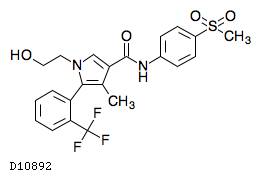
D10892
エサキセレノン
|
| KEGG DGROUP |
DG01676
アルドステロン拮抗薬
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年12月 改訂(第7版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ミネブロ錠1.25mg | MINNEBRO TABLETS | 第一三共 | 2149049F1027 | 47.8円/錠 | 処方箋医薬品注) |
| ミネブロ錠2.5mg | MINNEBRO TABLETS | 第一三共 | 2149049F2023 | 91.6円/錠 | 処方箋医薬品注) |
| ミネブロ錠5mg | MINNEBRO TABLETS | 第一三共 | 2149049F3020 | 137.4円/錠 | 処方箋医薬品注) |
| ミネブロOD錠1.25mg | MINNEBRO OD TABLETS | 第一三共 | 2149049F4026 | 47.8円/錠 | 処方箋医薬品注) |
| ミネブロOD錠2.5mg | MINNEBRO OD TABLETS | 第一三共 | 2149049F5022 | 91.6円/錠 | 処方箋医薬品注) |
| ミネブロOD錠5mg | MINNEBRO OD TABLETS | 第一三共 | 2149049F6029 | 137.4円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 高カリウム血症の患者もしくは本剤投与開始時に血清カリウム値が5.0mEq/Lを超えている患者[高カリウム血症を増悪させるおそれがある。]
2.3 重度の腎機能障害(eGFR 30mL/min/1.73m2未満)のある患者[9.2.1参照]
2.4 カリウム保持性利尿剤(スピロノラクトン、トリアムテレン、カンレノ酸カリウム)、アルドステロン拮抗剤(エプレレノン)又はカリウム製剤(塩化カリウム、グルコン酸カリウム、アスパラギン酸カリウム、ヨウ化カリウム(放射性ヨウ素による甲状腺の内部被曝の予防・低減に使用する場合を除く。)、酢酸カリウム)を投与中の患者[10.1参照]
4. 効能または効果
6. 用法及び用量
通常、成人にはエサキセレノンとして2.5mgを1日1回経口投与する。なお、効果不十分な場合は、5mgまで増量することができる。
7. 用法及び用量に関連する注意
7.1 本剤の投与中に血清カリウム値が5.0mEq/Lを超えた場合には減量を考慮し、5.5mEq/L以上の場合は減量ないし中止し、6.0mEq/L以上の場合には直ちに中止すること。[11.1.1参照]
8. 重要な基本的注意
8.1 高カリウム血症があらわれることがあるので、血清カリウム値を原則として投与開始前、投与開始後(又は用量調節後)2週以内及び約1ヵ月時点に測定し、その後も定期的に測定すること。[9.1.1、9.2.2、9.8.2、10.2、11.1.1参照]
8.2 降圧作用に基づくめまい等があらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.2.1 重度の腎機能障害(eGFR 30mL/min/1.73m2未満)のある患者
投与しないこと。高カリウム血症を誘発させるおそれがある。重度の腎機能障害のある患者を対象とした臨床試験は実施していない。[2.3参照]
9.2.2 中等度の腎機能障害(eGFR 30mL/min/1.73m2以上60mL/min/1.73m2未満)のある患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害(Child-Pugh分類C)のある患者
血中濃度が上昇するおそれがある。重度の肝機能障害のある患者を対象とした臨床試験は実施していない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠ラットで14C-エサキセレノン単回経口投与後の放射能の胎児への移行が認められている。また、ラット及びウサギで催奇形性はみられていないが、ラットで黄体数、着床数、生存胚数及び出生児体重の低値が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。授乳期ラットで14C-エサキセレノン単回経口投与後の放射能の乳汁中への移行が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
9.8.1 一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。
9.8.2 より頻回に血清カリウム値を測定すること。一般に腎機能が低下していることが多く、高カリウム血症の発現リスクが高まるおそれがある。[8.1参照]
10. 相互作用
相互作用序文
本剤は主に薬物代謝酵素CYP3Aで代謝される。
薬物代謝酵素用語
CYP3A
10.1 併用禁忌
10.2 併用注意
| アンジオテンシン変換酵素阻害剤 イミダプリル塩酸塩 エナラプリルマレイン酸塩等 アンジオテンシンII受容体拮抗剤 オルメサルタン メドキソミル アジルサルタン テルミサルタン等 アリスキレンフマル酸塩 シクロスポリン タクロリムス ドロスピレノン配合剤 ヨウ化カリウム(放射性ヨウ素による甲状腺の内部被曝の予防・低減に使用する場合) [8.1参照] | 血清カリウム値が上昇するおそれがあるので、血清カリウム値をより頻回に測定するなど十分に注意すること。 | カリウム貯留作用が増強するおそれがある。 |
| 強いCYP3A阻害剤 イトラコナゾール クラリスロマイシン エンシトレルビル フマル酸等 [8.1、16.7.1参照] | 血清カリウム値の上昇を誘発するおそれがあるので、血清カリウム値をより頻回に測定するなど注意すること。 | CYP3A阻害剤が本剤の代謝を阻害し、本剤の血漿中濃度が上昇する。 |
| 強いCYP3A誘導剤 リファンピシン フェニトイン カルバマゼピン等 セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 [16.7.2参照] | 本剤の作用が減弱するおそれがあるので、本剤投与時は、これらの薬剤・食品との併用を可能な限り避けること。 | CYP3A誘導剤が本剤の代謝を促進し、本剤の血漿中濃度が減少する。 |
| リチウム製剤 炭酸リチウム | リチウム中毒を起こすおそれがあるので、血中リチウム濃度に注意すること。 | 明確な機序は不明であるが、ナトリウムイオン不足はリチウムイオンの貯留を促進するといわれているため、ナトリウム排泄を促進することにより起こると考えられる。 |
| 非ステロイド性消炎鎮痛剤 インドメタシン等 [8.1参照] | 本剤の降圧作用の減弱や、腎機能障害患者では高カリウム血症があらわれるおそれがある。 | 明確な機序は不明であるが、プロスタグランジン産生が抑制されることによって、ナトリウム貯留作用による降圧作用の減弱、カリウム貯留作用による血清カリウム値の上昇が起こると考えられる。 危険因子:腎機能障害 |
| ミトタン | ミトタンの作用を阻害するおそれがある。 | 明確な機序は不明であるが、ミトタンの薬効を類薬(スピロノラクトン)が阻害するとの報告がある。 |
11. 副作用
11.1 重大な副作用
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 血液 | 貧血、血小板数減少、白血球数減少 | ||
| 代謝 | 血清カリウム値上昇、血中尿酸増加、高尿酸血症 | 痛風 | 低ナトリウム血症 |
| 精神神経系 | めまい、頭痛 | ||
| 消化器 | 下痢、悪心 | ||
| 過敏症 | 発疹 | ||
| 肝臓 | 肝機能異常、γ-GTP上昇 | ||
| 泌尿器 | 腎機能障害、GFR減少、血中クレアチニン増加、BUN上昇 | ||
| その他 | 異常感、低血圧 |
14. 適用上の注意
14.1 薬剤交付時の注意
<製剤共通>
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<OD錠>
14.1.2 OD錠は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.1.3 OD錠は寝たままの状態では、水なしで服用させないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)エサキセレノン錠
健康成人男性23例に、エサキセレノン5mgを空腹時単回経口投与したときの血漿中濃度推移及び薬物動態パラメータは次のとおりであった1)。
エサキセレノン単回経口投与時の血漿中濃度推移
| 投与量 | n | Cmax(ng/mL) | Tmax(hr)注1) | AUClast(ng・hr/mL) | t1/2(hr) |
| 5mg | 23 | 64.9±12.1 | 3.00(1.50,4.00) | 1,200±174 | 18.6±2.38 |
健康成人男性23例にエサキセレノン5mgを静脈内注2)に単回投与したときの全身クリアランスは3.7L/hr、分布容積は80Lであった1)。
(2)エサキセレノンOD錠
健康成人男性23例にエサキセレノンOD錠5mg1錠(水なしで服用又は水で服用)又はエサキセレノン錠5mg1錠(水で服用)を、クロスオーバー法で空腹時単回経口投与して薬物動態パラメータを比較した。Cmax及びAUClastの幾何最小二乗平均値の比の両側90%信頼区間は、いずれも0.80〜1.25の範囲内であり、両製剤の生物学的同等性が確認された2)。エサキセレノンOD錠1.25mg及びOD錠2.5mgは「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、標準製剤をエサキセレノンOD錠5mgとしたとき、溶出挙動は同等と判定され、生物学的に同等とみなされた。
| 投与量 | n | Cmax(ng/mL) | Tmax(hr)注1) | AUClast(ng・hr/mL) | t1/2(hr) |
| OD錠5mg(水なしで服用) | 23 | 77.0±11.1 | 2.50(1.50,4.00) | 1,260±172 | 18.0±2.42 |
| 錠5mg(水で服用) | 23 | 76.2±10.0 | 2.00(1.00,4.00) | 1,320±187 | 17.5±1.83 |
| 投与量 | n | Cmax(ng/mL) | Tmax(hr)注1) | AUClast(ng・hr/mL) | t1/2(hr) |
| OD錠5mg(水で服用) | 23 | 77.7±10.3 | 2.50(1.00,5.00) | 1,290±180 | 16.9±2.06 |
| 錠5mg(水で服用) | 23 | 75.0±8.18 | 2.50(1.00,4.50) | 1,250±152 | 16.7±1.89 |
16.1.2 反復投与
健康成人男性7例にエサキセレノン10mg注2)を1日1回10日間空腹時反復経口投与したとき、AUCの累積係数は1.36であった3)。
本態性高血圧症患者にエサキセレノン1.25mgから10mg注2)(各12又は13例)を反復経口投与したとき、初日のAUC及びCmaxは、投与量に比例して増加した。トラフ濃度は、投与開始後1週目で概ね定常状態に到達した。
16.2 吸収
16.2.1 食事の影響
健康成人男性23例にエサキセレノン5mgを空腹時あるいは食後に単回経口投与したとき、Cmax及びAUCに食事の影響は認められなかった1)。
16.2.2 生物学的利用率
健康成人男性23例にエサキセレノン5mgを空腹時に単回経口投与したとき、生物学的利用率は89%であった1)。
16.3 分布
16.3.1 血清蛋白結合率
エサキセレノンのヒト血漿蛋白結合率は98%以上と高く、濃度依存性は認められなかった(in vitro)。
16.4 代謝
エサキセレノンの主要な消失経路は代謝である。血漿中の主成分はエサキセレノンであり、総放射能に対するAUCの比は40.8%であった。他にO-グルクロナイド(M4)及びアミド結合加水分解物のアシルグルクロナイド(M11)が認められた。エサキセレノンの代謝には酸化、グルクロン酸抱合及び加水分解が関与すると推定された(外国人データ)。
In vitro代謝試験から、エサキセレノンはCYP3A4/5及び複数のUGT分子種により代謝されることが示された。
In vitro代謝試験から、エサキセレノンはCYP3A4/5及び複数のUGT分子種により代謝されることが示された。
16.5 排泄
健康成人男性6例に14C-エサキセレノン20mg注2)を単回経口投与したマスバランス試験では、投与後288時間までに、投与された放射能のそれぞれ54.0%及び38.5%が糞中及び尿中に排泄され、総排泄率は92.5%であった。投与されたエサキセレノンの大部分が尿糞中に代謝物として排泄され、未変化体の糞中及び尿中排泄率はそれぞれ18.7%及び1.6%であった。尿糞中には代謝物として酸化体、M4及びM11などが認められた(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
中等度腎機能障害(eGFR 30mL/min/1.73m2以上60mL/min/1.73m2未満)のある高血圧症患者30例にエサキセレノン1.25mgを1日1回経口投与したときのエサキセレノンの初日の薬物動態パラメータ及び2週目以降のトラフ値は、本態性高血圧症患者を対象とした試験と比較して、顕著な差は認められなかった。
16.6.2 肝機能障害患者
軽度あるいは中等度肝機能障害患者(それぞれChild-Pugh分類A及びB)各6例にエサキセレノン2.5mgを単回経口投与したとき、正常肝機能被験者と比較して軽度肝機能障害患者ではAUCは18%低下し、Cmaxは同程度であった。中等度肝機能障害患者ではAUCは10%増加し、Cmaxは20%低下した4)。
16.7 薬物相互作用
16.7.1 イトラコナゾール
16.7.2 リファンピシン
16.7.3 アムロジピン
健康成人男性22例にエサキセレノン2.5mgをアムロジピン10mg(1日1回)と併用投与したとき、血漿中エサキセレノンの薬物動態にアムロジピンによる影響は認められなかった。健康成人男性18例にアムロジピン2.5mgをエサキセレノン5mg(1日1回)と併用投与したとき、血漿中アムロジピンのAUCは単独投与と比較して1.2倍に増加したが、Cmaxの増加は認められなかった。
16.7.4 ジゴキシン
健康成人男性19例にジゴキシン0.25mg(1日1回)をエサキセレノン5mg(1日1回)と併用投与したとき、定常状態の血漿中ジゴキシンのCmaxは単独投与と比較して13%増加したが、トラフ時血漿中濃度及びAUCの増加は認められなかった。
注2)本剤の承認された用法及び用量は2.5mg及び5mg経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験(本態性高血圧症に対する用量設定試験)
本態性高血圧症患者を対象に、エサキセレノンを1日1回12週間投与したプラセボ対照二重盲検比較試験の結果は次のとおりであった。プラセボ群に比べて、2.5mg群及び5mg群のトラフ時座位血圧の変化量注1)に有意な差(P<0.001)が認められた6)。
| 投与群 | n | トラフ時座位血圧(mmHg) | |||
| 収縮期 | 拡張期 | ||||
| 投与前値注2) | 投与前からの変化量注3) | 投与前値注2) | 投与前からの変化量注3) | ||
| プラセボ群 | 85 | 156.7±9.04 | −7.0 [−9.5,−4.6] | 96.8±4.95 | −3.8 [−5.2,−2.4] |
| エサキセレノン1.25mg群 | 82 | 156.4±9.05 | −10.7 [−13.2,−8.2] | 97.2±5.48 | −5.0 [−6.4,−3.6] |
| エサキセレノン2.5mg群 | 84 | 156.4±8.43 | −14.3 [−16.8,−11.9] | 98.6±5.62 | −7.6 [−9.1,−6.2] |
| エサキセレノン5mg群 | 88 | 157.4±9.04 | −20.6 [−23.0,−18.2] | 97.2±5.43 | −10.4 [−11.8,−9.0] |
注1)Last observation carried forward法により欠測値を補完
注2)mean±SD
注3)投与群を因子、投与前の基準血圧を共変量とした共分散分析による最小二乗平均値、[ ]は両側95%信頼区間
副作用(臨床検査値異常を含む)は本剤投与群255例中27例(10.6%)に認められ、主な副作用は血清カリウム値上昇6例(2.4%)、血中尿酸増加6例(2.4%)、GFR減少6例(2.4%)等であった。
17.1.2 国内第III相試験(本態性高血圧症に対する検証試験)
本態性高血圧症患者を対象に、エプレレノン50mgを対照としてエサキセレノンを1日1回12週間投与した二重盲検比較試験の結果は次のとおりであった。エプレレノン50mg群とエサキセレノン2.5mg群におけるトラフ時の座位血圧変化量の群間差の点推定値[両側95%信頼区間]は、収縮期血圧−1.6mmHg[−3.3,0.1]、拡張期血圧−0.7mmHg[−1.8,0.3]であり、いずれも両側95%信頼区間の上限が非劣性マージン(収縮期血圧3.4mmHg、拡張期血圧1.5mmHg)を下回ったため、エサキセレノン2.5mg群のエプレレノン50mg群に対する非劣性が検証された7)。
| 投与群 | n | トラフ時座位血圧(mmHg) | |||
| 収縮期 | 拡張期 | ||||
| 投与前値注1) | 投与前からの変化量注2) | 投与前値注1) | 投与前からの変化量注2) | ||
| エプレレノン50mg群 | 316 | 155.0±9.59 | −12.1 [−13.3,−10.9] | 98.3±5.54 | −6.1 [−6.8,−5.4] |
| エサキセレノン2.5mg群 | 306 | 154.7±9.52 | −13.7 [−14.9,−12.5] | 97.9±5.70 | −6.8 [−7.6,−6.1] |
| エサキセレノン5mg群 | 322 | 155.3±9.42 | −16.9 [−18.1,−15.7] | 97.7±5.38 | −8.4 [−9.1,−7.7] |
副作用(臨床検査値異常を含む)は本剤投与群669例中56例(8.4%)に認められ、主な副作用は血清カリウム値上昇13例(1.9%)、血中尿酸増加12例(1.8%)、高尿酸血症5例(0.7%)等であった。
17.1.3 国内第III相試験(長期投与試験)
本態性高血圧症患者(368例)を対象に、エサキセレノン2.5〜5mg(2.5mgより開始)を1日1回28〜52週間単独投与、又はカルシウム拮抗剤あるいはレニン−アンジオテンシン系阻害剤と併用投与したところ、いずれも安定した降圧効果が得られた8)。
副作用(臨床検査値異常を含む)は368例中71例(19.3%)に認められ、主な副作用は血清カリウム値上昇25例(6.8%)、高尿酸血症7例(1.9%)、貧血6例(1.6%)、肝機能異常6例(1.6%)、腎機能障害5例(1.4%)等であった。
副作用(臨床検査値異常を含む)は368例中71例(19.3%)に認められ、主な副作用は血清カリウム値上昇25例(6.8%)、高尿酸血症7例(1.9%)、貧血6例(1.6%)、肝機能異常6例(1.6%)、腎機能障害5例(1.4%)等であった。
17.1.4 国内第III相試験(III度高血圧症)
III度高血圧症患者(20例)を対象に、エサキセレノン2.5〜5mg(2.5mgより開始)を1日1回8週間投与したところ、安定した降圧効果が得られた9)。
副作用(臨床検査値異常を含む)は20例中2例(10.0%)に認められ、血清カリウム値上昇が2例(10.0%)であった。
副作用(臨床検査値異常を含む)は20例中2例(10.0%)に認められ、血清カリウム値上昇が2例(10.0%)であった。
17.1.5 国内第III相試験(中等度腎機能障害のある高血圧症)
17.1.6 国内第III相試験(アルブミン尿を有する2型糖尿病を伴う高血圧症)
17.1.7 国内第III相試験(原発性アルドステロン症)
原発性アルドステロン症患者(44例)を対象に、エサキセレノン2.5〜5mg(2.5mgより開始)を1日1回12週間投与したところ、安定した降圧効果が得られた12)。
副作用(臨床検査値異常を含む)は44例中11例(25.0%)に認められ、主な副作用は血清カリウム値上昇2例(4.5%)、GFR減少2例(4.5%)等であった。
副作用(臨床検査値異常を含む)は44例中11例(25.0%)に認められ、主な副作用は血清カリウム値上昇2例(4.5%)、GFR減少2例(4.5%)等であった。
18. 薬効薬理
18.1 作用機序
エサキセレノンは非ステロイド構造を有するミネラルコルチコイド受容体ブロッカーであり、核内受容体であるミネラルコルチコイド受容体に選択的に結合し、レニン−アンジオテンシン系等により生成が促進される副腎皮質ホルモンのアルドステロンによるミネラルコルチコイド受容体の活性化を阻害する。過剰なミネラルコルチコイド受容体の活性化により、尿中ナトリウム及び水分の再吸収の促進などによる血圧上昇が起こり、心臓、血管、腎臓などの組織障害を促進することが知られている。エサキセレノンはミネラルコルチコイド受容体の活性化を抑制することで、降圧作用を発揮するものと考えられる。
18.2 受容体結合の選択性
エサキセレノンは、ラット及びヒトのミネラルコルチコイド受容体に結合しアルドステロンの結合及び受容体活性化を阻害した。一方でグルココルチコイド受容体等、他のステロイドホルモン受容体に対する親和性を示さず、それぞれの特異的リガンドによる受容体活性化を阻害しなかった。またミネラルコルチコイド受容体を含むすべてのステロイドホルモン受容体に対する活性化能は認められなかった。
18.3 ミネラルコルチコイド受容体阻害作用(in vivo)
18.3.1 アルドステロンによる尿中ナトリウム/カリウム濃度比の低下に対する作用
両副腎摘出ラットにアルドステロンを皮下投与すると腎尿細管のミネラルコルチコイド受容体が活性化されナトリウム再吸収及びカリウム排泄が促進するため尿中ナトリウム/カリウム濃度比が低下する。エサキセレノンの単回経口投与は、アルドステロン投与による尿中ナトリウム/カリウム濃度比の低下を抑制した。
18.3.2 尿中電解質に対する作用
カニクイザルの腎尿細管のミネラルコルチコイド受容体を阻害するとナトリウム再吸収及びカリウム排泄が抑制され尿中ナトリウム/カリウム濃度比が増加する。エサキセレノンの単回経口投与は、尿中ナトリウム/カリウム濃度比を用量依存的に増加した。
18.4 降圧作用
19. 有効成分に関する理化学的知見
19.1. エサキセレノン
20. 取扱い上の注意
<製剤共通>
20.1 ミネブロ錠1.25mg、ミネブロ錠2.5mg、ミネブロOD錠1.25mg及びミネブロOD錠2.5mgの錠剤表面には使用色素により、黄色の斑点がみられることがある。ミネブロ錠5mg及びミネブロOD錠5mgの錠剤表面には使用色素により、赤色の斑点がみられることがある。
<OD錠>
20.2 アルミピロー開封後は湿気を避けて保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ミネブロ錠1.25mg>
(PTP) 100錠(10錠×10)
<ミネブロ錠2.5mg>
(PTP) 100錠(10錠×10)
<ミネブロ錠5mg>
(PTP) 100錠(10錠×10)
<ミネブロOD錠1.25mg>
(PTP) 100錠(10錠×10)
<ミネブロOD錠2.5mg>
(PTP) 100錠(10錠×10)
<ミネブロOD錠5mg>
(PTP) 100錠(10錠×10)
23. 主要文献
- Kurata A,et al., Adv Ther., 36 (7), 1618-1627, (2019) »PubMed
- 社内資料:エサキセレノンOD錠5mgとエサキセレノン錠5mgの生物学的同等性試験
- Kato M,et al., Br J Clin Pharmacol., 84 (8), 1821-1829, (2018) »PubMed
- Kurata A,et al., Adv Ther., 37 (1), 253-264, (2020) »PubMed
- Kirigaya Y,et al., Br J Clin Pharmacol., 86 (10), 2070-2079, (2020) »PubMed
- Ito S,et al., Hum Hypertens., 33 (7), 542-551, (2019)
- Ito S,et al., Hypertension., 75 (1), 51-58, (2020) »PubMed
- Rakugi H,et al., Hypertens Res., 42 (12), 1932-1941, (2019) »PubMed
- 楽木宏実ほか, Prog Med., 40 (7), 755-760, (2020)
- Ito S,et al., Hypertens Res., 44 (5), 489-497, (2021) »PubMed
- Itoh H,et al., Hypertens Res., 42 (10), 1572-1581, (2019) »PubMed
- Satoh F,et al., Hypertens Res., 44 (4), 464-472, ( 2021) »PubMed
- Arai K,et al., J Pharmacol Exp Ther., 358 (3), 548-557, (2016) »PubMed
- Arai K,et al., Eur J Pharmacol., 769, 266-273, (2015) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1