医薬品情報
| 総称名 | アロカリス |
|---|---|
| 一般名 | ホスネツピタント塩化物塩酸塩 |
| 欧文一般名 | Fosnetupitant Chloride Hydrochloride Fosnetupitant |
| 製剤名 | ホスネツピタント塩化物塩酸塩注射剤 |
| 薬効分類名 | 選択的NK1受容体拮抗型制吐剤 |
| 薬効分類番号 | 2391 |
| KEGG DRUG |
D11370
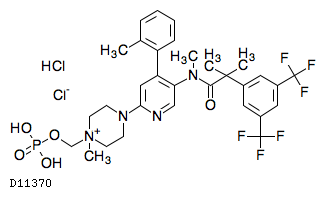
ホスネツピタント塩化物塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アロカリス点滴静注235mg | Arokaris I.V.infusion | 大鵬薬品工業 | 2391406A1029 | 11276円/瓶 | 劇薬, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)(遅発期を含む)
5. 効能または効果に関連する注意
6. 用法及び用量
他の制吐剤との併用において、通常、成人にはホスネツピタントとして235mgを抗悪性腫瘍剤投与1日目に1回、点滴静注する。
7. 用法及び用量に関連する注意
7.1 抗悪性腫瘍剤投与前に投与を終了すること。
7.2 本剤は、原則としてコルチコステロイド及び5-HT3受容体拮抗型制吐剤と併用して使用すること。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 中等度以上の肝機能障害患者(Child-Pughスコア7以上)
血中濃度が上昇するおそれがある。[16.6.1参照]
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び最終投与後1ヵ月間において避妊する必要性及び適切な避妊法について説明すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で本剤の乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤の活性本体ネツピタントは主にCYP3Aで代謝される。また、本剤の活性本体ネツピタントはCYP3A阻害作用を有する。[8.、16.4参照]
薬物代謝酵素用語
CYP3A
10.2 併用注意
| CYP3Aを阻害する薬剤 ケトコナゾール、クラリスロマイシン、フルコナゾール、イトラコナゾール等 [16.7.1参照] | 本剤の活性本体ネツピタントの作用が増強するおそれがある。 本剤と強いCYP3A阻害剤との併用は慎重に行うこと。 | CYP3A阻害剤との併用により、本剤の活性本体ネツピタントの血漿中濃度が上昇するおそれがある。 |
| CYP3Aを誘導する薬剤 リファンピシン、フェニトイン等 [16.7.2参照] | 本剤の活性本体ネツピタントの作用が減弱するおそれがある。 本剤と強いCYP3A誘導剤との併用は治療上やむを得ないと判断される場合を除き避けること。 | CYP3A誘導剤との併用により、本剤の活性本体ネツピタントの血漿中濃度が低下するおそれがある。 |
| CYP3Aで代謝される薬剤 デキサメタゾン、ドセタキセル、シクロホスファミド、エトポシド、ピモジド、ミダゾラム、エリスロマイシン、経口避妊剤(エチニルエストラジオール・レボノルゲストレル)等 [7.3、16.7.3参照] | これらの薬剤の作用が増強されるおそれがある。 なお、デキサメタゾンを併用する場合は、デキサメタゾンの用量を減量するなど用量に注意すること。 | 本剤の活性本体ネツピタントのCYP3A阻害作用により、これらの薬剤の血漿中濃度が上昇するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | |
| 消化器 | 便秘 | 下痢 | 腹部膨満、腹痛、口内乾燥 |
| 肝臓 | ALT上昇 | 肝機能異常、AST上昇、ALP上昇、ビリルビン上昇 | |
| 精神神経系 | 頭痛、めまい | ||
| 呼吸器 | しゃっくり | ||
| 循環器 | QT延長、心室性期外収縮、高血圧、潮紅 | ||
| 過敏症 | 蕁麻疹、湿疹 | ||
| その他 | 倦怠感、食欲不振 | 低ナトリウム血症、低カリウム血症、耳鳴、味覚障害 |
14. 適用上の注意
14.1 薬剤調製時の注意
本剤は泡立つため、輸液バッグ等に注入する際は緩徐に注入し、静かに転倒混和すること。
14.2 薬剤投与時の注意
本剤は、30分かけて点滴静注すること。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)国内第I相試験
<健康成人>
日本人健康成人に本剤118mg、235mg、353mgを30分かけて点滴静脈内投与したとき、ホスネツピタントは速やかに活性本体ネツピタントに代謝された。ホスネツピタント及びネツピタントの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった1)。
| 本剤投与量(mg) | 例数 | Cmax(ng/mL) | tmax(h) | AUCinf(ng・h/mL) | t1/2(h) | |
| 118 | ホスネツピタント | 8 | 3430±450 | 0.34±0.13 | 1557±198 | 0.26±0.33 |
| ネツピタント | 8 | 344±62 | 0.52±0.06 | 6196±1531 | 68.6±19.8 | |
| 235 | ホスネツピタント | 7 | 6291±681 | 0.36±0.13 | 2896±320 | 0.96±0.45 |
| ネツピタント | 7 | 852±138 | 0.52±0.06 | 17718±4067 | 70.4±22.3 | |
| 353 | ホスネツピタント | 7 | 8742±1666 | 0.43±0.12 | 3970±744 | 0.97±0.27 |
| ネツピタント | 7 | 1160±289 | 0.64±0.38 | 25944±4562 | 68.6±14.7 |
(2)国内第II相試験
<悪性腫瘍患者>
日本人悪性腫瘍患者に本剤235mgを30分かけて点滴静脈内投与したとき、ホスネツピタントは速やかに活性本体ネツピタントに代謝された。ホスネツピタント及びネツピタントの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった2)。
| 本剤投与量(mg) | 例数 | Cmax(ng/mL) | tmax(h) | AUClast(ng・h/mL) | t1/2(h) | |
| 235 | ホスネツピタント | 10 | 8448±1438 | 0.41±0.12 | 4283±651 | 0.60±0.51※1 |
| ネツピタント | 10 | 1009±341 | 0.68±0.48 | 15259±4451 | 69.5±30.6※2 |
16.3 分布
ホスネツピタント及びネツピタントの血漿蛋白結合率は、それぞれ93.5%及び99.67%であった(in vitro)。
ホスネツピタントはOATP1B1及びOATP1B3の基質であった(in vitro)。ネツピタントはP-糖蛋白質の基質の輸送を5μmol/Lで有意に阻害し、BCRPの基質の輸送を6μmol/Lで50%阻害した(in vitro)。有色ラットで本剤関連成分のメラニン含有組織(眼球・ブドウ膜等)への親和性が認められた。
ホスネツピタントはOATP1B1及びOATP1B3の基質であった(in vitro)。ネツピタントはP-糖蛋白質の基質の輸送を5μmol/Lで有意に阻害し、BCRPの基質の輸送を6μmol/Lで50%阻害した(in vitro)。有色ラットで本剤関連成分のメラニン含有組織(眼球・ブドウ膜等)への親和性が認められた。
16.4 代謝
ホスネツピタントは、速やかに活性本体ネツピタントに代謝され、ネツピタントは主に脱メチル体及び2種の酸化体に代謝された2)3)。ネツピタントは主にCYP3Aで代謝されたが、CYP2C9及び2D6も代謝に一部関与した(in vitro)。[10.参照]
ネツピタントはCYP3Aの活性を阻害定数1.1〜2.2μmol/Lで阻害し、UGT2B7の活性を0.7μmol/Lで50%阻害した(in vitro)。
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
16.7 薬物相互作用
16.7.1 CYP3Aを阻害する薬剤
(1)ケトコナゾール
16.7.2 CYP3Aを誘導する薬剤
(1)リファンピシン
16.7.3 CYP3Aで代謝される薬剤
(1)ミダゾラム
(2)エリスロマイシン
(3)ドセタキセル
(4)シクロホスファミド
(5)エトポシド
(6)経口避妊剤(エチニルエストラジオール・レボノルゲストレル)
(7)デキサメタゾン
16.7.4 P-糖蛋白質の基質薬
(1)ジゴキシン
健康成人16名に対して、ジゴキシン(1日目:0.5mgを3回、2日目以降:0.25mgを連日)の反復投与時に、ネツピタント(8日目450mg)注)を併用投与したとき、ジゴキシンのAUC0-24は単独投与時と比べ1.04倍であった12)(外国人データ)。
16.7.5 その他の制吐剤
(1)パロノセトロン
健康成人18名にネツピタント(450mg)注)とパロノセトロン(0.75mg)を併用投与したとき、パロノセトロンのAUCinfは単独投与時と比べ1.10倍であった7)(外国人データ)。
(2)グラニセトロン
日本人健康成人22名に本剤(235mg)とグラニセトロン(40μg/kg)を併用投与したとき、グラニセトロンのAUCinfは単独投与時と比べ1.07倍であった13)。
注)本剤の承認された用量は、ホスネツピタントとして抗悪性腫瘍剤投与1日目に1回235mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(10057030試験)
高度催吐性抗悪性腫瘍剤投与※1に起因する消化器症状(悪心・嘔吐)に対する本剤(235mg)単回静脈内投与※2の有効性について、ホスアプレピタント(150mg)単回静脈内投与※2を対照に比較した第III相二重盲検試験成績は以下のとおりである。[5.、7.3参照]
| 主要評価項目 | 副次評価項目 | ||
| 投与群 | 全期間※3 嘔吐完全抑制率※6 | 急性期※4 嘔吐完全抑制率※6 | 遅発期※5 嘔吐完全抑制率※6 |
| 本剤 | 75.2%※7 (295/392) | 93.9% (368/392) | 76.8% (301/392) |
| ホスアプレピタント | 71.0%※7 (279/393) | 92.6% (364/393) | 72.8% (286/393) |
本剤の副作用発現率は22.2%(87/392名)であった。主な副作用は便秘11.2%(44/392名)、しゃっくり4.8%(19/392名)であった14)。
17.1.2 国内第III相試験(10057040試験)
17.3 その他
17.3.1 心電図への影響
健康成人200名(外国人)にネツピタント(プラセボ、200mg、600mg)をパロノセトロン(プラセボ、0.5mg、1.5mg)併用下で投与し心電図に対する影響を評価したところ、心臓再分極に対して影響しないことが確認された16)。
18. 薬効薬理
18.1 作用機序
ホスネツピタントは、静脈内投与後、速やかに活性本体ネツピタントに代謝される。ネツピタントは、ニューロキニン1(NK1)受容体に対して、選択的な拮抗作用を示す。
18.2 ホスネツピタントの薬理作用
ヒトNK1受容体に対するホスネツピタントのpKi値は9.92であった17)(in vitro)。
18.3 活性本体ネツピタントの薬理作用
18.3.1 NK1受容体に対する結合阻害活性
ヒトNK1受容体に対するネツピタントのpKi値は8.90であった18)(in vitro)。
18.3.2 各種薬剤誘発嘔吐反応に対する作用
フェレットにネツピタント(3mg/kg)を経口投与したとき、アポモルヒネ、モルヒネ、トコン又は硫酸銅投与により誘発された嘔吐反応を完全に抑制した19)。
18.3.3 シスプラチン誘発嘔吐反応に対する作用
フェレットにネツピタント(0.03、0.1、0.3mg/kg)を経口投与したとき、シスプラチン投与により誘発される嘔吐反応を0.1及び0.3mg/kgの用量において有意に抑制した19)。
18.3.4 シスプラチン誘発嘔吐反応に対するパロノセトロン及びデキサメタゾンとの併用効果
フェレットにネツピタント(1mg/kg)及びパロノセトロン(0.1mg/kg)を経口投与し、更にデキサメタゾン(1mg/kg)を腹腔内投与したとき、シスプラチン投与により誘発される嘔吐反応を有意に抑制し、また、パロノセトロン及びデキサメタゾンの投与時と比べ抑制した20)。
18.3.5 アポモルヒネ誘発嘔吐反応に対する作用
フェレットにネツピタント(0.03、0.1、0.3mg/kg)を経口投与したとき、アポモルヒネ投与により誘発される嘔吐反応を0.03、0.1及び0.3mg/kgの用量において有意に抑制した19)。
19. 有効成分に関する理化学的知見
19.1. ホスネツピタント塩化物塩酸塩
20. 取扱い上の注意
20.1 紙箱から取り出して長期間保存した場合は、光により分解又は容易に着色するため、紙箱から取り出した後は速やかに使用するか又は遮光すること。
20.2 次の場合には使用しないこと。
内容液が無色〜微黄色の範囲を超えて着色しているとき
20.3 凍結しないように注意すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
5バイアル
23. 主要文献
- ホスネツピタントの薬物動態試験成績(承認年月日:2022年3月28日、CTD2.7.6.1)
- Sugawara,S.,et al., Cancer, 125 (22), 4076-4083, (2019) »PubMed
- Gilmore,J.,et al., J.Clin.Pharmacol., 59 (4), 472-487, (2019) »PubMed
- ネツピタントの薬物動態試験成績(承認年月日:2022年3月28日、CTD2.7.6.3)
- ネツピタントの薬物動態試験成績(承認年月日:2022年3月28日、CTD2.7.6.12)
- 肝機能障害患者におけるネツピタントの薬物動態試験成績(承認年月日:2022年3月28日、CTD2.7.6.8)
- Calcagnile,S.,et al., Support.Care Cancer, 21 (10), 2879-2887, (2013) »PubMed
- Lanzarotti,C.,et al., Support.Care Cancer, 21 (10), 2783-2791, (2013) »PubMed
- ネツピタントとCYP3Aで代謝される薬剤(抗悪性腫瘍剤)との薬物相互作用の検討(承認年月日:2022年3月28日、CTD2.7.6.6)
- ホスネツピタントとデキサメタゾンとの薬物相互作用の検討(承認年月日:2022年3月28日、CTD2.7.6.10)
- ネツピタントとデキサメタゾンとの薬物相互作用の検討(承認年月日:2022年3月28日、CTD2.7.6.4)
- Natale,J.J.,et al., J.Oncol.Pharm.Pract., 22 (3), 485-495, (2016) »PubMed
- ホスネツピタントとグラニセトロンとの薬物相互作用の検討(承認年月日:2022年3月28日、CTD2.7.6.9)
- Hata A,et al., J.Clin.Oncol., 40 (2), 180-188, (2022) »PubMed
- ホスネツピタントの国内第III相安全性試験成績(承認年月日:2022年3月28日、CTD2.7.6.21)
- ネツピタント及びパロノセトロンの心電図への影響(承認年月日:2022年3月28日、CTD2.7.6.16)
- ホスネツピタントの各種受容体結合阻害試験(承認年月日:2022年3月28日、CTD2.6.2.2)
- ネツピタントの各種受容体結合阻害試験(承認年月日:2022年3月28日、CTD2.6.2.2)
- Rudd,J.A.,et al., Front.Pharmacol., 7 (263), 1-11, (2016)
- シスプラチン誘発嘔吐反応に対するネツピタント,パロノセトロン及びデキサメタゾンの3剤併用試験(承認年月日:2022年3月28日、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
製品情報問い合わせ先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
26. 製造販売業者等
26.1 製造販売元
大鵬薬品工業株式会社
東京都千代田区神田錦町1-27
26.2 提携先
HELSINN
スイス