医薬品情報
| 総称名 | ケレンディア |
|---|---|
| 一般名 | フィネレノン |
| 欧文一般名 | Finerenone |
| 製剤名 | フィネレノン錠 |
| 薬効分類名 | 非ステロイド型選択的ミネラルコルチコイド受容体拮抗薬 |
| 薬効分類番号 | 2190 |
| ATCコード | C03DA05 |
| KEGG DRUG |
D10633
フィネレノン
|
| KEGG DGROUP |
DG01676
アルドステロン拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(第6版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ケレンディア錠10mg | Kerendia tablets 10mg | バイエル薬品 | 2190044F1020 | 143.9円/錠 | 処方箋医薬品注) |
| ケレンディア錠20mg | Kerendia tablets 20mg | バイエル薬品 | 2190044F2027 | 205.8円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
2型糖尿病を合併する慢性腎臓病
ただし、末期腎不全又は透析施行中の患者を除く。
ただし、末期腎不全又は透析施行中の患者を除く。
5. 効能または効果に関連する注意
5.1 アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬による治療が適さない場合を除き、これらの薬剤が投与されている患者に投与すること。
5.2 本剤投与によりeGFRが低下することがあることから、eGFRが25mL/min/1.73m2未満の患者には、リスクとベネフィットを考慮した上で、本剤投与の適否を慎重に判断すること。[8.2、9.2.1参照]
6. 用法及び用量
通常、成人にはフィネレノンとして以下の用量を1日1回経口投与する。
eGFRが60mL/min/1.73m2以上
20mg
eGFRが60mL/min/1.73m2未満
10mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量する。
7. 用法及び用量に関連する注意
7.1
投与開始又は再開、増量から4週間後、その後も定期的に血清カリウム値及びeGFRを測定し、表に従って用量を調節すること。[8.1、8.2参照]
| 血清カリウム値(mEq/L) | 用量調節 |
| 4.8以下の場合 | 20mg1日1回の場合:維持 10mg1日1回の場合:20mg1日1回に増量(ただし、eGFRが前回の測定から30%を超えて低下していない場合に限る。) |
| 4.8超5.5以下の場合 | 維持 |
| 5.5超の場合 | 中止 |
投与中止後、血清カリウム値が5.0mEq/L以下に下がった場合には、10mgを1日1回から投与を再開することができる。
7.2 10mg錠と20mg錠の生物学的同等性は示されていないため、20mgを投与する際には10mg錠を使用しないこと。[16.1.3参照]
8. 重要な基本的注意
8.1 高カリウム血症があらわれることがあるので、原則として血清カリウム値が4.8mEq/L以下の患者に投与開始し、投与開始又は再開、増量から4週後に血清カリウム値及びeGFRを測定し、その後も定期的に測定すること。また、投与開始時の血清カリウム値が4.8mEq/L超の患者では、血清カリウム値及び患者の状態に応じて投与開始から4週後よりも前に追加の血清カリウム値測定を考慮すること。[7.1、9.1.1、9.1.2、11.1.1参照]
8.3 降圧作用に基づくめまい等があらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 血清カリウム値が5.0mEq/L超5.5mEq/L以下の患者
9.1.2 高カリウム血症の発現リスクが高い患者
9.2 腎機能障害患者
9.2.1 重度の腎機能障害患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害(Child-Pugh分類C)のある患者
9.3.2 中等度の肝機能障害(Child-Pugh分類B)のある患者
患者の状態に応じて、より頻回に血清カリウム値を測定すること。本剤の血中濃度が上昇するおそれがある。[16.6.2参照]
9.4 生殖能を有する者
妊娠可能な女性に対しては、投与中は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で催奇形性(重複大動脈弓)がヒトの約25倍、胚・胎児毒性(胎児体重の減少)が約19倍、受胎能への影響(卵巣重量の低値)が約17倍の全身曝露量で認められた。また、動物実験(ラット)において、児に妊娠中の曝露によると考えられる軽度の自発運動量増加がヒトの約4倍の母動物への全身曝露量で認められた。
9.6 授乳婦
授乳を避けさせること。動物実験(ラット、静脈内投与)で乳汁中へ移行することが報告されている。また、ラットの母動物においてヒトの約4倍の全身曝露量で、授乳期の児に明らかな有害作用(死亡率の増加)が認められた。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は主としてCYP3A4により代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
10.2 併用注意
| 中程度のCYP3A阻害剤 エリスロマイシン ベラパミル フルコナゾール等 弱いCYP3A阻害剤 アミオダロン フルボキサミン等 [16.7.1-16.7.3参照] | 本剤の血中濃度が上昇するおそれがあるので、特に本剤開始時及び用量調節時は血清カリウム値等患者の状態を慎重に観察すること。 | CYP3Aを阻害することにより本剤のクリアランスが減少する。 |
| 強い又は中程度のCYP3A誘導剤 リファンピシン カルバマゼピン フェニトイン フェノバルビタール エファビレンツ ミトタン セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品等 [16.7.3参照] | 本剤の血中濃度が著しく低下し、効果が減弱するおそれがあるので、CYP3A誘導作用のない又は弱い薬剤への代替を考慮すること。 | CYP3Aを誘導することにより本剤のクリアランスが増加する。 |
| スピロノラクトン トリアムテレン カンレノ酸カリウム エプレレノン エサキセレノン | 血清カリウム値上昇及び高カリウム血症が発現する危険性が増大するおそれがあるので、治療上必要と判断される場合にのみ併用すること。併用する場合には、血清カリウム値をより頻回に測定するなど患者の状態を慎重に観察すること。 | カリウム貯留作用が増強するおそれがある。 |
| カリウム製剤 | 血清カリウム値上昇及び高カリウム血症が発現する危険性が増大するおそれがあるので、血清カリウム値をより頻回に測定するなど十分に注意すること。 | カリウム貯留作用が増強するおそれがある。 |
| スルファメトキサゾール・トリメトプリム | 血清カリウム値上昇及び高カリウム血症が発現する危険性が増大するおそれがあるので、血清カリウム値をより頻回に測定するなど十分に注意すること。あるいは本剤の中断を考慮すること。 | カリウム貯留作用が増強するおそれがある。 |
| グレープフルーツ含有食品 | 本剤の血中濃度が上昇するおそれがあるので、摂取しないよう注意すること。 | CYP3Aを阻害することにより本剤のクリアランスが減少する。 |
| リチウム製剤 炭酸リチウム | リチウム中毒を起こすおそれがあるので、血中リチウム濃度に注意すること。 | 明確な機序は不明であるが、ナトリウムイオン不足はリチウムイオンの貯留を促進するといわれているため、ナトリウム排泄を促進することにより起こると考えられる。 |
| 非ステロイド性消炎鎮痛薬 インドメタシン等 | 腎機能障害患者では高カリウム血症があらわれるおそれがある。 | 明確な機序は不明であるが、プロスタグランジン産生が抑制されることにより糸球体ろ過量が減少し、カリウム貯留作用による血清カリウム値の上昇が起こると考えられる。 |
| ミトタン | ミトタンの作用を阻害するおそれがある。 | 明確な機序は不明であるが、ミトタンの薬効を類薬(スピロノラクトン)が阻害するとの報告がある。 |
11. 副作用
11.1 重大な副作用
11.2 その他の副作用
| 1%以上 | 1%未満 | |
| 代謝および栄養障害 | 低ナトリウム血症、高尿酸血症 | |
| 血管障害 | 低血圧 | |
| 臨床検査 | 糸球体ろ過率減少 |
13. 過量投与
タンパク結合率が約90%のため、血液透析は本剤の除去には有用でないと考えられる。[16.3参照]
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人被験者27例(各投与群9例)にフィネレノン10、20及び40mg注)を単回経口投与したとき、血漿中未変化体濃度は投与0.75〜1.00時間後にCmaxに達した後、2〜3時間の消失半減期で低下した。
| Dose(mg) | AUC(μg・h/L) | Cmax(μg/L) | tmax※(h) | t1/2(h) |
| 10 | 279/35.0 | 123/39.3 | 1.00(0.5-2.5) | 2.06/23.6 |
| 20 | 445/36.8 | 213/30.8 | 0.75(0.5-1.5) | 1.97/21.8 |
| 40 | 1220/34.5 | 483/49.8 | 0.75(0.5-2.0) | 2.64/20.3 |
16.1.2 反復投与
日本人健康成人被験者27例(各投与群9例)にフィネレノン10及び20mgを1日2回、並びに40mg1日1回注)を反復経口投与したとき、初回投与時と比較してフィネレノンの薬物動態特性に大きな変化はなく、血漿中フィネレノンのAUCτ,mdは用量比例的に増加した。最終投与時のAUCτ,mdは初回投与時の1.33〜1.53倍であった。
16.1.3 生物学的同等性試験
日本人健康男性被験者36例を対象にフィネレノン錠10mg2錠、及びフィネレノン錠20mg1錠をそれぞれ絶食下で単回経口投与したときの主要な薬物動態パラメータ、並びにAUC(0-tlast)及びCmaxの幾何平均値の比(10mg×2錠/20mg×1錠)を以下に示す。[7.2参照]
| 製剤 | AUC(0-tlast)(μg・h/L) | Cmax(μg/L) | tmax※(h) | t1/2(h) |
| 10mg×2錠 | 526/27.6 | 279/25.4 | 0.5(0.25-1.5) | 1.90/23.5 |
| 20mg×1錠 | 493/28.5 | 237/37.8 | 0.5(0.5-2) | 1.85/24.0 |
| 比の点推定値(%) (90%信頼区間) | 106.84 (102.55-111.31) | 117.66 (106.26-130.27) | − | − |
16.2 吸収
16.2.1 バイオアベイラビリティ
健康成人被験者15例にフィネレノン5mg注)を空腹時に単回経口投与したときの絶対的バイオアベイラビリティは44%であった(外国人データ)。
16.2.2 食事の影響
健康成人被験者18例にフィネレノン20mgを食後に単回経口投与したとき、空腹時投与時と比較してAUCは21%増加し、Cmaxは19%低下した(外国人データ)。
16.3 分布
健康成人被験者15例にフィネレノン注射剤1mg注)を単回静脈内投与した際の、分布容積は52.6Lであった(外国人データ)。In vitro試験におけるフィネレノンのヒト血漿タンパク結合率は91.7%であり、主に血清アルブミンに結合した。[13.参照]
16.4 代謝
ヒト肝細胞を用いたin vitro試験において、フィネレノンは主にCYP3A4により代謝され、CYP2C8の寄与も認められた。ヒト血漿中における主代謝物は4種類認められ、フィネレノンのジヒドロピリジン部分が酸化されピリジンとなった代謝物M-1a及びM-1b、引き続きメチル基が水酸化された代謝物M-2a、更に酸化を受けたカルボン酸代謝物M-3aであった。いずれの主代謝物も薬理活性は認められなかった。[10.参照]
16.5 排泄
健康成人被験者4例に[14C]フィネレノン経口液剤10mgを単回経口投与したとき、投与後10日までに尿及び糞中にそれぞれ投与放射能の約80%及び約20%が排泄された(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
軽度(クレアチニンクリアランス:60〜89mL/min)の腎機能障害を有する被験者6例にフィネレノン10mgを単回経口投与したとき、フィネレノンのAUC及びCmaxは、腎機能が正常な被験者と比較して大きく変化しなかった(AUC:15%低下、Cmax:22%増加)。
中等度(クレアチニンクリアランス:30〜59mL/min、11例)及び重度(クレアチニンクリアランス:〜29mL/min、9例)の腎機能障害を有する被験者にフィネレノン10mgを単回経口投与したとき、中等度及び重度の腎機能障害を有する被験者のAUCは、腎機能が正常な被験者に比べてそれぞれ51%及び36%増加し、Cmaxはそれぞれ13%増加及び8%低下した(外国人データ)。
中等度(クレアチニンクリアランス:30〜59mL/min、11例)及び重度(クレアチニンクリアランス:〜29mL/min、9例)の腎機能障害を有する被験者にフィネレノン10mgを単回経口投与したとき、中等度及び重度の腎機能障害を有する被験者のAUCは、腎機能が正常な被験者に比べてそれぞれ51%及び36%増加し、Cmaxはそれぞれ13%増加及び8%低下した(外国人データ)。
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 エリスロマイシン
健康成人被験者15例を対象にエリスロマイシン500mgを1日3回4日間反復投与した翌日にフィネレノン1.25mg注)を併用投与したとき、フィネレノンのAUC及びCmaxは、フィネレノン単独投与時と比較してそれぞれ248%及び88%増加した(外国人データ)。[10.2参照]
16.7.2 ベラパミル
健康成人被験者13例を対象にベラパミル120mgを1日目に1回投与した後、2日目、3日目及び4日目にベラパミル240mgを1日1回3日間反復投与し、4日目のベラパミル投与(最終投与)の6時間後にフィネレノン5mg注)を単回経口投与したとき、フィネレノンのAUC及びCmaxは、フィネレノン単独投与時と比較してそれぞれ170%及び122%増加した(外国人データ)。[10.2参照]
16.7.3 母集団薬物動態解析又は生理学的薬物速度論モデルによるシミュレーション
生理学的薬物速度論モデルによるシミュレーションにおいて、フィネレノンと強いCYP3A阻害剤のイトラコナゾール及びクラリスロマイシンを併用投与したとき、フィネレノンのAUCはそれぞれ531%及び428%増加、Cmaxはそれぞれ137%及び125%増加することが推定された。母集団薬物動態解析の結果、フィネレノンと弱いCYP3A阻害剤のアミオダロンを併用投与したとき、フィネレノンのAUCは21%増加することが推定された。生理学的薬物速度論モデルによるシミュレーションにおいて、フィネレノンと強いCYP3A誘導剤のリファンピシン及び中等度のCYP3A誘導剤のエファビレンツを併用投与したとき、フィネレノンのAUCはそれぞれ93%及び81%低下、Cmaxはそれぞれ86%及び68%低下することが推定された。[2.2、10.1、10.2参照]
16.7.4 その他の薬剤
(1)ゲムフィブロジル
健康成人被験者16例を対象にゲムフィブロジル600mgを1日2回4日間反復投与した翌日にゲムフィブロジル600mgを投与し、その1時間後にフィネレノン10mgを投与したとき、フィネレノンのAUC及びCmaxは、フィネレノン単独投与時と比較してそれぞれ10%及び16%増加した(外国人データ)。
(2)オメプラゾール及び制酸薬(マーロックス)
オメプラゾール
健康成人被験者11例を対象にオメプラゾール40mgを1日1回4日間反復投与した翌日にオメプラゾール40mgを投与し、その2時間後にフィネレノン10mgを投与したとき、フィネレノンのAUC及びCmaxに影響はみられなかった(AUC:5%増加、Cmax:1%低下)(外国人データ)。
マーロックス
健康成人被験者10例を対象に酸化Al・水酸化Mg配合懸濁液70mVal懸濁液10mLを単回投与し、その直後にフィネレノン10mgを投与したとき、フィネレノンのAUC及びCmaxは、フィネレノン単独投与時と比較してそれぞれ2%増加及び19%減少した(外国人データ)。
(3)ミダゾラム
健康成人被験者30例を対象にフィネレノン20mgを1日1回9日間反復投与した翌日にミダゾラム7.5mgを併用投与したとき、ミダゾラムのAUC及びCmaxは、ミダゾラム単独投与時と比較してそれぞれ11%及び9%増加した(外国人データ)。
(4)レパグリニド
健康成人被験者28例を対象にフィネレノン20mgとレパグリニド0.5mgを同時投与、及びフィネレノン20mg投与後3時間後にレパグリニド0.5mgを投与したとき、同時投与したときのレパグリニドのAUC及びCmaxはレパグリニド単独投与時と比較してそれぞれ12%及び4%増加し、3時間後に投与したときのレパグリニドのAUC及びCmaxはそれぞれ10%及び5%増加した(外国人データ)。
(5)ワルファリン
健康成人被験者24例を対象にフィネレノン20mgを1日1回6日間反復投与し、その3日目にワルファリン25mgを併用投与したとき、ワルファリン単独投与時と比較して、S-ワルファリン及びR-ワルファリンのAUC及びCmaxは変化しなかった(外国人データ)。
(6)ジゴキシン
健康成人被験者24例を対象にジゴキシン0.375mgを1日1回14日間反復経口投与し、第5日〜第14日にフィネレノン20mgを併用にて1日1回反復経口投与したとき、ジゴキシン単独投与時と比較して、ジゴキシンの14日目のAUC及びCmaxは変化しなかった(外国人データ)。
注)承認された用法及び用量は、eGFRが60mL/min/1.73m2以上は20mg1日1回経口投与、eGFRが60mL/min/1.73m2未満は10mg1日1回経口投与から開始し血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第III相試験(試験16244、FIDELIO-DKD)
糖尿病性腎臓病と診断された患者※1[[1]尿中アルブミン/クレアチニン比(UACR)30mg/g以上300mg/g未満、推定糸球体ろ過量(eGFR)25mL/min/1.73m2以上60mL/min/1.73m2未満、かつ糖尿病性網膜症の病歴を有する、又は[2]UACR300mg/g以上5000mg/g以下、かつeGFR25mL/min/1.73m2以上75mL/min/1.73m2未満]5674例(日本人415例を含む)※2を対象に、アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬を含む標準治療※3に上乗せした本剤(10mg1日1回又は20mg1日1回、増量又は減量可)の有効性及び安全性を検討する多施設共同、無作為化、プラセボ対照、二重盲検、並行群間、イベント主導型試験を実施した。
※1:非糖尿病性の腎臓病(IgA腎症、多発性嚢胞腎等)患者は本試験の対象から除外した。
※2:高血圧症合併例は5505例(97.0%)(日本人414例(99.8%))組み入れられた。
※3:アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬が最大忍容量で投与されている患者を組み入れた。
治験薬の投与期間(中央値)は本剤群27.039ヵ月、プラセボ群27.203ヵ月であった。主要評価項目とした腎複合エンドポイント及びその構成要素の最初の発現、主な副次評価項目とした心血管複合エンドポイントの最初の発現は、下表のとおりであった。本剤群では、プラセボ群と比較して主要評価項目である腎複合エンドポイント発現リスクが有意に低かった(p=0.0014、層別ログランク検定)。
| エンドポイント | 本剤 (N=2833) n(/100患者年) | プラセボ (N=2841) n(/100患者年) | ハザード比※3 (95%信頼区間) | |
| 全体集団 | 主要評価項目 (腎複合エンドポイント)※1 | 504 (7.59) | 600 (9.08) | 0.825 (0.732〜0.928) |
| 腎不全の発症 | 208 (2.99) | 235 (3.39) | 0.869 (0.721〜1.048) | |
| 4週間以上持続するベースライン時点から40%以上の持続的なeGFR低下 | 479 (7.21) | 577 (8.73) | 0.815 (0.722〜0.920) | |
| 腎臓死 | 2 | 2 | − | |
| 主な副次評価項目 (心血管複合エンドポイント)※2 | 367 (5.11) | 420 (5.92) | 0.860 (0.747〜0.989) |
日本人部分集団においては、治験薬の投与期間(中央値)は本剤群35.565ヵ月、プラセボ群35.713ヵ月であった。主要評価項目とした腎複合エンドポイント及びその構成要素の最初の発現、主な副次評価項目とした心血管複合エンドポイントの最初の発現は、下表のとおりであった。
| エンドポイント | 本剤 (N=208) n(/100患者年) | プラセボ (N=207) n(/100患者年) | ハザード比※3 (95%信頼区間) | |
| 日本人部分集団 | 主要評価項目 (腎複合エンドポイント)※1 | 42 (7.39) | 44 (7.87) | 0.911 (0.596〜1.392) |
| 腎不全の発症 | 21 (3.54) | 15 (2.56) | 1.349 (0.695〜2.617) | |
| 4週間以上持続するベースライン時点から40%以上の持続的なeGFR低下 | 42 (7.39) | 43 (7.69) | 0.933 (0.609〜1.429) | |
| 腎臓死 | 0 | 0 | − | |
| 主な副次評価項目 (心血管複合エンドポイント)※2 | 15 (2.40) | 13 (2.13) | 1.116 (0.531〜2.347) |
副作用(臨床検査値異常を含む)は本剤群で2827例中646例(22.9%)に認められた。主な副作用は高カリウム血症333例(11.8%)、血中クレアチニン増加44例(1.6%)、低血圧42例(1.5%)、糸球体ろ過率減少39例(1.4%)であった。
17.1.2 国際共同第III相試験(試験17530、FIGARO-DKD)
糖尿病性腎臓病と診断された患者※1[[1]尿中アルブミン/クレアチニン比(UACR)30mg/g以上300mg/g未満、かつ推定糸球体ろ過量(eGFR)25mL/min/1.73m2以上90mL/min/1.73m2以下、又は[2]UACR300mg/g以上5000mg/g以下、かつeGFR60mL/min/1.73m2以上]7352例(日本人503例を含む)※2を対象に、アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬を含む標準治療※3に上乗せした本剤(10mg1日1回又は20mg1日1回、増量又は減量可)の有効性及び安全性を検討する多施設共同、無作為化、プラセボ対照、二重盲検、並行群間、イベント主導型試験を実施した。
※1:非糖尿病性の腎臓病(IgA腎症、多発性嚢胞腎等)患者は本試験の対象から除外した。
※2:高血圧症合併例は7061例(96.0%)(日本人496例(98.6%))組み入れられた。
※3:アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬が最大忍容量で投与されている患者を組み入れた。
治験薬の投与期間(中央値)は本剤群35.877ヵ月、プラセボ群35.893ヵ月であった。主要評価項目とした心血管複合エンドポイント及びその構成要素の最初の発現、主な副次評価項目とした腎複合エンドポイントの最初の発現は、下表のとおりであった。本剤群では、プラセボ群と比較して主要評価項目である心血管複合エンドポイント発現リスクが有意に低かった(p=0.0264、層別ログランク検定)。
| エンドポイント | 本剤 (N=3686) n(/100患者年) | プラセボ (N=3666) n(/100患者年) | ハザード比※3 (95%信頼区間) | |
| 全体集団 | 主要評価項目 (心血管複合エンドポイント)※1 | 458 (3.87) | 519 (4.45) | 0.87 (0.76〜0.98) |
| 心血管死 | 194 (1.56) | 214 (1.74) | 0.90 (0.74〜1.09) | |
| 非致死的心筋梗塞 | 103 (0.85) | 102 (0.85) | 0.99 (0.76〜1.31) | |
| 非致死的脳卒中 | 108 (0.89) | 111 (0.92) | 0.97 (0.74〜1.26) | |
| 心不全による入院 | 117 (0.96) | 163 (1.36) | 0.71 (0.56〜0.90) | |
| 主な副次評価項目 (腎複合エンドポイント)※2 | 350 (3.15) | 395 (3.58) | 0.87 (0.76〜1.01) |
日本人部分集団においては、治験薬の投与期間(中央値)は本剤群47.474ヵ月、プラセボ群46.784ヵ月であった。主要評価項目とした心血管複合エンドポイント及びその構成要素の最初の発現、主な副次評価項目とした腎複合エンドポイントの最初の発現は、下表のとおりであった。
| エンドポイント | 本剤 (N=250) n(/100患者年) | プラセボ (N=253) n(/100患者年) | ハザード比※3 (95%信頼区間) | |
| 日本人部分集団 | 主要評価項目 (心血管複合エンドポイント)※1 | 12 (1.26) | 18 (1.90) | 0.65 (0.31〜1.36) |
| 心血管死 | 2 (0.21) | 3 (0.31) | 0.64 (0.11〜3.83) | |
| 非致死的心筋梗塞 | 3 (0.31) | 2 (0.21) | 1.59 (0.26〜9.52) | |
| 非致死的脳卒中 | 5 (0.52) | 10 (1.04) | 0.48 (0.17〜1.42) | |
| 心不全による入院 | 2 (0.21) | 4 (0.41) | 0.48 (0.09〜2.64) | |
| 主な副次評価項目 (腎複合エンドポイント)※2 | 22 (2.43) | 19 (2.09) | 1.16 (0.63〜2.14) |
副作用(臨床検査値異常を含む)は本剤群で3683例中560例(15.2%)に認められた。主な副作用は高カリウム血症240例(6.5%)、低血圧50例(1.4%)、糸球体ろ過率減少28例(0.8%)、下痢26例(0.7%)、血中クレアチニン増加25例(0.7%)であった。
17.3 その他
17.3.1 QT間隔に対する影響
健康成人被験者57例を対象に本剤20mg及び80mg注)を単回投与したとき、QTc間隔の延長は示されなかった(外国人データ)。
注)承認された用法及び用量は、eGFRが60mL/min/1.73m2以上は20mg1日1回経口投与、eGFRが60mL/min/1.73m2未満は10mg1日1回経口投与から開始し血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量である。
18. 薬効薬理
18.1 作用機序
フィネレノンは非ステロイド型選択的ミネラルコルチコイド受容体(MR)拮抗薬であり、アンドロゲン、プロゲステロン、エストロゲン及びグルココルチコイドの各受容体には結合しない。アルドステロンによる細胞内MRの活性化により電解質の貯留・排泄が調節されているが、MRが過剰活性化すると、腎臓や心血管系において、炎症、線維化、ナトリウム貯留や臓器肥大が生じる。フィネレノンはMRに結合することで、MRの過剰活性化を抑制する。
18.2 心腎保護作用
虚血・再灌流誘発慢性腎臓病モデルラットにおいて、フィネレノンは腎機能障害を軽減し、線維化を抑制した。また、デスオキシコルチコステロン酢酸エステル(DOCA-salt)誘発高血圧症モデルラットにおいて、フィネレノンは心肥大及び線維化を抑制し、腎肥大及びタンパク尿の発現を抑制した。
19. 有効成分に関する理化学的知見
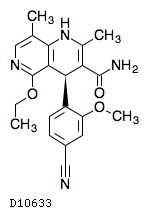
19.1. フィネレノン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ケレンディア錠10mg>
100錠[10錠(PTP)×10]
<ケレンディア錠20mg>
100錠[10錠(PTP)×10]
24. 文献請求先及び問い合わせ先
文献請求先
バイエル薬品株式会社
メディカルインフォメーション
〒530-0001
大阪市北区梅田二丁目4番9号
文献請求先
製品情報問い合わせ先
バイエル薬品株式会社
電話:0120-106-398
バイエル医療用医薬品のお問い合わせ先
26. 製造販売業者等
26.1 製造販売元
バイエル薬品株式会社
大阪市北区梅田二丁目4番9号