医薬品情報
| 総称名 | カログラ |
|---|---|
| 一般名 | カロテグラストメチル |
| 欧文一般名 | Carotegrast Methyl |
| 製剤名 | カロテグラストメチル錠 |
| 薬効分類名 | 潰瘍性大腸炎治療剤 α4インテグリン阻害剤 |
| 薬効分類番号 | 2399 |
| KEGG DRUG |
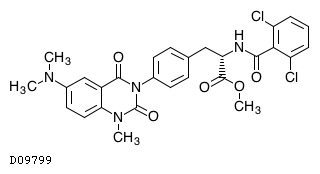
D09799
カロテグラストメチル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カログラ錠120mg | CAROGRA Tablets | EAファーマ | 2399018F1024 | 199.7円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
中等症の潰瘍性大腸炎(5-アミノサリチル酸製剤による治療で効果不十分な場合に限る)
5. 効能または効果に関連する注意
5.1 過去の治療において、5-アミノサリチル酸製剤による適切な治療を行っても、疾患に起因する明らかな臨床症状が残る場合に投与すること。
6. 用法及び用量
通常、成人にはカロテグラストメチルとして1回960mgを1日3回食後経口投与する。
7. 用法及び用量に関連する注意
7.1 8週間投与しても臨床症状や内視鏡所見等による改善効果が得られない場合、本剤の継続の可否も含め、治療法を再考すること。
8. 重要な基本的注意
8.1 本剤はα4インテグリンに結合しリンパ球の遊走を阻害するため、感染症に対する免疫能に影響を及ぼす可能性がある。本剤の投与に際しては十分な観察を行い、感染症の発現や増悪に注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者(Child-Pugh分類C)
投与しないこと。中等度の肝機能障害患者に投与した場合にカロテグラストメチル及び活性代謝物であるカロテグラストの血中濃度の上昇が認められている。重度の肝機能障害患者を対象とした臨床試験は実施していない。[2.3参照]
9.3.2 中等度の肝機能障害患者(Child-Pugh分類B)又は胆道閉塞のある患者
減量を考慮するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。胆道閉塞のある患者を含む中等度の肝機能障害患者に投与した場合にカロテグラストメチル及び活性代謝物であるカロテグラストの血中濃度の上昇が認められている。[16.6.1参照]
9.4 生殖能を有する者
妊娠可能な女性には、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で本剤の乳汁中への移行が認められている2)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
相互作用序文
カロテグラストメチルはCYP3A4阻害作用を有する。また、本剤の活性代謝物であるカロテグラストはOATP1B1及びOATP1B3の基質である。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
OATP1B1
薬物代謝酵素用語
OATP1B3
10.2 併用注意
| CYP3A4の基質となる薬剤 ミダゾラム アトルバスタチン等 [16.7.1、16.7.2参照] | これらの薬剤の作用が増強される可能性がある。 | カロテグラストメチルのCYP3A4阻害作用により、これらの薬剤の血中濃度が上昇する可能性がある。 |
| OATP1B1及びOATP1B3を阻害する薬剤 リファンピシン等 [16.7.4参照] | 本剤の活性代謝物であるカロテグラストの作用が増強される可能性がある。本剤の減量を考慮するとともに、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | これらの薬剤の肝取り込みトランスポーター(OATP1B1及びOATP1B3)阻害作用により、カロテグラストの血中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 進行性多巣性白質脳症(PML)(頻度不明)
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | |
| 過敏症 | 薬物過敏症 | |
| 肝臓 | 肝機能異常、AST増加、LDH増加 | ALT増加、γ-GTP増加 |
| 精神神経系 | 頭痛 | 感覚鈍麻 |
| 消化器 | 悪心、腹部不快感 | 嘔吐、口内炎、胃食道逆流性疾患、胃腸炎、消化不良、腹部膨満、腹痛 |
| 血液・免疫系 | 白血球数増加 | |
| 筋・骨格系 | 関節痛 | |
| 皮膚 | 発疹、蕁麻疹 | |
| 泌尿器 | 尿中蛋白陽性 | |
| その他 | 上咽頭炎、上気道の炎症、発熱、CRP増加 | 鼻出血、アミラーゼ増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人男性(18例)に本剤240、480、960mg注)を単回経口投与したとき、カロテグラストメチル及び活性代謝物であるカロテグラストの血中濃度はそれぞれ投与1.8〜2.3時間及び2.7〜3.2時間後に最高血中薬物濃度(Cmax)に到達し、消失半減期はそれぞれ8.4〜15.8時間及び11.5〜15.9時間であった3)。
健康成人男性における食後単回投与時の血漿中濃度推移(平均値±標準偏差)
| カロテグラストメチル | カロテグラスト | |||||
| 240mg n=6 | 480mg n=5※ | 960mg n=6 | 240mg n=6 | 480mg n=5※ | 960mg n=6 | |
| AUC0-∞(ng・h/mL) | 458※※ | 684±70※※※ | 1602±341 | 2990±721 | 5542±327 | 8998±2849 |
| Cmax(ng/mL) | 168±88 | 241±101 | 541±154 | 653±224 | 1140±189 | 2012±934 |
| Tmax(h) | 1.8±1.3 | 2.3±1.6 | 1.8±1.2 | 2.8±1.3 | 3.2±1.1 | 2.7±1.0 |
| t1/2(terminal)(h) | 8.4※※ | 13.0±17.5※※※ | 15.8±11.2 | 11.5±1.0 | 15.9±9.6 | 15.6±8.0 |
16.1.2 反復投与
日本人健康成人男性(18例)に本剤240、480、960mg注)を1日3回6日間反復経口投与したとき、カロテグラストメチル及びカロテグラストの薬物動態パラメータは下表のとおりであった4)。
| カロテグラストメチル | 1日目 | 最終投与日(反復投与6日目) | ||||
| 240mg n=6 | 480mg n=5※ | 960mg n=6 | 240mg n=6 | 480mg n=5※ | 960mg n=6 | |
| AUC0-24(ng・h/mL) | 755±311 | 1667±560 | 3134±1307 | 1187±176 | 2408±618 | 3121±788 |
| Cmax(ng/mL) | 122±73 | 292±257 | 527±551 | 195±40 | 278±88 | 501±270 |
| Tmax(h) | 10.2±3.8 | 11.4±2.0 | 6.5±3.2 | 10.0±1.1 | 7.7±3.0 | 9.3±3.6 |
| t1/2(terminal)(h) | 1.4±0.1※※ | 6.0±6.6 | 4.0±5.9 | 1.4±0.1※※※ | 24.8±46.1 | 5.6±8.2 |
| カロテグラスト | 1日目 | 最終投与日(反復投与6日目) | ||||
| 240mg n=6 | 480mg n=5※ | 960mg n=6 | 240mg n=6 | 480mg n=5※ | 960mg n=6 | |
| AUC0-24(ng・h/mL) | 4710±1592 | 11313±3603 | 18978±7684 | 7660±1916 | 17457±3477 | 19790±5601 |
| Cmax(ng/mL) | 466±200 | 1251±613 | 1989±1105 | 824±130 | 1732±354 | 2247±1019 |
| Tmax(h) | 9.3±3.5 | 10.0±2.6 | 9.6±3.1 | 8.2±2.8 | 9.4±0.6 | 10.0±0.6 |
| t1/2(terminal)(h) | 6.5±3.1 | 8.9±4.1 | 9.6±4.1 | 18.3±12.4 | 26.9±24.0 | 14.1±7.9 |
16.2 吸収
16.2.1 食事の影響
日本人健康成人男性(6例)に本剤960mgを単回経口投与したとき、カロテグラストメチルのCmax及びAUC0-∞は食事によりそれぞれ33.8%、20.9%低下し、カロテグラストのCmax及びAUC0-∞は食事によりそれぞれ18.5%、2.4%低下した3)。
16.3 分布
カロテグラストメチル及びカロテグラストの血漿蛋白結合率は、それぞれ99.2%〜99.3%及び99.6%〜99.7%であった(in vitro)。カロテグラストメチルの主な結合蛋白はアルブミン及びα1-酸性糖蛋白質であり、カロテグラストの主な結合蛋白はアルブミンであった(in vitro)。14C標識した本剤をラット及びイヌに単回経口投与したときの放射能の血球への移行性は低く、血球移行率は12.8%以下であった。14C標識した本剤をラットに単回経口投与後、大部分の組織中放射能濃度は投与1時間後に最高濃度を示し、血漿中放射能濃度の低下とともに速やかに低下した5)。
16.4 代謝
本剤は主にカルボキシルエステラーゼ1(CES1)及びCYP3A4による一次代謝によりカロテグラスト及びN-脱メチル体へと代謝され、さらにN-脱メチル体はエステル加水分解体へと代謝される(in vitro)。カロテグラストの一部はUGT1A3によりグルクロン酸抱合体へと代謝される(in vitro)6)。
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
軽度(Child-Pugh分類A)の肝機能障害被験者(6例)及び胆道閉塞のある被験者(1例)を含む中等度(Child-Pugh分類B)の肝機能障害被験者(2例)に本剤960mgを単回経口投与した。軽度肝機能障害被験者では肝機能正常被験者と比較して、カロテグラストメチルの曝露量(Cmax及びAUC0-∞)はそれぞれ0.7倍及び0.8倍であり、カロテグラストのCmax及びAUC0-∞はそれぞれ1.1倍及び1.5倍であった。中等度肝機能障害被験者では、肝機能正常被験者と比較してカロテグラストメチルのCmax及びAUC0-∞はそれぞれ2.5倍及び3.1倍であり、カロテグラストのCmax及びAUC0-∞はそれぞれ2.1倍及び4.3倍であった9)。[9.3.2参照]
| カロテグラストメチル | カロテグラスト | |||||
| 正常 n=6 | 軽度 n=6 | 中等度 n=2 | 正常 n=6 | 軽度 n=6 | 中等度 n=2 | |
| AUC0-∞(ng・h/mL) [95%信頼区間] | 1750 [1100,2780] | 1480 [666,3300] | 5460 [NC] | 7360 [5420,10000] | 10900 [6030,19700] | 31300 [NC] |
| Cmax(ng/mL) [95%信頼区間] | 743 [472,1170] | 506 [220,1160] | 1840 [NC] | 1830 [1210,2760] | 1990 [1230,3220] | 3840 [NC] |
| Tmax(h) [範囲] | 1.50 [1.00-2.00] | 1.00 [0.50-2.00] | 0.75 [0.50-1.00] | 2.00 [1.00-2.00] | 2.00 [2.00-4.00] | 3.00 [2.00-4.00] |
| t1/2(terminal)(h) [95%信頼区間] | 12.9 [2.57,65.0] | 9.71 [4.21,22.4] | 4.64 [NC] | 10.8 [8.16,14.3] | 12.5 [5.71,27.5] | 11.4 [NC] |
16.7 薬物相互作用
16.7.1 ミダゾラム
16.7.2 アトルバスタチン
16.7.3 プレドニゾロン
日本人健康成人男性(20例)に本剤960mgを1日3回14日間反復経口投与後、プレドニゾロン5mgを併用投与したとき、プレドニゾロンのCmax及びAUC0-tはそれぞれ0.9倍及び1.1倍であった10)。
16.7.4 リファンピシン
注)本剤の用法及び用量は、カロテグラストメチルとして960mg1日3回投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(検証試験)
5-アミノサリチル酸に対して効果不十分又は不耐の中等症の活動期にある日本人潰瘍性大腸炎患者(203例)を対象として実施された比較試験において、本剤960mg又はプラセボを1日3回食後経口投与した。主要評価項目である8週時の改善率について、プラセボに対する本剤の優越性が検証された(p=0.0003)。8週までの副作用の発現頻度は、プラセボ群で13.9%(14/101例)、本剤群で16.7%(17/102例)であった。本剤群の主な副作用は、上咽頭炎2.0%(2/102例)、悪心2.0%(2/102例)、肝機能異常2.0%(2/102例)であった12)。
| プラセボ群(101例) | 960mg群(102例) | |
| 改善率a)%(例数) | 20.8(21) | 45.1(46) |
| プラセボ群に対するオッズ比 [両側95%信頼区間]b) | 3.30 [1.73,6.29] | |
| p値b),c) | 0.0003 | |
8週間の投与により粘膜治癒(内視鏡所見が正常)に至らなかった被験者には最大24週間まで継続投与し、血便の消失又は粘膜治癒に至った時点で投与を終了した。24週時の累積改善率は、プラセボ群22.8%(23/101例)、本剤群49.0%(50/102例)であった。継続投与例における8週以降24週までの副作用の発現頻度は、プラセボ群で12.0%(6/50例)、本剤群で5.8%(3/52例)であった。本剤群の副作用は、胃腸炎1.9%(1/52例)、上咽頭炎1.9%(1/52例)、頭痛1.9%(1/52例)、鼻出血1.9%(1/52例)であった。本剤群の継続投与例(52例)における投与期間(平均値±標準偏差[最小値、最大値]、以下同様)は87.9±19.2[70,175]日であった。
なお、治験薬投与終了後に疾患が再燃した被験者には、8週間以上の間隔をおいて再治療を行うことが可能とされた。本剤による1回目の再治療を受けた37例、2回目の再治療を受けた9例における投与期間は、それぞれ72.0±40.9[3,175]日及び78.1±39.2[34,162]日であった。[5.2参照]
なお、治験薬投与終了後に疾患が再燃した被験者には、8週間以上の間隔をおいて再治療を行うことが可能とされた。本剤による1回目の再治療を受けた37例、2回目の再治療を受けた9例における投与期間は、それぞれ72.0±40.9[3,175]日及び78.1±39.2[34,162]日であった。[5.2参照]
18. 薬効薬理
18.1 作用機序
カロテグラストメチルは生体内で活性代謝物であるカロテグラストとなり、α4β1インテグリンとVascular cell adhesion molecule-1(VCAM-1)との結合及びα4β7インテグリンとMucosal addressin cell adhesion molecule-1(MAdCAM-1)との結合を阻害することによって、T細胞を含む炎症性細胞の血管内皮細胞への接着及び炎症部位への浸潤を阻害し、抗炎症作用を発揮する。
18.2 α4インテグリンと接着分子との結合に対する阻害作用
カロテグラストは、ヒト、ラット及びマウスのα4β1インテグリン発現細胞とVCAM-1との結合及びヒト、ラット及びマウスα4β7インテグリン発現細胞とMAdCAM-1との結合を阻害した13)。
18.3 ラット及びマウスにおけるリンパ球のホーミングに対する作用
カロテグラストメチルは、ラット及びマウス小腸パイエル板へのリンパ球(腸間膜リンパ節細胞)のホーミングを阻害した14)。
18.4 実験的腸炎に対する作用
インターロイキン-10ノックアウトCD4+ T細胞移入マウス腸炎モデルにおいて、カロテグラストメチルは腸管重量増加、便性状スコア及び腸管組織へのT細胞浸潤を有意に抑制した15)。
19. 有効成分に関する理化学的知見
19.1. カロテグラストメチル
20. 取扱い上の注意
本剤は吸湿性が強いので、アルミピロー包装開封後は湿気を避けて保存し、服用直前までPTPシートから取り出さないこと。また、保存に際してPTPシートを破損しないよう注意すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
336錠[8錠(PTP)×21シート×2ピロー]
23. 主要文献
- 社内資料:毒性試験「生殖発生毒性試験」(2022年3月28日承認、申請資料概要2.6.6.6)
- 社内資料:乳汁への移行(2022年3月28日承認、申請資料概要2.6.4.6.5)
- 社内資料:第I相試験結果(2022年3月28日承認、申請資料概要2.7.6.3)
- 社内資料:第I相試験結果(2022年3月28日承認、申請資料概要2.7.6.4)
- 社内資料:分布(2022年3月28日承認、申請資料概要2.6.4.4)
- 社内資料:代謝(2022年3月28日承認、申請資料概要2.6.4.5)
- 社内資料:臨床薬理試験結果(2022年3月28日承認、申請資料概要2.7.6.5)
- 社内資料:単回投与後の胆汁中排泄(2022年3月28日承認、申請資料概要2.6.4.6.3)
- 社内資料:第I相試験結果(2022年3月28日承認、申請資料概要2.7.6.7)
- 社内資料:薬物相互作用試験(1)結果(2022年3月28日承認、申請資料概要2.7.6.8)
- 社内資料:薬物相互作用試験(2)結果(2022年3月28日承認、申請資料概要2.7.6.9)
- 社内資料:第III相試験結果(2022年3月28日承認、申請資料概要2.7.6.14)
- 社内資料:α4インテグリンと接着分子との結合に対する阻害作用(2022年3月28日承認、申請資料概要2.6.2.2.2)
- 社内資料:α4インテグリンの生物活性に対する作用(2022年3月28日承認、申請資料概要2.6.2.2.3)
- Sugiura T,et al., J Crohns Colitis., 7 (11), e533-42, (2013), (2013 Dec) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
キッセイ薬品工業株式会社
くすり相談センター
〒112-0002
東京都文京区小石川3丁目1番3号
電話:フリーダイヤル:0120-007-622
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:フリーダイヤル:0120-917-719
製品情報問い合わせ先
キッセイ薬品工業株式会社
くすり相談センター
〒112-0002
東京都文京区小石川3丁目1番3号
電話:フリーダイヤル:0120-007-622
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:フリーダイヤル:0120-917-719
26. 製造販売業者等
26.1 製造販売元
EAファーマ株式会社
東京都中央区入船二丁目1番1号
26.2 販売元
キッセイ薬品工業株式会社
松本市芳野19番48号