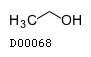医薬品情報
| 総称名 | 無水エタノール |
|---|---|
| 一般名 | 無水エタノール |
| 欧文一般名 | Anhydrous Ethanol |
| 製剤名 | 無水エタノール注射液 |
| 薬効分類名 | 経皮的エタノール注入療法用剤 |
| 薬効分類番号 | 4291 |
| KEGG DRUG |
D00068
無水エタノール
|
| KEGG DGROUP |
DG00430
エタノール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| 無水エタノール注「VTRS」 | Anhydrous Ethanol Injection | ヴィアトリス・ヘルスケア | 4291411A1066 | 処方箋医薬品注) |
1. 警告
経皮的エタノール注入療法は、緊急時に十分処置できる医療施設及び経皮的エタノール注入療法に十分な経験を持つ医師のもとで、本療法が適切と判断される症例についてのみ実施すること。
2. 禁忌
次の患者には投与しないこと
エタノールに対し過敏症の既往歴のある患者
4. 効能または効果
肝細胞癌における経皮的エタノール注入療法
6. 用法及び用量
腫瘍病変毎に対して、総注入量は腫瘍体積により決定する。患者当たり1日注入量は最大10mL以内を原則とする。総注入量が1日最大注入量を超える場合、数日に分けて治療を行うが、通常、週2回の注入手技を限度とする。
7. 用法及び用量に関連する注意
7.1 1日注入量が10mLを超える場合の安全性は確立されていないので、それ以上の注入量が必要な際は、慎重に注入すること。
7.2 総注入量は、4/3π(r+0.5)3mL(r+0.5:腫瘍の最大径の半分+安全域cm)の計算式を目安として求めること。
8. 重要な基本的注意
8.1 腫瘍の全体像が超音波で描出できない場合又は安全な穿刺ルートを確保できない場合には経皮的エタノール注入療法を施行しないこと。
8.2 経皮的エタノール注入療法単独による治療は、最大腫瘍径3cm以内の病変を原則とし、3cmを超える病変に対して治療を行う場合には、他の治療法との併用を考慮するなど、慎重に実施すること。
8.3 腫瘍細胞が一部残存するおそれがあるので、CT等で確認すること。
8.4 経皮的エタノール注入療法に伴う以下の合併症が報告されているため、十分注意を払い実施すること。観察を十分に行い、症状が現れた場合は適切に処置すること。
8.4.1 重篤な合併症
・肝癌破裂
肝表面から突出している腫瘍に対するエタノールの注入により、肝癌破裂が起こる可能性があるので、注入方法、適応に関して十分に考慮し、異常が認められた場合には適切に処置すること。
・肝梗塞
・肝不全
8.4.2 その他の合併症
| 症状 | |
| 肝臓 | 肝内胆汁性のう胞、肝被膜下血腫、門脈内の血栓、肝静脈閉塞、閉塞性黄疸、肝外A-Vシャント形成、肝膿瘍 |
| 胆のう、胆管 | 胆管気管支瘻、胆管損傷、胆のう炎、胆管内出血、胆道出血 |
| 呼吸器 | 気胸、胸水発現、血胸、胸腔内出血、呼吸困難 |
| 精神神経系 | 迷走神経反射 |
| その他 | 炎症波及、穿刺部疼痛、腹腔内播種、腹膜炎、腹壁播種、リンパ節転移、転移(穿刺ルート)、心窩部痛、右季肋部痛、右肩痛、腹水発現、皮下出血、腹腔内出血 |
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な出血傾向を有する患者
重篤な出血を起こす可能性がある。
9.1.2 アルコール代謝能の低い患者
全身状態の変化に十分注意すること。
9.3 肝機能障害患者
9.3.1 総ビリルビン値が3mg/dL以上の患者又は管理困難な腹水を有する等、重篤な肝障害を有する患者
肝不全を起こす可能性がある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。
9.6 授乳婦
授乳を避けさせること。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと1)2)3)4)5)6)7)8)9)10)11)12)13)14)15)16)17)18)。
11.1.1 ショック(頻度不明)
11.1.2 心筋梗塞(頻度不明)
11.2 その他の副作用
| 1%以上注) | 頻度不明 | |
| 循環器 | 血圧上昇、血圧低下 | |
| 肝臓 | AST上昇、ALT上昇、LDH上昇、Al-P上昇、総ビリルビン上昇、ChE低下 | γ-GTP上昇、直接ビリルビン上昇、ウロビリノーゲン陽性、HPT値減少、ICGR15増加 |
| 呼吸器 | 咳嗽 | |
| 血液 | 白血球増加、赤血球減少、血小板減少 | 白血球減少、ヘマトクリット低下、血液凝固第VIII因子低下 |
| 消化器 | 嘔気、食欲不振、嘔吐 | 下痢、出血性十二指腸潰瘍 |
| 代謝 | アルブミン低下、血清総蛋白低下 | 尿酸上昇、血糖上昇、血糖低下、尿蛋白陽性、尿糖陽性、血清総蛋白上昇、総コレステロール低下 |
| 皮膚 | 発疹、そう痒感 | |
| その他 | 腹部疼痛、発熱、CRP上昇、倦怠感、酩酊感 | 灼熱感 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 経皮的エタノール注入療法(腫瘍内注入)のみに使用し、その他の投与経路(血管内、脊髄腔内、皮下、筋肉内等)での投与を行わないこと。
14.1.2 本剤に局所麻酔剤を加えて使用する場合、腫瘍壊死効果が確認されているエタノール濃度(90%以上)で使用すること。
14.1.3 無水エタノールは外用には刺激が強く、殺菌力が劣ることが知られているので外用には使用しないこと。
14.1.4 眼に入らないよう注意すること。眼に入った場合は直ちによく水洗すること。
14.1.5 エタノール蒸気に大量に又は繰り返しさらされた場合、粘膜への刺激、頭痛等を起こすことがあるので、蒸気の吸入に注意すること。
14.1.6 本剤は引火性、爆発性があるため、火気(電気メス使用等を含む)には十分に注意すること。
17. 臨床成績
17.2 製造販売後調査等
17.2.1 使用成績調査
肝細胞癌患者のうち、経皮的エタノール注入療法を施行する患者を対象とした使用成績調査(調査期間:2006年1月1日〜2010年10月21日)の結果、有効率(肝癌治療直接効果判定基準(2004年改訂版)に準拠した総合評価)は64.5%であった。副作用発現頻度は69.7%(69/99例)であり、主な副作用はAST上昇47例(47.5%)、ALT上昇44例(44.4%)、LDH上昇23例(23.2%)、腹部疼痛29例(29.3%)、発熱24例(24.2%)であった。
18. 薬効薬理
18.1 作用機序
本剤は投与部位における組織水分を奪ってタンパク質凝固をきたす19)。
19. 有効成分に関する理化学的知見
19.1. 無水エタノール
20. 取扱い上の注意
20.1 火気を避けて保存すること。
20.2 外箱開封後は遮光して保存すること。
22. 包装
5mL×10アンプル
23. 主要文献
- 山本晋一郎, 綜合臨床, 47 (5), 1017-1018, (1998)
- 谷川久一ほか, 消化器外科, 16 (1), 63-68, (1993)
- 望月圭ほか:中村仁信ほか編, 肝癌の低侵襲治療, 93-115, (1999), (医学書院)
- 椎名秀一朗ほか, 臨床画像, 17 (8), 868-876, (2001)
- 孝田雅彦ほか, 大阪回生病院臨床集報, 149, 33-38, (1989)
- 谷川久一ほか, 臨床医, 14 (8), 976-978, (1988)
- 肝腫瘍生検研究会, 肝腫瘍生検と画像, 3, 209-211, (1990)
- 佐藤博道ほか, 肝腫瘍生検と画像, 3, 159-165, (1990)
- 山田俊彦ほか, 肝腫瘍生検と画像, 3, 172-177, (1990)
- 峯村正実ほか, 肝臓, 40 suppl. (3), 166, (1999)
- 井内英人ほか, 肝臓, 40 suppl. (3), 76, (1999)
- 中村佳子ほか, 肝臓, 40 suppl. (3), 167, (1999)
- 厚生省医薬安全局, 医薬品・医療用具等安全性情報, (161), 21, (2000)
- 金守良ほか, 肝臓, 40 suppl. (3), 167, (1999)
- 江原正明ほか, 癌の臨床, 47 (11), 1073-1079, (2001)
- 市田文弘ほか, 基礎と臨床, 30 (4), 703-726, (1996)
- 山本晋一郎ほか, 川崎医会誌, 16 (1), 23-28, (1990)
- 森近茂ほか, 福山医学, 1, 63-68, (1991)
- 第十八改正 日本薬局方解説書, C-872-880, (2021), (廣川書店)
- 杉浦信之ほか, 肝臓, 24, 920, (1983) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
製品情報問い合わせ先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
26. 製造販売業者等
26.1 製造販売元
ヴィアトリス・ヘルスケア合同会社
東京都港区麻布台一丁目3番1号
26.2 販売元
ヴィアトリス製薬合同会社
東京都港区麻布台一丁目3番1号