医薬品情報
| 総称名 | エパデール |
|---|---|
| 一般名 | イコサペント酸エチル |
| 欧文一般名 | Ethyl Icosapentate |
| 薬効分類名 | EPA製剤 |
| 薬効分類番号 | 2189 |
| KEGG DRUG |
D01892
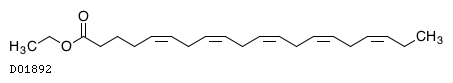
イコサペント酸エチル
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年11月 改訂(第5版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エパデールEMカプセル2g | EPADEL EM Capsules 2g | 持田製薬 | 2189021M1028 | 112.6円/包 |
2. 禁忌
次の患者には投与しないこと
2.1 出血している患者(血友病、毛細血管脆弱症、消化管潰瘍、尿路出血、喀血、硝子体出血等)[止血が困難となるおそれがある。]
2.2 ミフェプリストン・ミソプロストールを投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
適用の前に十分な検査を実施し、高脂血症であることを確認した上で本剤の適用を考慮すること。
6. 用法及び用量
イコサペント酸エチルとして、通常、成人には1回2gを1日1回、食直後に経口投与する。ただし、トリグリセリド高値の程度により、1回4g、1日1回まで増量できる。
8. 重要な基本的注意
8.1 あらかじめ高脂血症治療の基本である食事療法を行い、更に運動療法や高血圧・喫煙等の虚血性心疾患のリスクファクターの軽減等も十分に考慮すること。
8.2 投与中は血中脂質値を定期的に検査し、治療に対する反応が認められない場合には投与を中止すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 出血を助長するおそれのある患者
(1)月経期間中の患者
(2)出血傾向のある患者
(3)手術を予定している患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
10.1 併用禁忌
| ミフェプリストン・ミソプロストール メフィーゴパック [2.2参照] | ミフェプリストン・ミソプロストールによる子宮出血の程度が悪化するおそれがある。 | イコサペント酸エチルの抗血小板作用により出血が増強するおそれがある。 |
10.2 併用注意
| 抗凝固剤 ワルファリンカリウム 等 血小板凝集を抑制する薬剤 アスピリン インドメタシン チクロピジン塩酸塩 シロスタゾール 等 | 出血傾向をきたすおそれがある。 | イコサペント酸エチルは抗血小板作用を有するので、抗凝固剤、血小板凝集を抑制する薬剤との併用により相加的に出血傾向が増大すると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害(頻度不明)、黄疸(頻度不明)
AST、ALT、Al-P、γ-GTP、LDH、ビリルビン等の上昇を伴う肝機能障害、黄疸があらわれることがある。
11.1.2 心房細動(頻度不明)、心房粗動(頻度不明)
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹等 | そう痒感 | |
| 出血傾向 | 鼻出血、歯肉出血 | 皮下出血、血尿、眼底出血、消化管出血等 | |
| 血液 | 貧血等 | ||
| 消化器 | 下痢、腹部不快感 | 悪心、便秘、腹部膨満感、腹痛、口内炎 | 胸やけ、嘔吐、食欲不振、口渇、鼓腸等 |
| 肝臓 | AST・ALT・Al-P・γ-GTP・LDH・ビリルビンの上昇等の肝機能障害 | ||
| 腎臓 | BUN・クレアチニンの上昇 | ||
| 呼吸器 | 咳嗽、呼吸困難 | ||
| 精神神経系 | 頭痛・頭重感、めまい、ふらつき、眠気、不眠、しびれ | ||
| 筋骨格系 | 関節痛、筋肉痛、四肢痛、筋痙攣(こむら返り等) | ||
| その他 | CKの上昇 | 顔面潮紅、ほてり、発熱、動悸、浮腫、頻尿、尿酸上昇、全身倦怠感、血圧上昇、女性化乳房、耳鳴、発汗、ざ瘡 |
14. 適用上の注意
14.1 薬剤交付時の注意
本剤は噛まずに服用させること。
15. その他の注意
15.1 臨床使用に基づく情報
コントロール不良の高血圧症を有し、他の抗血小板剤を併用した症例において、脳出血があらわれたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性に本剤0.5g、1g、2g又は4gを朝食直後に単回経口投与注)したときのEPAの薬物動態パラメータを以下に示す。Cmax及びAUC0-∞は用量依存的に増加した4)。
| 投与量 | Cmaxa)(μg/mL) | tmaxb)(hr) | t1/2a)(hr) | AUC0-∞a)(μg・hr/mL) |
| 0.5g (n=8) | 21.72±5.58 | 3.00(3.0、12.0) | 29.27±15.48 | 669.50±298.95 |
| 1g (n=8) | 48.08±18.05 | 3.00(2.0、5.0) | 44.57±17.27 | 1721.11±493.53 |
| 2g (n=8) | 94.45±33.47 | 3.00(2.0、5.0) | 40.29±18.07 | 2587.56±826.93 |
| 4g (n=7) | 208.84±44.36 | 5.00(3.0、5.0) | 33.93±9.47 | 4274.67±1078.51 |
16.1.2 反復投与
健康成人男性に本剤0.5g、1g、2g若しくは4gを1日1回(朝)又はエパデールS900を1回0.9g、1日2回(朝・夕)、食直後に11日間反復経口投与注)したところ、本剤の投与において、血漿中EPAの濃度は、投与6〜8日以降上昇幅が小さくなり、投与11日目にはほぼ定常状態に達した。本剤2g若しくは4g/日又はエパデールS900 1.8g/日を11日間反復経口投与したときのEPAの薬物動態パラメータを以下に示す4)。
| 投与量 | 投与日 | Css,maxa)(μg/mL) | tmaxb)(hr) | t1/2a)(hr) | AUC0-24hra)(μg・hr/mL) |
| 本剤 2g/日 (n=7) | 11 | 239.93±60.57 | 3.00(3.0、5.0) | 44.87±9.12 | 3409.86±629.05 |
| 本剤 4g/日 (n=8) | 11 | 450.89±145.83 | 4.50(3.0、5.0) | 53.83±10.34 | 5707.02±1552.23 |
| エパデールS900 1.8g/日 (n=8) | 11 | 139.56±16.84 | 5.00(5.0、10.0) | 48.92±9.44 | 2536.38±216.87 |
注)本剤の承認された用法及び用量は、「1日1回2g又は4gを経口投与」である。
16.2 吸収
16.2.1 食事の影響
健康成人男性に本剤2g又は4gを1日1回、朝空腹時又は朝食直後に単回経口投与したときのEPAのCmax及びAUC0-72hrは、食直後投与と比較して、空腹時投与で、本剤2g投与ではそれぞれ30%及び28%、本剤4g投与ではそれぞれ34%及び26%減少した4)。
16.3 分布
16.3.1 組織分布
雌雄ラットに14C標識EPA-Eを単回経口投与したときの組織内分布率は、観察期間を通じて肝、白色脂肪、筋肉及び皮膚で高値であった5)。
16.3.2 血漿蛋白結合率
雄ラット及び雄イヌに14C標識EPA-Eを単回経口投与したときの血漿蛋白結合率は、86.7〜98.8%及び96.7〜98.7%であった5)。
16.4 代謝
EPA-Eは小腸において脱エチル化を受けた後、トリグリセリドやリン脂質等の構成脂肪酸として取り込まれ、リンパ及び血漿を経由して各組織へ移行後、肝又は各組織の主としてミトコンドリアにおいてβ酸化によりアセチルCoAにまで代謝され、TCA回路によって炭酸ガス及び水となって体外に排泄されるものと推定される6)(ラット)。
16.5 排泄
雄ラットに14C標識EPA-Eを経口投与したところ、投与168時間までの尿中への排泄は2.7%、糞中へは16.7%であった。なお、呼気中へ放射活性の44.4%が排泄された5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(エパデールカプセル対照)
トリグリセリドが高値の患者580例を対象として、本剤2g若しくは4gを1日1回(朝)、又はエパデールカプセル300を1回0.9g、1日2回(朝・夕)若しくは1日3回(朝・昼・夕)、食直後に12週間経口投与した無作為化二重盲検並行群間比較試験を行った。検定の多重性を調整するため、閉検定手順を用いて、本剤2g/日群のエパデールカプセル1.8g/日群に対する非劣性が検証された場合に限り、本剤4g/日群の本剤2g/日群に対する優越性を検証することとした。
投与終了時における投与前値からの血清トリグリセリド変化率(主要評価項目)を以下に示す。投与終了時の血清トリグリセリド変化率において、本剤2g/日群のエパデールカプセル1.8g/日群に対する非劣性が示された(非劣性限界値は7%)。また、本剤4g/日群の本剤2g/日群に対する優越性が示された。
投与終了時における投与前値からの血清トリグリセリド変化率(主要評価項目)を以下に示す。投与終了時の血清トリグリセリド変化率において、本剤2g/日群のエパデールカプセル1.8g/日群に対する非劣性が示された(非劣性限界値は7%)。また、本剤4g/日群の本剤2g/日群に対する優越性が示された。
| 投与群 | 投与前値a)(mg/dL) | 変化率a)(%) | エパデールカプセル1.8g/日との差b,c)(%) | 本剤2g/日との差b,c)(%) |
| 本剤2g/日 (1日1回) (n=145) | 257.3±71.7 | −10.09±22.34 | −0.42[−5.76,4.91] | − |
| 本剤4g/日 (1日1回) (n=145) | 252.5±72.4 | −15.51±20.60 | − | −5.74[−10.59,−0.89] |
| エパデールカプセル1.8g/日 (1日2回) (n=145) | 252.3±68.1 | −9.30±24.70 | − | − |
| エパデールカプセル2.7g/日 (1日3回) (n=145) | 251.1±65.2 | −8.80±28.19 | − | − |
副作用の発現頻度は本剤2g/日群で9.0%(13/145例)、本剤4g/日群で10.3%(15/145例)、エパデールカプセル1.8g/日群で7.6%(11/145例)、エパデールカプセル2.7g/日群で9.0%(13/145例)であった。本剤群では2%以上に認められた副作用はなかった7)。
17.1.2 国内第III相長期投与試験
トリグリセリドが高値の患者122例を対象として、本剤2g又は4gを1日1回(朝)、食直後に52週間経口投与した無作為化非盲検試験を行った。
投与前値からの血清トリグリセリド変化率の推移を以下に示す。いずれの群においても、血清トリグリセリドは投与4週時から低下が認められ、投与52週時まで効果が持続した。
投与前値からの血清トリグリセリド変化率の推移を以下に示す。いずれの群においても、血清トリグリセリドは投与4週時から低下が認められ、投与52週時まで効果が持続した。
| 投与群 | 投与前値a)(mg/dL) | 変化率a)(%) | ||||
| 投与4週時 | 投与12週時 | 投与24週時 | 投与52週時 | 投与終了時 | ||
| 本剤 2g/日 | 280.6±71.4 (n=60) | −6.10±26.86 (n=60) | −14.48±24.61 (n=57) | −12.39±23.81 (n=57) | −16.71±36.27 (n=54) | −17.54±34.90 (n=60) |
| 本剤 4g/日 | 281.1±71.8 (n=61) | −8.37±25.53 (n=60) | −17.53±22.68 (n=59) | −17.37±32.78 (n=58) | −21.01±25.10 (n=54) | −17.30±29.01 (n=61) |
副作用の発現頻度は本剤2g/日群で9.8%(6/61例)、本剤4g/日群で8.2%(5/61例)であった。2%以上に認められた副作用は本剤2g/日群で下痢3.3%(2/61例)、本剤4g/日群で軟便3.3%(2/61例)であった8)。
18. 薬効薬理
18.1 作用機序
18.2 血清脂質低下作用
19. 有効成分に関する理化学的知見
19.1. イコサペント酸エチル
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
スティック包装
56包、280包
23. 主要文献
- Bhatt,D.L.et al., N.Engl.J.Med., 380 (1), 11-22, (2019) »PubMed
- Miyauchi,K.et al., Circulation., 150 (6), 425-434, (2024) »PubMed
- Nicholls,S.J.et al., JAMA., 324 (22), 2268-2280, (2020) »PubMed
- 持田製薬社内資料:第I相単回・反復投与試験(エパデールEMカプセル:2022年6月20日承認、CTD 2.7.6.2)
- 石黒淳三 他, 薬物動態, 2 (6), 683-702, (1987) »DOI
- 持田製薬社内資料:EPAEの生体内動態(2)−14C-EPAEのラットにおける代謝−
- 持田製薬社内資料:第III相試験(エパデールEMカプセル:2022年6月20日承認、CTD 2.7.6.4)
- 持田製薬社内資料:第III相長期投与試験(エパデールEMカプセル:2022年6月20日承認、CTD 2.7.6.5)
- Mizuguchi,K.et al., Eur.J.Pharmacol., 231 (1), 121-127, (1993) »PubMed
- Mizuguchi,K.et al., Eur.J.Pharmacol., 235 (2-3), 221-227, (1993) »PubMed
- Mizuguchi,K.et al., Jpn.J.Pharmacol., 59 (3), 307-312, (1992) »PubMed
- 水口 清 他, 動脈硬化, 18 (5), 471, (1990)
- 矢野 崇 他, 動脈硬化, 18 (5), 535, (1990)
- 水口 清 他, 動脈硬化, 18 (5), 536, (1990)
24. 文献請求先及び問い合わせ先
文献請求先
持田製薬株式会社
くすり相談窓口
〒160-8515
東京都新宿区四谷1丁目7番地
電話:03-5229-3906
0120-189-522
0120-189-522
FAX:03-5229-3955
製品情報問い合わせ先
持田製薬株式会社
くすり相談窓口
〒160-8515
東京都新宿区四谷1丁目7番地
電話:03-5229-3906
0120-189-522
0120-189-522
FAX:03-5229-3955
26. 製造販売業者等
26.1 製造販売元
持田製薬株式会社
東京都新宿区四谷1丁目7番地