医薬品情報
| 総称名 | ジェセリ |
|---|---|
| 一般名 | ピミテスピブ |
| 欧文一般名 | Pimitespib |
| 製剤名 | ピミテスピブ錠 |
| 薬効分類名 | 抗悪性腫瘍剤 HSP注)90阻害剤 注)HSP:Heat Shock Protein(ヒートショックプロテイン) |
| 薬効分類番号 | 4291 |
| KEGG DRUG |
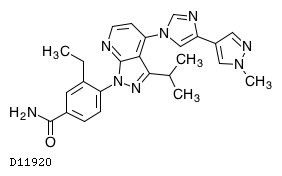
D11920
ピミテスピブ
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジェセリ錠40mg | Jeselhy tablets | 大鵬薬品工業 | 4291078F1021 | 6265円/錠 | 劇薬, 処方箋医薬品 |
1. 警告
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで本剤の使用が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
がん化学療法後に増悪した消化管間質腫瘍
5. 効能または効果に関連する注意
5.1 イマチニブ、スニチニブ及びレゴラフェニブによる治療後の患者を対象とすること。
5.2 本剤の手術の補助療法としての有効性及び安全性は確立していない。
6. 用法及び用量
通常、成人にはピミテスピブとして1日1回160mgを空腹時に投与する。5日間連続経口投与したのち2日間休薬し、これを繰り返す。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.1 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2 食後に本剤を投与した場合、Cmax及びAUCが上昇する。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けること。[16.2.1参照]
7.3 副作用がみられた場合は、症状、重症度に応じて以下の基準を考慮して、本剤を休薬・減量すること。
| 減量レベル | 投与量 |
| 通常投与量 | 160mg/日 |
| 1段階減量 | 120mg/日 |
| 2段階減量 | 80mg/日 |
| 3段階減量 | 40mg/日 |
| 副作用 | 程度注) | 処置 |
| 下痢 | グレード2 | 管理困難で忍容不能な場合は、グレード1以下に回復するまで休薬する。回復後、同一用量で投与を再開できる。 |
| グレード3以上 | グレード1以下に回復するまで休薬する。回復後、1段階減量した用量又は同一用量で投与を再開できる。 | |
| 眼障害 | グレード2以上 | グレード1以下に回復するまで休薬する。回復後、1段階減量した用量又は同一用量で投与を再開できる。 |
| 上記以外の副作用 | グレード3以上 | グレード2又はグレード1以下に回復するまで休薬する。グレード2に回復後、1段階減量した用量又はグレード1以下に回復後、同一用量で投与を再開できる。 |
8. 重要な基本的注意
8.1 重度の下痢があらわれることがあるので、定期的に症状を確認するなど、患者の状態を十分に観察すること。[11.1.1参照]
8.2 眼障害があらわれることがあるので、本剤投与開始前及び投与期間中は定期的に眼の異常の有無を確認し、必要に応じて検査を行うなど、患者の状態を十分に観察すること。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
本剤は主に肝臓で代謝されるため、血中濃度が上昇する可能性がある。なお、中等度(総ビリルビンが基準値上限1.5倍より高い)の肝機能障害患者を対象とした臨床試験は実施していない。
9.4 生殖能を有する者
9.4.1 生殖可能な患者に投与する必要がある場合には、生殖機能の低下があらわれる可能性があることを考慮すること。動物実験(ラット)で膣上皮のアポトーシス小体増加、卵巣の多巣性嚢胞、白斑、黄体減少及び間質腺増生が報告されている。動物実験(ラット及びイヌ)で精細管変性及び副生殖腺の萎縮性変化、精巣上体での精子減少を伴う胚上皮の変性/壊死が報告されている1)。
9.4.2 妊娠する可能性のある女性には、本剤投与中及び最終投与後7カ月間において避妊する必要性及び適切な避妊法について説明すること。[9.5、15.2参照]
9.4.3 男性には、本剤投与中及び最終投与後4カ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[15.2参照]
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。本剤が乳汁に移行する可能性があり、乳児が乳汁を介して本剤を摂取した場合、乳児に重篤な副作用が発現するおそれがある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は、CYP3A、MATE1及びMATE2-Kの阻害作用を示す。
薬物代謝酵素用語
CYP3A
薬物代謝酵素用語
MATE1
薬物代謝酵素用語
MATE2-K
10.2 併用注意
| CYP3Aの基質となる薬剤 ミダゾラム、アルプラゾラム、アトルバスタチン等 [16.7.1参照] | これらの薬剤の副作用が増強されるおそれがあるため、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤がCYP3Aを阻害することにより、これらの薬剤の血中濃度が上昇する可能性がある。 |
| MATE1及びMATE2-Kの基質となる薬剤 メトホルミン、ピルシカイニド、プロカインアミド等 [16.7.1参照] | これらの薬剤の副作用が増強されるおそれがあるため、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤がMATE1及びMATE2-Kを阻害することにより、これらの薬剤の血中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 重度の下痢
重度の下痢(16.0%)により脱水をきたし、重篤な腎障害があらわれることがある。[8.1参照]
11.1.2 眼障害
夜盲(12.0%)、霧視(5.3%)、視力障害(5.3%)、網膜静脈閉塞(1.3%)、網膜症(1.3%)、後天性色覚異常(1.3%)等があらわれることがある。[8.2参照]
11.1.3 出血
腹腔内出血(1.3%)、出血性十二指腸潰瘍(1.3%)等があらわれることがある。
11.2 その他の副作用
| 10%以上 | 5〜10%未満 | 5%未満 | |
| 精神神経系 | 発声障害 | ||
| 血液 | 貧血 | 血小板数減少 | |
| 感覚器 | 味覚障害 | ||
| 肝臓 | ALT上昇、AST上昇、肝障害 | 血中ビリルビン増加、ALP増加 | |
| 呼吸器 | 肺炎 | ||
| 腎臓・泌尿器 | 腎機能障害、血中クレアチニン増加(28.0%) | 膀胱炎、排尿困難、蛋白尿 | |
| 消化器 | 下痢(72.0%)、食欲減退(29.3%)、悪心(25.3%) | 嘔吐 | 腹部不快感、腹痛、口内乾燥、消化不良、腸炎、口内炎 |
| 皮膚 | 発疹 | 脱毛症、ざ瘡様皮膚炎、湿疹、そう痒症、斑状丘疹状皮疹 | |
| その他 | 倦怠感(26.7%) | 甲状腺機能低下症、浮腫、発熱、LDH増加、体重減少、脱水、低カリウム血症、血中リン減少 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
遺伝毒性試験成績から、染色体構造異常誘発作用が認められた3)。[9.4.2、9.4.3参照]
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
日本人進行固形癌患者22例に、本剤160mgを空腹時に1日1回反復経口投与したときのピミテスピブの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった4)。
本剤160mgを1日1回反復経口投与したときの血漿中濃度推移(平均値+標準偏差、n=22)
| PK parameter(unit) | Day1(n=22) | Day5(n=22) |
| Tmax(hr) | 3.87(1.00〜8.00) | 2.98(1.00〜7.98) |
| Cmax(ng/mL) | 2263±758 | 2600±942 |
| AUClast(ng・hr/mL) | 28394±7351 | 35277±12003 |
| AUCinf(ng・hr/mL) | 38570±9686a) | NC |
| T1/2(hr) | 11.22±3.48a) | 10.40±2.32a) |
本剤160mgを空腹時に1日1回反復経口投与したときの投与5日目におけるピミテスピブの蓄積率は1.27であった。
16.2 吸収
16.2.1 食事の影響
16.3 分布
ピミテスピブのヒト血漿蛋白結合率は93.1〜93.6%であり、主にヒト血清アルブミンと結合していた(in vitro)。ピミテスピブのヒト血液/血漿中濃度比は0.525〜0.630であった6)(in vitro)。
16.4 代謝
ピミテスピブは主にCES1によって代謝される(in vitro)。進行固形癌患者3例に本剤150.5mg/m2注)を反復経口投与したとき、投与24時間後までの尿中に未変化体、アミド加水分解体、N-脱メチル体等が検出された7)。
16.5 排泄
日本人進行固形癌患者6例に本剤107.5mg/m2注)を経口投与したとき、投与24時間後までに投与量の2.2%が尿中に未変化体として排泄された8)。
16.7 薬物相互作用
16.7.1 ミダゾラム及びメトホルミン
16.7.2 その他
(1)ピミテスピブはP-gp及びBCRPの基質である(in vitro)。
(2)ピミテスピブはP-gp、BCRP及びOATP1B1を阻害する10)(in vitro)。
注)本剤の承認された用法・用量は下記のとおりである。
通常、成人にはピミテスピブとして1日1回160mgを空腹時に投与する。5日間連続経口投与したのち2日間休薬し、これを繰り返す。なお、患者の状態により適宜減量する。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(10058030試験)
イマチニブ、スニチニブ及びレゴラフェニブによる治療後に増悪した注1)切除不能又は遠隔転移を有する消化管間質腫瘍患者86例を対象に、本剤160mg又はプラセボを1日1回5日間連続経口投与したのち2日間休薬するスケジュールで繰り返し投与した結果、本剤はプラセボと比較して主要評価項目である改変RECIST ver.1.1注2)に基づく無増悪生存期間を有意に延長した(2020年6月23日データカットオフ)11)。
注1)イマチニブ、スニチニブ及びレゴラフェニブによる治療に対して、RECISTに基づく進行、又は臨床的な増悪若しくは不耐と判定された患者が対象とされた。
注2)通常のRECIST ver.1.1から以下の点が改変された基準が用いられた。
[1]リンパ節病変を標的病変として選択しない。
[2]既存の腫瘍内に新たに出現した腫瘍結節を新規病変と判定する基準について、(i)最長径が2cm以上で、ダイナミックCTで造影される病変であること、かつ(ii)21日以上の撮像間隔かつ2回以上連続した腫瘍評価で認められることと定義する。
| 投与群 | 症例数 | 無増悪生存期間中央値(月) (95%信頼区間) | p値 (片側)注3) | ハザード比注4) (95%信頼区間) |
| 本剤 | 58 | 2.8 (1.6,2.9) | 0.006 | 0.51 (0.30,0.87) |
| プラセボ | 28 | 1.4 (0.9,1.8) |
無増悪生存期間のKaplan-Meier曲線
副作用は本剤が投与された注5)75例中70例(93.3%)に認められた。主な副作用の発現例数(発現率)は、下痢54例(72%)、食欲減退22例(29.3%)、血中クレアチニン増加21例(28%)、倦怠感20例(26.7%)、悪心19例(25.3%)、腎機能障害10例(13.3%)、夜盲9例(12%)であった。
注5)本剤群58例及びプラセボから本剤への切替え例17例
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. ピミテスピブ
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
PTP包装
40錠(10錠×4)
23. 主要文献
- 反復投与毒性試験(トキシコキネティクス評価を含む)(2022年6月20日承認、CTD2.6.6.3)
- 胚・胎児発生に関する試験(2022年6月20日承認、CTD2.6.6.6.1)
- 遺伝毒性試験(2022年6月20日承認、CTD2.6.6.4)
- 臨床薬理試験(2022年6月20日承認、CTD2.7.2.2)
- 臨床薬理試験(2022年6月20日承認、CTD2.7.1.2)
- 薬物動態試験(2022年6月20日承認、CTD2.6.4.4)
- 薬物動態試験(2022年6月20日承認、CTD2.6.4.5)
- 臨床薬理試験(2022年6月20日承認、CTD2.7.2.2)
- 臨床薬理試験(2022年6月20日承認、CTD2.7.2.3.6)
- 薬物動態試験(2022年6月20日承認、CTD2.6.4.7)
- Kurokawa Y,et al., Ann Oncol., 33 (9), 959-967, (2022) »PubMed
- Yoshimura C,et al., J Med Chem., 64 (5), 2669-2677, (2021) »PubMed
- 薬効薬理試験(2022年6月20日承認、CTD2.6.2.2)
- Saito Y,et al., Br J Cancer., 122 (5), 658-667, (2020) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
製品情報問い合わせ先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
26. 製造販売業者等
26.1 製造販売元
大鵬薬品工業株式会社
東京都千代田区神田錦町1-27