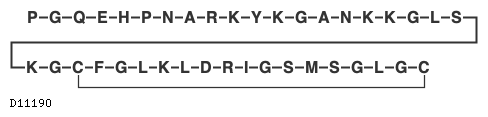医薬品情報
| 総称名 | ボックスゾゴ |
|---|---|
| 一般名 | ボソリチド(遺伝子組換え) |
| 欧文一般名 | Vosoritide(Genetical Recombination) |
| 製剤名 | ボソリチド(遺伝子組換え)製剤 |
| 薬効分類名 | 軟骨無形成症治療薬 |
| 薬効分類番号 | 3999 |
| ATCコード | M05BX07 |
| KEGG DRUG |
D11190
ボソリチド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 改訂(第6版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ボックスゾゴ皮下注用0.4mg | Voxzogo for Subcutaneous Injection | BioMarin Pharmaceutical Japan | 3999465D1028 | 104092円/瓶 | 処方箋医薬品注) |
| ボックスゾゴ皮下注用0.56mg | Voxzogo for Subcutaneous Injection | BioMarin Pharmaceutical Japan | 3999465D2024 | 106850円/瓶 | 処方箋医薬品注) |
| ボックスゾゴ皮下注用1.2mg | Voxzogo for Subcutaneous Injection | BioMarin Pharmaceutical Japan | 3999465D3020 | 107498円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
骨端線閉鎖を伴わない軟骨無形成症
5. 効能または効果に関連する注意
骨端線の閉鎖により成長の可能性がないことが確認された場合、本剤の投与を中止すること。
6. 用法及び用量
通常、ボソリチド(遺伝子組換え)として、2歳以上の患者には15μg/kgを、2歳未満の患者には30μg/kgを1日1回、皮下注射する。ただし、1回投与量は1mgを超えないこと。
7. 用法及び用量に関連する注意
ボックスゾゴ皮下注用0.4mg
7.1 2歳以上の患者には、下表を参考に投与量を決定し、投与すること。[14.1.1参照]
| ボックスゾゴ皮下注用0.4mg | ボックスゾゴ皮下注用0.56mg | ボックスゾゴ皮下注用1.2mg | |
| 溶解後液量 | 0.5mL | 0.7mL | 0.6mL |
| 溶解後濃度 | 0.8mg/mL | 0.8mg/mL | 2.0mg/mL |
| 採取可能量 | 0.3mL | 0.5mL | 0.4mL |
| 患者の体重(kg) | 投与量(mL) | ||
| 8-9 | 0.15 | ||
| 10-11 | 0.20 | ||
| 12-14 | 0.25 | ||
| 15-17 | 0.30 | ||
| 18-19 | 0.35 | ||
| 20-22 | 0.40 | ||
| 23-25 | 0.45 | ||
| 26-27 | 0.50 | ||
| 28-29 | 0.20 | ||
| 30-36 | 0.25 | ||
| 37-43 | 0.30 | ||
| 44-49 | 0.35 | ||
| 50-56 | 0.40 | ||
| 57-63 | 0.45a) | ||
| ≧64 | 0.50a) | ||
7.2 2歳未満の患者には、下表を参考に投与量を決定し、投与すること。[14.1.1参照]
| ボックスゾゴ皮下注用0.4mg | ボックスゾゴ皮下注用0.56mg | |
| 溶解後液量 | 0.5mL | 0.7mL |
| 溶解後濃度 | 0.8mg/mL | 0.8mg/mL |
| 採取可能量 | 0.3mL | 0.5mL |
| 患者の体重(kg) | 投与量(mL) | |
| 3 | 0.12 | |
| 4 | 0.15 | |
| 5 | 0.20 | |
| 6-7 | 0.25 | |
| 8 | 0.30 | |
| 9 | 0.35 | |
| 10-11 | 0.40 | |
| 12 | 0.45 | |
| 13 | 0.50 | |
7.3 本剤は1日1回投与する薬剤であり、可能な限り同一時間帯に投与すること。
7.4 本剤の投与を忘れた場合は、次回投与までの期間が12時間以上であれば気づいた時点で投与し、その後はあらかじめ定めた時間帯に投与すること。次回投与までの期間が12時間未満であれば投与せず、次のあらかじめ定めた時間帯に投与すること。
ボックスゾゴ皮下注用0.56mg
7.1 2歳以上の患者には、下表を参考に投与量を決定し、投与すること。[14.1.1参照]
| ボックスゾゴ皮下注用0.4mg | ボックスゾゴ皮下注用0.56mg | ボックスゾゴ皮下注用1.2mg | |
| 溶解後液量 | 0.5mL | 0.7mL | 0.6mL |
| 溶解後濃度 | 0.8mg/mL | 0.8mg/mL | 2.0mg/mL |
| 採取可能量 | 0.3mL | 0.5mL | 0.4mL |
| 患者の体重(kg) | 投与量(mL) | ||
| 8-9 | 0.15 | ||
| 10-11 | 0.20 | ||
| 12-14 | 0.25 | ||
| 15-17 | 0.30 | ||
| 18-19 | 0.35 | ||
| 20-22 | 0.40 | ||
| 23-25 | 0.45 | ||
| 26-27 | 0.50 | ||
| 28-29 | 0.20 | ||
| 30-36 | 0.25 | ||
| 37-43 | 0.30 | ||
| 44-49 | 0.35 | ||
| 50-56 | 0.40 | ||
| 57-63 | 0.45a) | ||
| ≧64 | 0.50a) | ||
7.2 2歳未満の患者には、下表を参考に投与量を決定し、投与すること。[14.1.1参照]
| ボックスゾゴ皮下注用0.4mg | ボックスゾゴ皮下注用0.56mg | |
| 溶解後液量 | 0.5mL | 0.7mL |
| 溶解後濃度 | 0.8mg/mL | 0.8mg/mL |
| 採取可能量 | 0.3mL | 0.5mL |
| 患者の体重(kg) | 投与量(mL) | |
| 3 | 0.12 | |
| 4 | 0.15 | |
| 5 | 0.20 | |
| 6-7 | 0.25 | |
| 8 | 0.30 | |
| 9 | 0.35 | |
| 10-11 | 0.40 | |
| 12 | 0.45 | |
| 13 | 0.50 | |
7.3 本剤は1日1回投与する薬剤であり、可能な限り同一時間帯に投与すること。
7.4 本剤の投与を忘れた場合は、次回投与までの期間が12時間以上であれば気づいた時点で投与し、その後はあらかじめ定めた時間帯に投与すること。次回投与までの期間が12時間未満であれば投与せず、次のあらかじめ定めた時間帯に投与すること。
ボックスゾゴ皮下注用1.2mg
7.1 2歳以上の患者には、下表を参考に投与量を決定し、投与すること。[14.1.1参照]
| ボックスゾゴ皮下注用0.4mg | ボックスゾゴ皮下注用0.56mg | ボックスゾゴ皮下注用1.2mg | |
| 溶解後液量 | 0.5mL | 0.7mL | 0.6mL |
| 溶解後濃度 | 0.8mg/mL | 0.8mg/mL | 2.0mg/mL |
| 採取可能量 | 0.3mL | 0.5mL | 0.4mL |
| 患者の体重(kg) | 投与量(mL) | ||
| 8-9 | 0.15 | ||
| 10-11 | 0.20 | ||
| 12-14 | 0.25 | ||
| 15-17 | 0.30 | ||
| 18-19 | 0.35 | ||
| 20-22 | 0.40 | ||
| 23-25 | 0.45 | ||
| 26-27 | 0.50 | ||
| 28-29 | 0.20 | ||
| 30-36 | 0.25 | ||
| 37-43 | 0.30 | ||
| 44-49 | 0.35 | ||
| 50-56 | 0.40 | ||
| 57-63 | 0.45a) | ||
| ≧64 | 0.50a) | ||
7.3 本剤は1日1回投与する薬剤であり、可能な限り同一時間帯に投与すること。
7.4 本剤の投与を忘れた場合は、次回投与までの期間が12時間以上であれば気づいた時点で投与し、その後はあらかじめ定めた時間帯に投与すること。次回投与までの期間が12時間未満であれば投与せず、次のあらかじめ定めた時間帯に投与すること。
8. 重要な基本的注意
8.1 一過性の血圧低下や血圧低下に伴う症状(めまい、吐き気、疲労、失神等)があらわれることがあるので、本剤投与時には適切な水分補給を行うよう患者に指導すること。
8.2 一過性の血圧低下があらわれることがあるので、高所での作業、自動車の運転等危険を伴う作業に従事する場合には注意させること。
8.3 本剤の自己注射にあたっては、以下の点に留意すること。
・投与法について十分な教育訓練を実施したのち、患者自ら確実に投与できることを確認した上で、医師の管理指導の下で実施すること。
・全ての器具の安全な廃棄方法について指導を徹底すること。
・注射方法の説明書を必ず読むよう指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な心疾患のある患者
臨床試験では除外されている。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
10. 相互作用
10.2 併用注意
| 降圧剤 (カルシウム拮抗薬、アンジオテンシン受容体拮抗薬、アンジオテンシン変換酵素阻害薬、利尿薬、β遮断薬、等) | 血圧低下があらわれる可能性がある。 | 本剤は血管拡張作用による降圧作用を有するため、併用による降圧作用が増強する可能性がある。 |
11. 副作用
11.2 その他の副作用
| 10%以上 | 10%未満 | 頻度不明 | |
| 神経系障害 | 失神 失神寸前の状態 浮動性めまい | ||
| 血管障害 | 低血圧 | ||
| 胃腸障害 | 嘔吐(26%) | 悪心 | |
| 皮膚及び皮下組織障害 | 多毛症 | ||
| 全身障害及び投与部位の状態 | 注射部位反応(85%) | 疲労 | |
| 臨床検査 | 血中アルカリホスファターゼ増加 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.2 バイアル及び添付溶解液を冷蔵庫で保存している場合は、調製前に室温に戻しておくこと。
14.1.3 各バイアルに添付された溶解液以外は使用しないこと。バイアルに添付の溶解液全量を加えた後、静かに円を描くように回して溶解すること(激しく振盪しないこと)。投与用シリンジで必要量を抜き取ること。
14.1.4 用時調製し、溶解後は直ちに使用すること。直ちに使用できない場合でも、溶解後、室温で3時間以内に使用すること。
14.1.5 溶解後に目視にてバイアル内を確認し、異物や変色が認められる場合は使用しないこと。溶解後、溶液は無色〜黄色の液体となる。
14.1.6 各バイアルは1回限りの使用とし、残液は廃棄すること。
14.2 薬剤投与時の注意
皮下投与は、大腿部、腹部、臀部又は上腕部に行うこと。同一部位へ繰り返し注射することは避け、投与毎に注射部位を変えること。
15. その他の注意
15.1 臨床使用に基づく情報
臨床試験において、5歳以上の軟骨無形成症患者の37.8%(59/156例)に抗ボソリチド抗体の産生が報告され、1.9%(3/156例)に中和抗体の産生が報告された。
5歳未満の軟骨無形成症患者では、18.6%(8/43例)に抗ボソリチド抗体産生が報告され、抗ボソリチド抗体陽性患者からは中和抗体は検出されなかった。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与1)
外国人健康成人(14例)に本剤5、10又は15μg/kgを単回皮下投与したときの血漿中濃度推移及び本薬の薬物動態パラメータは以下のとおりであった。
血漿中薬物濃度の推移図
| 用量(μg/kg) | |||
| 5 | 10 | 15 | |
| 例数 | 5 | 5 | 4 |
| Cmax(ng/mL) | 2.30±1.07 | 6.75±4.08 | 8.83±2.88 |
| AUC0-t(ng・min/mL) | 90.0±15.3a) | 607±562 | 687±424 |
| tmax(min) | 15[15,30] | 30[15,30] | 20[15,30] |
| t1/2(min) | − | 31.6,76.0b) | 69.5±61.2c) |
| CL/F(mL/min/kg) | − | 5.76,15.1b) | 20.3±11.3c) |
| Vz/F(mL/kg) | − | 632,688b) | 1500±530c) |
16.1.2 反復投与
5歳以上18歳未満の軟骨無形成症患者(58例、日本人3例を含む)に本剤15μg/kgを1日1回反復皮下投与したときの本薬の薬物動態パラメータは表2のとおりであった。
| 時点 | ||
| 1日目 | 52週時 | |
| 例数 | 58 | 56 |
| Cmax(ng/mL) | 7.18±9.65 | 5.80±3.68 |
| AUC0-t(ng・min/mL) | 242±232 | 290±235 |
| tmax(min) | 15.0[5,35] | 15.0[5,60] |
| t1/2(min) | 21.0±4.67a) | 27.9±9.91b) |
| CL/F(mL/min/kg) | 104±98.8a) | 79.4±53.0b) |
| Vz/F(mL/kg) | 2880±2450a) | 2910±1660b) |
5歳未満の軟骨無形成症患者に本剤15又は30μg/kgを1日1回反復皮下投与したときの本薬の薬物動態パラメータは表3のとおりであった。
| 年齢 | ||||||
| 2歳以上5歳未満 | 6カ月以上2歳未満 | 6カ月未満 | ||||
| 用量(μg/kg) | 15 | 15 | 30 | 30 | 30 | 30 |
| 時点 | 1日目 | 52週時 | 1日目 | 52週時 | 1日目 | 52週時 |
| Cmax(ng/mL) | 4.43±3.67 (18例) | 5.64±2.74 (16例) | 14.5±5.90 (7例) | 12.9±6.26 (3例) | 13.4±5.71 (11例) | 13.5±6.77 (8例) |
| AUC0-t(ng・min/mL) | 132±97.3 (18例) | 258±169 (16例) | 547±279 (7例) | 672±334 (3例) | 323±129 (11例) | 557±401 (8例) |
| tmax(min) | 15.0[4,30] (18例) | 15.0[7,31] (16例) | 14.0[4,30] (7例) | 14.0[13,16] (3例) | 5.0[5,14] (11例) | 15.5[6,17] (8例) |
| t1/2(min) | 21.7±7.99 (16例) | 29.0±9.12 (15例) | 33.3±8.41 (7例) | 40.1±15.2 (3例) | 41.1±18.8 (8例) | 24.3±6.58 (7例) |
| CL/F(mL/min/kg) | 134±59.8 (16例) | 69±41.2 (15例) | 65.9±31.6 (7例) | 49.7±32 (3例) | 95.9±34.0 (8例) | 76.5±49.8 (7例) |
| Vz/F(mL/kg) | 4070±2310 (16例) | 2660±1420 (15例) | 3190±1790 (7例) | 3040±2630 (3例) | 5240±1890 (8例) | 2620±1950 (7例) |
16.4 代謝
本剤は、中性エンドペプチターゼによる分解に対して抵抗性があることが示された(in vitro試験)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第III相試験2)
5歳以上18歳未満の骨端線閉鎖を伴わない軟骨無形成症患者121例(日本人7例を含む)を対象に、本剤15μg/kg(60例、うち日本人3例)又はプラセボ(61例、うち日本人4例)を1日1回52週間皮下投与した。なお、成長ホルモン製剤は併用しないこととされた。
主要評価項目である年間成長速度のベースラインから投与52週時までの変化量は表4のとおりであり、本剤群のプラセボ群に対する優越性が示された。また、副次評価項目である身長Zスコアの結果は表4のとおりであった。
主要評価項目である年間成長速度のベースラインから投与52週時までの変化量は表4のとおりであり、本剤群のプラセボ群に対する優越性が示された。また、副次評価項目である身長Zスコアの結果は表4のとおりであった。
| プラセボ群(61例) | 本剤群(60例) | |
| 年間成長速度(cm/年):主要評価項目 | ||
| 投与前a) | 4.06±1.20 | 4.26±1.53 |
| 投与52週時b) | 3.94±1.07 | 5.61±1.05 |
| 変化量c) | 0.13[−0.18,0.45] | 1.71[1.40,2.01] |
| 群間差c) | 1.57[1.22,1.93] | |
| p値c)d) | p<0.0001 | |
| 身長Zスコア | ||
| 投与前a) | −5.14±1.07 | −5.13±1.11 |
| 投与52週時b) | −5.14±1.09 | −4.89±1.09 |
| 変化量c) | −0.01[−0.10,0.09] | 0.27[0.18,0.36] |
本剤群における副作用発現頻度は88.3%(53/60例)であり、主な副作用は、注射部位反応71.7%(43/60例)、注射部位紅斑68.3%(41/60例)、注射部位腫脹38.3%(23/60例)、注射部位蕁麻疹11.7%(7/60例)及び血圧低下11.7%(7/60例)であった。プラセボ群における副作用発現頻度は83.6%(51/61例)であり、主な副作用は、注射部位紅斑63.9%(39/61例)、注射部位反応45.9%(28/61例)、注射部位内出血11.5%(7/61例)及び注射部位出血11.5%(7/61例)であった。
17.1.2 国際共同第II相試験3)
5歳未満の骨端線閉鎖を伴わない軟骨無形成症患者75例(日本人8例を含む)を対象に、コホート1(2歳以上5歳未満)では本剤15μg/kg又はプラセボを1日1回、コホート2(6カ月以上2歳未満)及びコホート3(6カ月未満)では本剤30μg/kg又はプラセボを1日1回、52週間皮下投与した。なお、成長ホルモン製剤は併用しないこととされた。いずれのコホートにおいても、センチネル被験者として3〜4例に対して非盲検下で本剤を投与し、安全性及び薬物動態を評価した後、64例を本剤群又はプラセボ群に無作為割り付けした。無作為化された被験者64例における主な有効性評価項目の結果は表5のとおりであった。
| 全体 | コホート1 | コホート2 | コホート3 | |||||
| プラセボ群 | 本剤群 | プラセボ群 | 本剤群 | プラセボ群 | 本剤群 | プラセボ群 | 本剤群 | |
| 身長Zスコア(主要評価項目) | ||||||||
| ベースライン | −4.28±1.48 (32例) | −3.79±0.97 (32例) | −5.13±1.15 (16例) | −4.27±0.81 (15例) | −4.21±1.24 (8例) | −3.39±0.84 (8例) | −2.65±0.79 (8例) | −3.34±1.02 (9例) |
| 52週時 | −4.52±1.19 (32例) | −3.92±0.78 (31例) | −5.06±1.01 (16例) | −4.14±0.72 (15例) | −4.36±1.33 (8例) | −3.40±0.80 (8例) | −3.59±0.76 (8例) | −4.04±0.73 (8例) |
| 変化量a) | −0.31[−0.48,−0.13] | −0.06[−0.26,0.15] | −0.06[−0.28,0.16] | 0.27[0.04,0.50] | −0.19[−0.58,0.20] | 0.02[−0.38,0.41] | −0.91[−1.36,−0.45] | −0.68[−1.21,−0.15] |
| 群間差a) | 0.25[−0.02,0.53] | 0.33[0.00,0.67] | 0.21[−0.37,0.79] | 0.23[−0.45,0.91] | ||||
| 年間成長速度(cm/年) | ||||||||
| ベースライン | 9.60±7.74 (32例) | 11.06±7.57 (32例) | 4.20±1.78 (16例) | 4.74±1.68 (15例) | 10.55±4.78 (8例) | 11.51±4.66 (8例) | 19.45±7.55 (8例) | 21.19±2.80 (9例) |
| 52週時 | 7.35±2.44 (32例) | 8.08±2.50 (31例) | 5.45±0.87 (16例) | 6.35±1.70 (15例) | 8.05±1.85 (8例) | 8.66±2.12 (8例) | 10.43±1.30 (8例) | 10.74±1.22 (8例) |
| 変化量b) | −2.95[−3.45,−2.45] | −2.17[−2.76,−1.58] | 0.89[0.23,1.55] | 1.99[1.31,2.67] | −3.00[−3.86,−2.13] | −2.36[−3.22,−1.50] | −10.14[−11.48,−8.79] | −9.34[−10.78,−7.91] |
| 群間差b) | 0.78[0.02,1.54] | 1.10[0.13,2.07] | 0.63[−0.60,1.87] | 0.79[−1.08,2.67] | ||||
本剤群における副作用発現頻度は86.0%(37/43例)であり、主な副作用は、注射部位反応79.1%(34/43例)、注射部位紅斑76.7%(33/43例)、注射部位腫脹18.6%(8/43例)、注射部位蕁麻疹14.0%(6/43例)、注射部位内出血11.6%(5/43例)及び注射部位硬結11.6%(5/43例)であった。プラセボ群における副作用発現頻度は53.1%(17/32例)であり、主な副作用は注射部位反応40.6%(13/32例)、注射部位紅斑40.6%(13/32例)及び注射部位内出血15.6%(5/32例)であった。
18. 薬効薬理
18.1 作用機序
18.2 薬理作用
重度の四肢短縮型矮小発育症の表現型を有するタナトフォリック骨異形成症モデルマウスであるFgfr3Y367C/+マウス、及び軽度の四肢短縮型矮小発育症の表現型を有する軟骨異形成症モデルマウスであるFgfr3G380Rマウスにおいて、本薬投与により成長板の拡大並びにそれに続く四肢骨格及び中軸骨格の成長が認められた6)。
19. 有効成分に関する理化学的知見
19.1. ボソリチド(遺伝子組換え)
20. 取扱い上の注意
凍結を避けること。冷蔵庫(2〜8℃)で保管できない場合は、室温で保管することもできるが、3か月以内に使用すること。また、室温で保管した後は冷蔵庫に戻さないこと。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
<ボックスゾゴ皮下注用0.4mg>
1バイアル(日局注射用水0.5mL/プレフィルドシリンジ 1シリンジ添付)
<ボックスゾゴ皮下注用0.56mg>
1バイアル(日局注射用水0.7mL/プレフィルドシリンジ 1シリンジ添付)
<ボックスゾゴ皮下注用1.2mg>
1バイアル(日局注射用水0.6mL/プレフィルドシリンジ 1シリンジ添付)
23. 主要文献
- 社内資料:本薬の血漿中濃度(承認年月日:2022年6月20日、CTD 2.7.2.2)
- 社内資料:111-301試験(承認年月日:2022年6月20日、CTD 2.7.6.5)
- 社内資料:111-206試験総括報告書
- Lorget F,et al., Am.J.Hum.Genet., 91 (6), 1108-1114, (2012) »PubMed
- Krejci P,et al., J.Cell Sci., 118 (21), 5089-5100, (2005)
- 社内資料:Animal model(承認年月日:2022年6月20日、CTD 2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
BioMarin Pharmaceutical Japan株式会社
メディカルインフォメーション
〒160-0022
東京都新宿区新宿四丁目1番6号 JR新宿ミライナタワー
電話:03-6837-0844
製品情報問い合わせ先
BioMarin Pharmaceutical Japan株式会社
メディカルインフォメーション
〒160-0022
東京都新宿区新宿四丁目1番6号 JR新宿ミライナタワー
電話:03-6837-0844
25. 保険給付上の注意
本製剤の効能又は効果に関連する注意において、「骨端線の閉鎖により成長の可能性がないことが確認された場合、本剤の投与を中止すること。」とされているので、使用にあたっては十分留意すること(保医発0817第4号:令和4年8月17日付)。
26. 製造販売業者等
26.1 製造販売業者
BioMarin Pharmaceutical Japan株式会社
東京都新宿区新宿四丁目1番6号
26.2 製造業者
BioMarin International Limited,Ireland