医薬品情報
| 総称名 | タリージェ |
|---|---|
| 一般名 | ミロガバリンベシル酸塩 |
| 欧文一般名 | Mirogabalin Besilate |
| 製剤名 | ミロガバリンベシル酸塩製剤 |
| 薬効分類名 | 神経障害性疼痛治療剤 |
| 薬効分類番号 | 1190 |
| ATCコード | N02BF03 |
| KEGG DRUG |
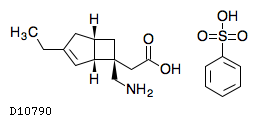
D10790
ミロガバリンベシル酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年1月 改訂(第9版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タリージェ錠2.5mg | TARLIGE TABLETS | 第一三共 | 1190026F1028 | 67.2円/錠 | 処方箋医薬品注) |
| タリージェ錠5mg | TARLIGE TABLETS | 第一三共 | 1190026F2024 | 92.5円/錠 | 処方箋医薬品注) |
| タリージェ錠10mg | TARLIGE TABLETS | 第一三共 | 1190026F3020 | 127.9円/錠 | 処方箋医薬品注) |
| タリージェ錠15mg | TARLIGE TABLETS | 第一三共 | 1190026F4027 | 154.8円/錠 | 処方箋医薬品注) |
| タリージェOD錠2.5mg | TARLIGE OD TABLETS | 第一三共 | 1190026F5023 | 67.2円/錠 | 処方箋医薬品注) |
| タリージェOD錠5mg | TARLIGE OD TABLETS | 第一三共 | 1190026F6020 | 92.5円/錠 | 処方箋医薬品注) |
| タリージェOD錠10mg | TARLIGE OD TABLETS | 第一三共 | 1190026F7026 | 127.9円/錠 | 処方箋医薬品注) |
| タリージェOD錠15mg | TARLIGE OD TABLETS | 第一三共 | 1190026F8022 | 154.8円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人には、ミロガバリンとして初期用量1回5mgを1日2回経口投与し、その後1回用量として5mgずつ1週間以上の間隔をあけて漸増し、1回15mgを1日2回経口投与する。なお、年齢、症状により1回10mgから15mgの範囲で適宜増減し、1日2回投与する。
7. 用法及び用量に関連する注意
腎機能障害患者に投与する場合は、次の表に示すクレアチニンクリアランス値を参考として投与量及び投与間隔を調節すること。低用量から開始し、忍容性が確認され、効果不十分な場合は増量すること。[9.2、9.8.1、16.6.1、17.1.6参照]
| 腎機能障害の程度(CLcr:mL/min) | ||||
| 軽度(90>CLcr≧60) | 中等度(60>CLcr≧30) | 重度(血液透析患者を含む)(30>CLcr) | ||
| 1日投与量 | 10〜30mg | 5〜15mg | 2.5〜7.5mg | |
| 初期用量 | 1回5mg 1日2回 | 1回2.5mg 1日2回 | 1回2.5mg 1日1回 | |
| 有効用量 | 最低用量 | 1回10mg 1日2回 | 1回5mg 1日2回 | 1回5mg 1日1回 |
| 推奨用量 | 1回15mg 1日2回 | 1回7.5mg 1日2回 | 1回7.5mg 1日1回 | |
8. 重要な基本的注意
8.1 めまい、傾眠、意識消失等が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。[11.1.1参照]
8.2 体重増加を来すことがあるので、肥満に注意し、肥満の徴候があらわれた場合は、食事療法、運動療法等の適切な処置を行うこと。特に、投与量の増加又は長期投与に伴い体重増加が認められることがあるため、定期的に体重計測を実施すること。
8.3 本剤による神経障害性疼痛の治療は原因療法ではなく対症療法であることから、疼痛の原因となる疾患の診断及び治療を併せて行い、本剤を漫然と投与しないこと。
8.4 本剤の急激な投与中止により、不眠症、悪心、下痢、食欲減退等の離脱症状があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。
8.5 弱視、視覚異常、霧視、複視等の眼障害があらわれることがあるので、診察時に、眼障害について問診を行うなど注意すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎盤通過性が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
ミロガバリンは主として腎からの糸球体ろ過及び尿細管分泌により排泄される。ミロガバリンの分泌に関わるトランスポーターは、有機アニオントランスポーター(OAT)1、OAT3、有機カチオントランスポーター(OCT)2、H+/有機カチオンアンチポーター(MATE)1及びMATE2-Kである。また、UDPグルクロン酸転移酵素(UGT)による代謝も受ける。
薬物代謝酵素用語
有機アニオントランスポーター(OAT)1
薬物代謝酵素用語
有機アニオントランスポーター(OAT)3
薬物代謝酵素用語
有機カチオントランスポーター(OCT)2
薬物代謝酵素用語
H+/有機カチオンアンチポーター(MATE)1
薬物代謝酵素用語
H+/有機カチオンアンチポーター(MATE)2-K
薬物代謝酵素用語
UDPグルクロン酸転移酵素(UGT)
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 めまい(頻度不明)、傾眠(頻度不明)、意識消失(0.1%未満)
11.1.2 肝機能障害(頻度不明)
AST、ALT上昇等の肝機能障害があらわれることがある。全身倦怠感や食欲不振等の初期症状を含む異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.3 腎機能障害(頻度不明)
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 精神神経系 | 傾眠、浮動性めまい | 体位性めまい、不眠症、意識消失、頭痛、振戦、感覚鈍麻 | 記憶障害、健忘、構語障害、幻覚、譫妄、味覚障害、味覚不全、頭部不快感、ジスキネジア、ミオクローヌス |
| 眼 | 霧視 | 複視、視力障害、視力低下 | |
| 血液 | 好酸球数増加 | ||
| 循環器 | 起立性低血圧、高血圧 | 動悸、ほてり、血圧低下 | |
| 消化器 | 便秘、腹部膨満、口内乾燥、胃炎、嘔吐、食欲亢進、食欲減退、上腹部痛、胃食道逆流性疾患 | 下痢、腹部不快感 | |
| 肝臓 | 肝酵素上昇 | ||
| 泌尿器 | 尿失禁、頻尿、排尿困難、尿閉 | ||
| 皮膚 | 発疹 | 蕁麻疹、紅斑、そう痒症 | |
| その他 | 浮腫 | 体重増加、歩行障害、異常感、回転性めまい、口渇、顔面浮腫、転倒、糖尿病(HbA1c上昇、血糖値上昇)、倦怠感、血中CK上昇、眼瞼浮腫、筋力低下、離脱症候群 | 無力症、疼痛 |
13. 過量投与
13.1 症状
線維筋痛症患者を対象とした海外臨床試験注)において、1日60mgまでの過量投与例が報告されている。過量投与時にみられた症状は、多幸気分、構語障害、頭痛、嚥下障害、関節炎、関節腫脹、無力症であった。
13.2 処置
本剤は血液透析により15.3%が除去される。[16.6.1参照]
注)本剤の効能又は効果は神経障害性疼痛である。
14. 適用上の注意
14.1 薬剤交付時の注意
<製剤共通>
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<OD錠>
14.1.2 OD錠は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.1.3 OD錠は寝たままの状態では、水なしで服用させないこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 日本を含むアジアで実施した国際共同プラセボ対照試験において、自殺関連有害事象が本剤投与群1,378例中5例(0.36%:自殺既遂1例、自殺念慮4例)、プラセボ群869例中4例(0.46%:自殺念慮4例)に認められた。
15.1.2 日本を含むアジアで実施した国際共同プラセボ対照試験において、死亡例が本剤投与群1,378例中3例(0.22%)で報告され、プラセボ群869例では報告はなかった。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)ミロガバリン錠
健康成人にミロガバリンとして3、5、10及び30mg(各投与量6例)を単回経口投与したとき、投与後1時間でCmaxに達し、t1/2は2.96〜3.37時間であった。Cmax及びAUCinfは投与量に比例して増加した1)2)(外国人データ)。
単回経口投与時の血漿中ミロガバリン濃度推移
| 投与量 | 例数 | Cmax(ng/mL) | Tmax(hr)注1) | AUCinf(ng・hr/mL) | t1/2(hr) |
| 3mg | 6 | 48.6±8.47 | 1.00(0.50〜1.00) | 184.2±21.75 | 3.31±0.37 |
| 5mg | 6 | 78.3±18.0 | 1.00(0.50〜2.00) | 276.2±26.96 | 2.96±0.17 |
| 10mg | 6 | 205±64.0 | 1.00(1.00〜1.50) | 614.1±84.02 | 3.32±0.75 |
| 30mg | 6 | 433±67.9 | 1.00(1.00〜1.50) | 1,682±233.4 | 3.37±0.26 |
(2)ミロガバリンOD錠
健康成人男性36例にミロガバリンOD錠15mg1錠(水なしで服用又は水で服用)又はミロガバリン錠15mg1錠(水で服用)を、クロスオーバー法で空腹時単回経口投与して薬物動態パラメータを比較した。Cmax及びAUClastの幾何最小二乗平均値の比の両側90%信頼区間は、いずれも0.80〜1.25の範囲内であり、両製剤の生物学的同等性が確認された3)。ミロガバリンOD錠2.5mg、OD錠5mg及びOD錠10mgは「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、標準製剤をミロガバリンOD錠15mgとしたとき、溶出挙動は同等と判定され、生物学的に同等とみなされた。
| 投与量 | 例数 | Cmax(ng/mL) | Tmax(hr)注2) | AUClast(ng・hr/mL) | t1/2(hr) |
| OD錠15mg (水なしで服用) | 36 | 282±69.4 | 1.00(0.50〜3.00) | 906±123 | 3.11±0.680 |
| 錠15mg (水で服用) | 36 | 282±63.2 | 1.00(0.50〜3.00) | 887±128 | 2.96±0.626 |
| 投与量 | 例数 | Cmax(ng/mL) | Tmax(hr)注3) | AUClast(ng・hr/mL) | t1/2(hr) |
| OD錠15mg (水で服用) | 36 | 285±71.0 | 1.00(0.50〜3.00) | 932±163 | 3.14±0.666 |
| 錠15mg (水で服用) | 36 | 283±70.0 | 1.00(0.50〜3.00) | 898±140 | 3.06±0.705 |
16.1.2 反復投与
健康成人にミロガバリンとして1回10及び15mg(各投与量6例)を1日2回7日間反復経口投与したとき、投与3日目までに定常状態に達し、投与7日目のt1/2は2.43及び2.83時間であった。投与7日目のCmax及びAUCtauは、投与量に比例して増加した4)5)。
反復経口投与時の血漿中ミロガバリン濃度推移(投与7日目)
| 投与量 | 例数 | Cmax(ng/mL) | Tmax(hr)注4) | AUCtau(ng・hr/mL) | t1/2(hr) |
| 1回10mg (1日2回) | 6 | 210±39.4 | 1.50(0.50〜2.00) | 601.0±63.68 | 2.43±0.54 |
| 1回15mg (1日2回) | 6 | 381±88.0 | 0.53(0.50〜1.53) | 1,057±142.2 | 2.83±0.70 |
16.2 吸収
16.2.1 食事の影響
健康成人30例にミロガバリンとして15mgを単回経口投与したときのCmaxは空腹時及び食後でそれぞれ230及び188ng/mL、Tmaxは1.00及び1.50時間、AUClastはそれぞれ884及び833ng・hr/mLであった。食後投与でCmaxは約18%低下し、Tmaxは0.5時間延長したが、AUCinfの低下は約6%であった6)(外国人データ)。
16.3 分布
16.3.1 分布容積
16.3.2 血球移行率
14C標識体を用いた実験で、ミロガバリンは赤血球に移行し、ヒトの血漿中濃度に対する全血中濃度の比は0.85〜0.87であった7)(in vitro)。
16.3.3 血漿蛋白結合率
14C標識体を用いた実験で、ヒト血漿蛋白結合率は血漿中濃度0.1〜10μg/mLにおいて超遠心法で23.4〜25.5%であった7)(in vitro)。
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
正常腎機能者及び腎機能障害患者30例にミロガバリンとして5mgを単回経口投与したとき、CLcrの低下に伴いAUClastの増加が認められた。血液透析を要する末期腎不全患者では、4時間の血液透析により投与したミロガバリンの15.3%が血液透析液中に回収された10)11)。[7.、9.2、13.2参照]
| 腎機能障害の程度 (CLcr:mL/min) | 例数 | Cmax(ng/mL) | Tmax(hr)注5) | AUClast(ng・hr/mL) | CLr(L/hr) |
| CLcr≧90 | 4 | 71.2±25.6 | 1.25(0.98〜2.00) | 321±52.5 | 10.9±1.52 |
| 90>CLcr≧60 (軽度) | 6 | 81.4±29.0 | 1.74(0.97〜4.00) | 422±85.1 | 7.83±1.61 |
| 60>CLcr≧30 (中等度) | 9 | 76.9±13.3 | 1.95(1.03〜5.00) | 655±144 | 4.48±1.87 |
| 30>CLcr (重度) | 5 | 118±25.8 | 2.00(1.47〜5.00) | 1,350±259 | 1.92±0.463 |
| 末期腎不全 透析注6) | 6 | 101±32.9 | 4.01(1.92〜5.00) | 1,990±916 | − |
16.6.2 肝機能障害患者
軽度及び中等度の肝機能障害患者16例にミロガバリンとして15mgを単回経口投与したときのCmaxは、健康成人と比較してそれぞれ1.0倍及び0.8倍であり、AUCinfはそれぞれ0.9倍及び1.1倍であった12)(外国人データ)。
16.6.3 高齢者
16.7 薬物相互作用
16.7.1 相互作用
ミロガバリンは主要なヒトCYP分子種を阻害あるいは誘導せず、薬物トランスポーター(OAT1、OAT3、OCT1、OCT2、OATP1B1、OATP1B3、MATE1及びMATE2-K)を阻害しなかった。また、P糖蛋白(P-gp)及び乳がん耐性蛋白(BCRP)を阻害しなかった。ミロガバリンは腎分泌され、OAT1、OAT3、OCT2、MATE1及びMATE2-Kの基質であることが示唆された。また、ミロガバリンはUGTによる代謝も受けた(in vitro)。
(3)ミロガバリンとエタノール又はロラゼパムを併用したとき、ミロガバリン及びこれらの薬剤の薬物動態に併用投与による明らかな影響は認められなかった。ミロガバリンとこれらの薬剤の併用投与時において、単独投与したときと比べて、注意力及び平衡機能の低下作用を認めた15)(外国人データ)。[10.2参照]
(4)ミロガバリンとトラマドールを併用したとき、ミロガバリン及びトラマドールの薬物動態に併用投与による明らかな影響は認められなかった15)(外国人データ)。
注)本剤の承認用量はミロガバリンとして初期用量1回5mg 1日2回、有効用量1回10mg又は1回15mg 1日2回である。
注)
AUCinf:無限大時間までの血漿中濃度−時間曲線下面積
AUClast:定量可能な最終時点までの血漿中濃度−時間曲線下面積
AUCtau:投与間隔ごとの血漿中濃度−時間曲線下面積
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 第III相国際共同臨床試験
日本を含むアジアにおいて、糖尿病性末梢神経障害性疼痛患者824例(日本人597例)を対象に、ミロガバリン15mg(5mg/日、10mg/日をそれぞれ1週間投与後、15mg/日を12週間投与:計14週間投与)、20mg(10mg/日を1週間投与後、20mg/日を13週間投与:計14週間投与)、30mg(10mg/日、20mg/日をそれぞれ1週間投与後、30mg/日を12週間投与:計14週間投与)注)、もしくはプラセボを14週間投与する二重盲検比較試験を実施した。
14週時の疼痛スコアにおいて、ミロガバリン30mg/日群でプラセボ群と比較して統計学的に有意な改善が認められた16)17)。
14週時の疼痛スコアにおいて、ミロガバリン30mg/日群でプラセボ群と比較して統計学的に有意な改善が認められた16)17)。
| 投与群 | 週 | 評価例数 | 疼痛スコア注1)、注2) | 14週時のベースラインからの変化量注3)、注4) | プラセボとの差[95%信頼区間]注3) | p値注5) |
| プラセボ群 | ベースライン | 330 | 5.59±1.012 | −1.31±0.095 | − | − |
| 14週 | 310 | 4.22±1.820 | ||||
| 20mg/日群 | ベースライン | 165 | 5.57±0.899 | −1.47±0.135 | −0.15[−0.48,0.17] | 0.3494 |
| 14週 | 151 | 4.14±1.685 | ||||
| 30mg/日群 | ベースライン | 165 | 5.55±0.967 | −1.81±0.136 | −0.50[−0.82,−0.17] | 0.0027 |
| 14週 | 142 | 3.73±1.845 |
副作用発現頻度は、20mg/日群で18.8%(31/165例)、30mg/日群で36.4%(60/165例)であった。主な副作用は、20mg/日群で傾眠9.7%(16/165例)、浮動性めまい7.9%(13/165例)、末梢性浮腫1.8%(3/165例)及び体重増加1.8%(3/165例)、30mg/日群で傾眠14.5%(24/165例)、浮動性めまい9.1%(15/165例)、末梢性浮腫5.5%(9/165例)及び体重増加5.5%(9/165例)であった。
17.1.2 第III相国際共同臨床試験
日本を含むアジアにおいて、帯状疱疹後神経痛患者763例(日本人611例)を対象に、ミロガバリン15mg(5mg/日、10mg/日をそれぞれ1週間投与後、15mg/日を12週間投与:計14週間投与)、20mg(10mg/日を1週間投与後、20mg/日を13週間投与:計14週間投与)、30mg(10mg/日、20mg/日をそれぞれ1週間投与後、30mg/日を12週間投与:計14週間投与)注)、もしくはプラセボを14週間投与する二重盲検比較試験を実施した。
14週時の疼痛スコアにおいて、ミロガバリン20mg/日群、30mg/日群でプラセボ群と比較して統計学的に有意な改善が認められた18)19)。
14週時の疼痛スコアにおいて、ミロガバリン20mg/日群、30mg/日群でプラセボ群と比較して統計学的に有意な改善が認められた18)19)。
| 投与群 | 週 | 評価例数 | 疼痛スコア注6)、注7) | 14週時のベースラインからの変化量注8)、注9) | プラセボとの差[95%信頼区間]注8) | p値注10) |
| プラセボ群 | ベースライン | 303 | 5.75±1.130 | −1.20±0.099 | − | − |
| 14週 | 263 | 4.40±2.115 | ||||
| 20mg/日群 | ベースライン | 153 | 5.70±1.015 | −1.68±0.141 | −0.47[−0.81,−0.14] | 0.0058 |
| 14週 | 129 | 3.99±1.839 | ||||
| 30mg/日群 | ベースライン | 155 | 5.65±1.025 | −1.97±0.137 | −0.77[−1.10,−0.44] | <0.0001 |
| 14週 | 139 | 3.71±1.797 |
副作用発現頻度は、20mg/日群で35.3%(54/153例)、30mg/日群で44.5%(69/155例)であった。主な副作用は、20mg/日群で傾眠17.0%(26/153例)、浮動性めまい8.5%(13/153例)及び体重増加4.6%(7/153例)、30mg/日群で傾眠22.6%(35/155例)、浮動性めまい14.2%(22/155例)及び浮腫7.1%(11/155例)であった。
17.1.3 第III相国際共同臨床試験(長期投与試験)
日本を含むアジアで実施した糖尿病性末梢神経障害性疼痛患者214例(日本人165例)又は帯状疱疹後神経痛患者237例(日本人187例)を対象とした52週間(漸増期4週間、用量調整期48週間)投与の非盲検長期投与試験における痛みの強度の平均値は次の表のとおりであった20)21)22)23)。
| 評価時点 | 糖尿病性末梢神経障害性疼痛 | 帯状疱疹後神経痛 | ||
| 評価例数 | 痛みの強度(mm)注11) | 評価例数 | 痛みの強度(mm)注11) | |
| 投与前 | 214 | 42.1±20.41 | 237 | 43.5±21.38 |
| 12週 | 200 | 35.7±20.30 | 219 | 34.7±21.80 |
| 24週 | 186 | 34.4±20.89 | 203 | 32.7±21.81 |
| 52週 | 169 | 31.1±20.70 | 184 | 28.6±22.16 |
副作用発現頻度は、糖尿病性末梢神経障害性疼痛患者で27.6%(59/214例)、帯状疱疹後神経痛患者で39.7%(94/237例)であった。主な副作用は、糖尿病性末梢神経障害性疼痛患者で傾眠7.9%(17/214例)、浮動性めまい6.1%(13/214例)及び末梢性浮腫4.7%(10/214例)、帯状疱疹後神経痛患者で傾眠13.5%(32/237例)、浮動性めまい10.1%(24/237例)及び体重増加7.2%(17/237例)であった。
17.1.4 第III相国際共同臨床試験
日本を含むアジアにおいて、中枢性神経障害性疼痛(脊髄損傷後神経痛)患者299例(日本人242例)を対象に、ミロガバリン(スクリーニング時のCLcrが60mL/min以上の被験者には10mg/日、20mg/日をそれぞれ1週間投与後、安全性に応じて30mg/日又は20mg/日を12週間投与、スクリーニング時のCLcrが30mL/min以上60mL/min未満の被験者には5mg/日、10mg/日をそれぞれ1週間投与後、安全性に応じて15mg/日又は10mg/日を12週間投与:計14週間投与)、もしくはプラセボを14週間投与する二重盲検比較試験を実施した。
14週時の疼痛スコアにおいて、ミロガバリン群でプラセボ群と比較して統計学的に有意な改善が認められた24)。
14週時の疼痛スコアにおいて、ミロガバリン群でプラセボ群と比較して統計学的に有意な改善が認められた24)。
| 投与群 | 週 | 評価例数 | 疼痛スコア注12)、注13) | 14週時のベースラインからの変化量注14)、注15) | プラセボとの差[95%信頼区間]注14) | p値 |
| プラセボ群 | ベースライン | 149 | 6.09±1.270 | −0.52±0.132 | − | − |
| 14週 | 135 | 5.50±1.932 | ||||
| ミロガバリン群 | ベースライン | 150 | 6.04±1.309 | −1.23±0.132 | −0.71[−1.08,−0.34] | 0.0001 |
| 14週 | 132 | 4.70±1.863 |
ミロガバリン群での副作用発現頻度は、41.1%(62/151例)であった。主な副作用は、傾眠25.8%(39/151例)、浮動性めまい6.6%(10/151例)及び体重増加4.6%(7/151例)であった。
17.1.5 第III相国際共同臨床試験(長期投与試験)
日本を含むアジアで実施した中枢性神経障害性疼痛(脊髄損傷後神経痛、脳卒中後疼痛、又はパーキンソン病による中枢性神経障害性疼痛)患者210例(日本人200例)を対象とした52週間(漸増期4週間、用量調整期47週間、漸減期1週間)投与の非盲検長期投与試験における痛みの強度の平均値は次の表のとおりであった25)。
| 評価時点 | 評価例数 | 痛みの強度(mm)注16) |
| 投与前 | 210 | 61.4±20.42 |
| 12週 | 182 | 49.3±24.16 |
| 24週 | 170 | 46.3±25.30 |
| 48週 | 167 | 45.2±25.74 |
| 52週 | 170 | 49.7±25.79 |
副作用発現頻度は、40.0%(84/210例)であった。主な副作用は、傾眠15.2%(32/210例)、末梢性浮腫9.0%(19/210例)及び浮動性めまい7.1%(15/210例)であった。
17.1.6 第III相国内臨床試験
糖尿病性末梢神経障害性疼痛患者又は帯状疱疹後神経痛患者で腎機能低下を有する患者を対象とした14週間(漸増期2週間及び用量維持期12週間)投与の第III相非盲検試験において、14週時の疼痛スコアは次の表のとおりであった26)27)。[7.、9.2参照]
| 投与群 (CLcr:mL/min) | 週 | 評価例数 | 疼痛スコア注17)、注18) | 14週時のベースラインからの変化量注19) |
| 中等度腎機能障害患者群 (59≧CLcr≧30)注20) | ベースライン | 30 | 5.65±1.049 | −1.79±0.335 |
| 14週 | 26 | 3.81±1.834 | ||
| 重度腎機能障害患者群 (29≧CLcr≧15)注21) | ベースライン | 5 | 5.97±1.275 | −2.07±0.871 |
| 14週 | 4 | 3.83±3.082 |
副作用発現頻度は、中等度腎機能障害患者群で30.0%(9/30例)であり、重度腎機能障害患者群で0%(0/5例)であった。主な副作用は、中等度腎機能障害患者群で傾眠13.3%(4/30例)、浮動性めまい6.7%(2/30例)であった。
注)本剤の承認用量はミロガバリンとして初期用量1回5mg 1日2回、有効用量1回10mg又は1回15mg 1日2回である。
18. 薬効薬理
18.1 作用機序
18.2 鎮痛作用
19. 有効成分に関する理化学的知見
19.1. ミロガバリンベシル酸塩
20. 取扱い上の注意
<錠>
20.1 開封後、吸湿により錠剤表面に微細なくぼみがみられることがある。
<OD錠>
20.2 アルミピロー開封後は湿気を避けて保存すること。
20.3 2.5mg錠、10mg錠は錠剤表面に使用色素による黄色の斑点がみられることがある。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<タリージェ錠2.5mg>
(PTP:乾燥剤入り) 100錠(10錠×10)
<タリージェ錠5mg>
(PTP:乾燥剤入り) 100錠(10錠×10)
<タリージェ錠10mg>
(PTP:乾燥剤入り) 100錠(10錠×10)
<タリージェ錠15mg>
(PTP:乾燥剤入り) 100錠(10錠×10)
<タリージェOD錠2.5mg>
(PTP:乾燥剤入り) 100錠(10錠×10)
<タリージェOD錠5mg>
(PTP:乾燥剤入り) 100錠(10錠×10)
<タリージェOD錠10mg>
(PTP:乾燥剤入り) 100錠(10錠×10)
<タリージェOD錠15mg>
(PTP:乾燥剤入り) 100錠(10錠×10)
23. 主要文献
- Brown K,et.al., Pharmacol Res Perspect., 6 (5), e00418, (2018) »PubMed
- 社内資料:単回投与時の薬物動態パラメータ(2019年1月8日承認、CTD2.7.6.3)
- 社内資料:ミロガバリンOD錠とミロガバリン錠の生物学的同等性試験
- Jansen M,et al., Clin Pharmacol Drug Dev., 7 (6), 661-669, (2018) »PubMed
- 社内資料:反復投与時の薬物動態パラメータ(2019年1月8日承認、CTD2.7.6.5)
- 社内資料:空腹時又は食後投与時の薬物動態パラメータ(2019年1月8日承認、CTD2.7.6.2)
- 社内資料:14C標識体を用いた非臨床薬物動態試験(2019年1月8日承認、CTD2.6.4.4)
- Yamamura N,et al., Xenobiotica., 51 (5), 549-563, (2021) »PubMed
- 社内資料:14C標識体を用いたヒトマスバランス試験(2019年1月8日承認、CTD2.7.6.4)
- Kato M,et al., J Clin Pharmacol., 58 (1), 57-63, (2018) »PubMed
- 社内資料:日本人腎機能障害患者における薬物動態(2019年1月8日承認、CTD2.7.2.3.2.5)
- Duchin K,et al., Clin Drug Investig., 38 (11), 1001-1009, (2018) »PubMed
- 社内資料:健康高齢者を対象とした反復投与試験(2019年1月8日承認、CTD2.7.6.7)
- Tachibana M,et al., Br J Clin Pharmacol., 84 (10), 2317-2324, (2018) »PubMed
- Jansen M,et al., Clin Pharmacol Drug Dev., 7 (6), 597-612, (2018) »PubMed
- Baba M,et al., J Diabetes Investig., 10 (5), 1299-1306, (2019) »PubMed
- 社内資料:糖尿病性末梢神経障害性疼痛患者を対象とした第III相国際共同臨床試験(プラセボ対照試験)(2019年1月8日承認、CTD2.7.6.21)
- Kato J,et al., Pain., 160 (5), 1175-1185, (2019) »PubMed
- 社内資料:帯状疱疹後神経痛患者を対象とした第III相国際共同臨床試験(プラセボ対照試験)(2019年1月8日承認、CTD2.7.6.22)
- Baba M,et al., J Diabetes Investig., 11 (3), 693-698, (2020) »PubMed
- 社内資料:糖尿病性末梢神経障害性疼痛患者を対象とした第III相国際共同臨床試験(長期投与試験)(2019年1月8日承認、CTD2.7.6.24)
- Kato J,et al., Medicine(baltimore)., 99 (36), e21976, (2020) »PubMed
- 社内資料:帯状疱疹後神経痛患者を対象とした第III相国際共同臨床試験(長期投与試験)(2019年1月8日承認、CTD2.7.6.25)
- 社内資料:中枢性神経障害性疼痛患者を対象とした第III相国際共同臨床試験(プラセボ対照試験)(2022年3月28日承認、CTD2.7.6.1)
- 社内資料:中枢性神経障害性疼痛患者を対象とした第III相国際共同臨床試験(長期投与試験)(2022年3月28日承認、CTD2.7.6.2)
- Baba M,et al., J Pain Res., 13, 1811-1821, (2020) »PubMed
- 社内資料:腎機能低下を有する糖尿病性末梢神経障害性疼痛又は帯状疱疹後神経痛患者を対象とした第III相国内臨床試験(2019年1月8日承認、CTD2.7.6.26)
- Domon Y,et al., J Pharmacol Exp Ther., 365 (3), 573-582, (2018) »PubMed
- Kitano Y,et al., Pharmazie., 74 (3), 147-149, (2019) »PubMed
- Oyama M,et al., J Pharmacol Sci., 146, 33-39, (2021) »PubMed
- Domon Y,et al., Pharmazie., 73 (11), 659-661, (2018) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1