医薬品情報
| 総称名 | リバゼブ |
|---|---|
| 一般名 | ピタバスタチンカルシウム水和物 エゼチミブ |
| 欧文一般名 | Pitavastatin Calcium Hydrate Ezetimibe |
| 製剤名 | ピタバスタチンカルシウム水和物・エゼチミブ配合錠 |
| 薬効分類名 | HMG-CoA還元酵素阻害剤 小腸コレステロールトランスポーター阻害剤配合剤 |
| 薬効分類番号 | 2189 |
| ATCコード | C10BA13 |
| KEGG DRUG |
D12438
ピタバスタチンカルシウム・エゼチミブ
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リバゼブ配合錠LD | LIVAZEBE Combination Tablets LD | 興和 | 2189103F1029 | 51円/錠 | 処方箋医薬品注) |
| リバゼブ配合錠HD | LIVAZEBE Combination Tablets HD | 興和 | 2189103F2025 | 65.7円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤を高コレステロール血症、家族性高コレステロール血症の治療の第一選択薬として用いないこと。
5.2 適用の前に十分な検査を実施し、高コレステロール血症、家族性高コレステロール血症であることを確認した上で本剤の適用を考慮すること。
5.3 ホモ接合体性家族性高コレステロール血症については、LDLアフェレーシス等の非薬物療法の補助として、あるいはそれらの治療法が実施不能な場合に本剤の適用を考慮すること。
6. 用法及び用量
通常、成人には1日1回1錠(ピタバスタチンカルシウム/エゼチミブとして2mg/10mg又は4mg/10mg)を食後に経口投与する。
7. 用法及び用量に関連する注意
7.1 以下のピタバスタチンカルシウム水和物とエゼチミブの成人に対する用法及び用量を踏まえ、患者毎に本剤の適用を考慮すること。
ピタバスタチンカルシウム水和物
通常、成人にはピタバスタチンカルシウムとして1〜2mgを1日1回経口投与する。
なお、年齢、症状により適宜増減し、LDL-コレステロール値の低下が不十分な場合には増量できるが、最大投与量は1日4mgまでとする。
なお、年齢、症状により適宜増減し、LDL-コレステロール値の低下が不十分な場合には増量できるが、最大投与量は1日4mgまでとする。
エゼチミブ
通常、成人にはエゼチミブとして1回10mgを1日1回食後経口投与する。なお、年齢、症状により適宜減量する。
7.2 原則として、ピタバスタチンカルシウムとして2mg及びエゼチミブ10mgを併用している場合、あるいはピタバスタチンカルシウムとして2mgを使用し効果不十分な場合に、本剤LD(ピタバスタチンカルシウム/エゼチミブとして2mg/10mg)の適用を検討すること。
7.3 原則として、ピタバスタチンカルシウムとして4mg及びエゼチミブ10mgを併用している場合、あるいはピタバスタチンカルシウムとして4mg又はピタバスタチンカルシウム/エゼチミブとして2mg/10mgを使用し効果不十分な場合に、本剤HD(ピタバスタチンカルシウム/エゼチミブとして4mg/10mg)の適用を検討すること。
7.5 ピタバスタチンは投与量(全身曝露量)の増加に伴い、横紋筋融解症関連有害事象が発現するので、ピタバスタチンカルシウムとして4mgに増量する場合には、CK上昇、ミオグロビン尿、筋肉痛及び脱力感等の横紋筋融解症前駆症状に注意すること。ピタバスタチンの成人海外臨床試験においてピタバスタチンカルシウムとして8mg以上の投与は横紋筋融解症及び関連有害事象の発現により中止されている。[11.1.2参照]
8. 重要な基本的注意
8.1 本剤は、ピタバスタチンカルシウムとして2mgあるいは4mgとエゼチミブ10mgとの配合剤であり、ピタバスタチンとエゼチミブ双方の副作用が発現するおそれがあるため、適切に本剤の使用を検討すること。[11.参照]
8.2 あらかじめ高コレステロール血症治療の基本である食事療法を行い、更に運動療法や、高血圧・喫煙等の虚血性心疾患のリスクファクターの軽減等も十分考慮すること。
8.3 ピタバスタチンの単剤投与から本剤への切り替え時に肝機能検査を行うこと。また、ピタバスタチンの投与開始時より12週までの間に1回以上、それ以降は定期的(半年に1回等)に肝機能検査を行うこと。[9.3.2、9.3.3、11.1.5参照]
8.4 投与中は血中脂質値を定期的に検査し、治療に対する反応が認められない場合には投与を中止すること。
8.5 甲状腺機能低下症、閉塞性胆のう胆道疾患、慢性腎不全、膵炎等の疾患の合併、血清脂質に悪影響を与える薬剤の服用等の二次的要因により高脂血症を呈している場合は、原疾患の治療、薬剤の切り替え等を可能な限り実施した上で本剤での治療を考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 糖尿病患者
エゼチミブでは空腹時血糖の上昇が報告されている。
9.1.2 横紋筋融解症があらわれやすいとの報告がある以下の患者
・甲状腺機能低下症のある患者
・遺伝性の筋疾患(筋ジストロフィー等)又はその家族歴のある患者
・薬剤性の筋障害の既往歴のある患者
・アルコール中毒のある患者
ピタバスタチンでは横紋筋融解症があらわれやすいとの報告がある。[11.1.2参照]
9.1.3 重症筋無力症又はその既往歴のある患者
重症筋無力症(眼筋型、全身型)が悪化又は再発することがある。[11.1.8参照]
9.2 腎機能障害患者
9.2.1 腎機能に関する臨床検査値に異常が認められる患者
9.2.2 腎障害又はその既往歴のある患者
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害又は胆道閉塞のある患者
9.3.2 中等度の肝機能障害のある患者
9.3.3 肝障害又はその既往歴のある患者(9.3.1、9.3.2に該当する患者を除く)
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。ピタバスタチンでは、動物実験(ラット)での周産期及び授乳期投与試験(1mg/kg以上)において分娩前又は分娩後の一時期に母動物の死亡が認められている。また、ウサギでの器官形成期投与試験(0.3mg/kg以上)において母動物の死亡が認められている。ラットに他のHMG-CoA還元酵素阻害剤を大量投与した場合に胎児の骨格奇形が報告されている。更にヒトでは、他のHMG-CoA還元酵素阻害剤で、妊娠3ヵ月までの間に服用したとき、胎児に先天性奇形があらわれたとの報告がある。[2.4参照]
9.6 授乳婦
投与しないこと。ピタバスタチンでは、動物実験(ラット)で乳汁中への移行が報告されている。エゼチミブでは、ヒト母乳中への移行の有無は不明であるが、妊娠後から授乳期まで投与したラットで乳児への移行が認められている。[2.4参照]
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
副作用が発現した場合には減量するなど注意すること。一般に生理機能が低下している。横紋筋融解症があらわれやすいとの報告がある。[11.1.2参照]
10. 相互作用
相互作用序文
ピタバスタチンは肝チトクロームP450(CYP)によりほとんど代謝されない(CYP2C9でわずかに代謝される)。
薬物代謝酵素用語
CYP
薬物代謝酵素用語
CYP2C9
10.1 併用禁忌
10.2 併用注意
| フィブラート系薬剤 ベザフィブラート等 [9.2.1、11.1.2、16.7.1参照] | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | フィブラート系薬剤、ピタバスタチン、エゼチミブでは、横紋筋融解症が報告されている。 危険因子:腎機能に関する臨床検査値に異常が認められる患者 |
| ニコチン酸 [9.2.2、11.1.2参照] | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | 危険因子:腎障害がある場合 |
| 陰イオン交換樹脂 コレスチミド コレスチラミン等 [16.7.2参照] | ピタバスタチンの血中濃度が低下する可能性がある。また、エゼチミブとの併用により、エゼチミブの血中濃度の低下がみられたとの報告がある。本剤は陰イオン交換樹脂の投与前2時間あるいは投与後4時間以上の間隔をあけて投与すること。 | 同時投与によりピタバスタチンの吸収が低下する可能性がある。また、エゼチミブが陰イオン交換樹脂と結合し、吸収が遅延あるいは減少する可能性がある。 |
| エリスロマイシン [11.1.2、16.7.1参照] | 急激な腎機能悪化を伴う横紋筋融解症があらわれるおそれがある。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | 左記薬剤によりピタバスタチンの肝臓への取り込みが阻害されるためと考えられる。 |
| リファンピシン [16.7.1参照] | ピタバスタチンとの併用によりピタバスタチンのCmaxが2.0倍、AUCが1.3倍に上昇したとの報告がある。 | 左記薬剤によりピタバスタチンの肝臓への取り込みが阻害されるためと考えられる。 |
| クマリン系抗凝固剤 ワルファリン等 | エゼチミブとの併用によりプロトロンビン時間国際標準比(INR)の上昇がみられたとの報告がある。併用する場合には適宜INR検査を行うこと。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。[8.1参照]
11.1.1 過敏症(頻度不明)
エゼチミブでは、アナフィラキシー、血管神経性浮腫、発疹を含む過敏症状があらわれたとの報告がある。
11.1.2 横紋筋融解症(頻度不明)
11.1.3 ミオパチー(頻度不明)
広範な筋肉痛、筋肉圧痛や著明なCKの上昇があらわれた場合には投与を中止すること。
11.1.4 免疫介在性壊死性ミオパチー(頻度不明)
HMG-CoA還元酵素阻害剤では、近位筋脱力、CK高値、炎症を伴わない筋線維の壊死、抗HMG-CoA還元酵素(HMGCR)抗体陽性等を特徴とする免疫介在性壊死性ミオパチーがあらわれることがある。また、投与中止後も持続する例が報告されているので、患者の状態を十分に観察すること。なお、免疫抑制剤投与により改善がみられたとの報告例がある。
11.1.5 肝機能障害、黄疸(いずれも頻度不明)
11.1.6 血小板減少(頻度不明)
血液検査等の観察を十分に行うこと。
11.1.7 間質性肺炎(頻度不明)
長期投与であっても、発熱、咳嗽、呼吸困難、胸部X線異常等が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 重症筋無力症(頻度不明)
重症筋無力症(眼筋型、全身型)が発症又は悪化することがある。[9.1.3参照]
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 皮膚 | 発疹、そう痒、じん麻疹、紅斑、多形紅斑、血管性浮腫、脱毛、皮膚疼痛 | ||
| 消化器 | 口渇、口内乾燥、口内炎、舌炎、嘔気・悪心、嘔吐、逆流性食道炎、胃炎、胃不快感、消化不良、腹痛、腹部膨満感、アミラーゼ上昇、膵炎、胆石症、胆のう炎、鼓腸放屁、便秘、下痢、食欲不振 | ||
| 肝臓 | ALT上昇 | γ-GTP上昇 | AST上昇、LDH上昇、ビリルビン上昇、コリンエステラーゼ上昇、AL-P上昇、肝炎 |
| 腎臓 | 蛋白尿 | 頻尿、BUN上昇、血清クレアチニン上昇 | |
| 循環器 | 期外収縮、動悸、血圧上昇、胸痛、ほてり | ||
| 筋肉注) | CK上昇 | 筋肉痛、背部痛、四肢痛、脱力感、筋痙縮、筋力低下、ミオグロビン上昇 | |
| 精神神経系 | 頭痛・頭重感、しびれ、めまい、こわばり感、眠気、不眠、坐骨神経痛、抑うつ、錯感覚 | ||
| 血液 | 白血球増多 | 貧血、血小板減少、顆粒球減少、白血球減少、好酸球増多、グロブリン上昇、クームス試験の陽性化 | |
| 内分泌 | テストステロン低下、アルドステロン低下、アルドステロン上昇、ACTH上昇、コルチゾール上昇、TSH上昇 | ||
| その他 | 倦怠感、疲労感、無力症、関節痛、浮腫、霧視、眼のちらつき、耳閉感、味覚異常、帯状疱疹、単純疱疹、結膜炎、咳嗽、疼痛、抗核抗体の陽性化、尿潜血、着色尿、尿酸値上昇、血清K上昇、血清P上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
複合型高脂血症患者を対象にした海外の多施設二重盲検プラセボ対照試験(625例が12週間以内、576例が1年以内の投与)において、血清トランスアミナーゼの上昇(基準値上限の3倍を超える連続した上昇)の発現率(曝露期間で調整)は、フェノフィブラート単独群で4.5%、エゼチミブとフェノフィブラート併用群で2.7%であった。同様に、胆のう摘出術の発現率は、フェノフィブラート単独群で0.6%、エゼチミブとフェノフィブラート併用群で1.7%であった。CK上昇(基準値上限の10倍を超える)については、本試験のいずれの群でも認められなかった。また、エゼチミブとフェノフィブラート併用における一般的な有害事象は腹痛であった。なお、本試験は、頻繁に発現しない有害事象を群間で比較するようにはデザインされていない1)2)。[8.6参照]
15.2 非臨床試験に基づく情報
15.2.1 ピタバスタチンでは、イヌの経口投与試験(3mg/kg/日以上を3ヵ月間、1mg/kg/日以上を12ヵ月間)で白内障の発現が認められている。なお、他の動物(ラット、サル)においては認められていない。
15.2.2 エゼチミブでは、イヌで1ヵ月間投与(0.03mg/kg/日以上)により、胆のう胆汁コレステロール濃度が約2〜3倍増加したとの報告がある。しかし、300mg/kg/日をイヌに12ヵ月間投与しても胆石あるいは肝・胆管系への影響はみられなかった。マウスに2週間投与(5mg/kg/日)しても胆のう胆汁コレステロール濃度への影響はみられなかった。[8.6参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性55例に本剤HD1錠又はピタバスタチンカルシウム錠4mg及びエゼチミブ錠10mg各1錠(単剤併用)を、クロスオーバー法により空腹時に単回経口投与したときの薬物動態パラメータ及び血漿中濃度推移を示す3)。
| \ | AUC0-t(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| ピタバスタチン (未変化体) | 本剤HD | 140.745±48.794(55) | 64.215±29.056(55) | 1.000[0.50,2.00](55) | 12.227±2.886(38) |
| 単剤併用 | 143.664±49.904(54) | 66.353±31.811(54) | 1.000[0.50,2.00](54) | 14.061±4.225(45) | |
| エゼチミブ (非抱合体) | 本剤HD | 89.9823±41.0849(55) | 5.7285±3.4775(55) | 4.000[0.50,12.00](55) | 16.950±6.663(38) |
| 単剤併用 | 94.7826±43.6560(54) | 6.6849±4.6191(54) | 5.000[0.50,24.00](54) | 20.199±12.952(41) | |
図 ピタバスタチン(未変化体)の空腹時単回経口投与時の血漿中濃度推移(本剤HD又は単剤併用)
図 エゼチミブ(非抱合体)の空腹時単回経口投与時の血漿中濃度推移(本剤HD又は単剤併用)
16.2 吸収
16.2.1 食事の影響
16.3 分布
16.3.1 蛋白結合率
16.4 代謝
16.4.1 ピタバスタチン
(1)代謝経路
(2)血中及び尿中代謝物
(3)代謝酵素
ピタバスタチンは、ヒト肝ミクロゾームを用いた代謝試験においてわずかに代謝され、主にCYP2C9により8位水酸化体を生じた4)(in vitro)。
16.4.2 エゼチミブ
エゼチミブは、主に小腸における初回通過効果によって主要活性代謝物であるエゼチミブ(グルクロン酸抱合体)に代謝される。
外国人健康成人男性8例に14C-エゼチミブカプセル20mg注)を単回経口投与したとき、血漿中の総放射能に占めるエゼチミブ(非抱合体)及びエゼチミブ(グルクロン酸抱合体)の割合(AUC比)はそれぞれ11%及び82%(合計93%)であった10)。
外国人健康成人男性8例に14C-エゼチミブカプセル20mg注)を単回経口投与したとき、血漿中の総放射能に占めるエゼチミブ(非抱合体)及びエゼチミブ(グルクロン酸抱合体)の割合(AUC比)はそれぞれ11%及び82%(合計93%)であった10)。
注)本剤の承認用量は1日1回1錠(ピタバスタチンカルシウム/エゼチミブとして2mg/10mg又は4mg/10mg)である。
16.5 排泄
16.5.1 ピタバスタチン
(1)排泄経路
ピタバスタチンの主たる排泄経路は糞中排泄であった7)(ラット、イヌ)。
(2)排泄率
健康成人男性各6例にピタバスタチンカルシウムとして2mg、4mgを単回経口投与したとき、尿中排泄率は低く、未変化体で0.6%未満、ラクトン体で1.3%未満、合計でも2%未満であった。
また、健康成人男性6例にピタバスタチンカルシウムとして4mgを1日1回7日間反復経口投与したとき、未変化体及びラクトン体の尿中排泄量は初回から7回目の投与まで増加を示さず、投与終了とともに速やかに減少した11)。
また、健康成人男性6例にピタバスタチンカルシウムとして4mgを1日1回7日間反復経口投与したとき、未変化体及びラクトン体の尿中排泄量は初回から7回目の投与まで増加を示さず、投与終了とともに速やかに減少した11)。
16.5.2 エゼチミブ
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
(1)ピタバスタチン
腎機能障害(血清クレアチニン基準値上限の1.5倍以上3倍以下)を有する高コレステロール血症患者6例と腎機能が正常な高コレステロール血症患者6例にピタバスタチンカルシウムとして2mgを1日1回7日間反復経口投与したとき、腎機能障害患者の投与7日目の血漿中濃度は腎機能正常者に比しCmaxで1.7倍、AUCで1.9倍を示した14)。
(2)エゼチミブ
重度の外国人慢性腎機能障害患者8例(クレアチニンクリアランス10〜29mL/min)にエゼチミブ10mgを単回経口投与したとき、外国人健康成人9例(クレアチニンクリアランス>80mL/min)と比較して血漿中エゼチミブ(非抱合体)及びエゼチミブ(グルクロン酸抱合体)濃度のAUCにそれぞれ約1.6倍及び1.5倍の上昇が認められた13)。
16.6.2 肝機能障害患者
(1)ピタバスタチン
(2)エゼチミブ
16.6.3 高齢者
16.7 薬物相互作用
16.7.1 ピタバスタチン
(1)シクロスポリン
(2)エリスロマイシン
(3)リファンピシン
(4)フィブラート系薬剤
(5)In vitro試験
16.7.2 エゼチミブ
(1)チトクロームP450酵素系への影響
外国人健康成人12例にエゼチミブ20mg注)と各種チトクロームP450酵素系の基質となる代表的な指標薬を併用したとき、CYP1A2、CYP2C8/9、CYP2D6及びCYP3A4活性、並びにN-アセチルトランスフェラーゼ活性への影響は認められなかった5)。
注)本剤の承認用量は1日1回1錠(ピタバスタチンカルシウム/エゼチミブとして2mg/10mg又は4mg/10mg)である。
(2)コレスチラミンによる影響
(3)フェノフィブラートとの相互作用
外国人成人8例(LDL-コレステロール値≧130mg/dL)にフェノフィブラート200mg(1日1回)とエゼチミブ10mg(1日1回)を14日間併用投与したとき、血漿中総エゼチミブ(非抱合体+グルクロン酸抱合体)濃度のCmax及びAUCがそれぞれ約64%及び48%上昇したが、臨床上意味のあるものではなかった。フェノフィブラートの薬物動態に及ぼすエゼチミブの影響は認められなかった5)。
(4)シクロスポリン製剤との相互作用
クレアチニンクリアランスが50mL/minを超え、かつ、一定用量(75〜150mg1日2回)のシクロスポリン製剤を服用中の外国人腎移植患者8例にエゼチミブ10mgを単回投与したとき、血漿中総エゼチミブ(非抱合体+グルクロン酸抱合体)濃度のAUCは健康成人と比較して約3.4倍高値を示した23)。別の試験で、重度の腎機能障害のため腎移植を行い、シクロスポリン製剤による治療を受けていた外国人患者1例にエゼチミブ10mgを単回経口投与したとき、血漿中総エゼチミブ濃度のAUCが健康成人と比較して約12倍に上昇した報告がある5)。外国人健康成人12例にエゼチミブ20mg注)を1日1回8日間反復経口投与し、7日目にシクロスポリン製剤100mgを単回経口投与したとき、血液中シクロスポリン濃度のCmax及びAUCはシクロスポリン単独投与と比較してそれぞれ10%及び15%上昇した24)。[2.3、10.1参照]
注)本剤の承認用量は1日1回1錠(ピタバスタチンカルシウム/エゼチミブとして2mg/10mg又は4mg/10mg)である。
(5)その他の薬物動態学的相互作用
薬物相互作用に関する臨床試験(外国人)で、エゼチミブ10mgとワルファリン、ジゴキシン、経口避妊薬(エチニルエストラジオール、レボノルゲストレル)を併用したとき、これらの薬物動態への影響は認められなかった。シメチジンとエゼチミブ10mgを併用したとき、エゼチミブのバイオアベイラビリティに対する影響は認められなかった。制酸剤(水酸化アルミニウムと水酸化マグネシウムを含有)とエゼチミブ10mgを併用したとき、血漿中総エゼチミブ(非抱合体+グルクロン酸抱合体)濃度のAUCへの影響は認められなかったが、Cmaxは55.9ng/mLから37.1ng/mLに低下した5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相検証試験
高コレステロール血症患者を対象に、本剤LD又は本剤HD若しくはピタバスタチンカルシウム2mg又は4mgを1日1回1錠食後に12週間投与した実薬対照二重盲検比較試験の結果は以下のとおりであった。
治療期12週時のLDL-コレステロール(Friedewald式)のベースラインからの変化率について、MMRM(Mixed model for repeated measurements)により、本剤HD群のピタバスタチンカルシウム4mg群に対する優越性、本剤LD群のピタバスタチンカルシウム2mg群に対する優越性及び本剤HD群の変化率が本剤LD群の変化率を下回ることが検証された。
治療期12週時のLDL-コレステロール(Friedewald式)のベースラインからの変化率について、MMRM(Mixed model for repeated measurements)により、本剤HD群のピタバスタチンカルシウム4mg群に対する優越性、本剤LD群のピタバスタチンカルシウム2mg群に対する優越性及び本剤HD群の変化率が本剤LD群の変化率を下回ることが検証された。
| \ | PS2mg | PS4mg | 本剤LD | 本剤HD | ||
| ベースライン(mg/dL) | 166.18±19.11 (n=72) | 162.14±21.94 (n=72) | 168.92±19.88 (n=72) | 167.01±19.51 (n=72) | ||
| 最終評価12週時(mg/dL) | 100.24±15.61 | 88.73±16.92 | 81.48±21.18 | 69.99±14.16 | ||
| 変化率(%) | −39.481 (−41.752,−37.209) | −45.152 (−47.439,−42.866) | −51.423 (−53.700,−49.146) | −57.843 (−60.130,−55.556) | ||
| 群間差 | vs.PS2mg | − | − | −11.942**a (−15.159,−8.726) | − | |
| vs.PS4mg | − | − | − | −12.690**a (−15.932,−9.449) | ||
| vs.本剤LD | − | − | − | −6.420 (−9.642,−3.197) | ||
本剤投与による副作用発現割合は、本剤LD群5.6%(4/72例)、本剤HD群6.9%(5/72例)であった。主な副作用はALT増加(本剤LD群1.4%(1/72例)、本剤HD群5.6%(4/72例))等であった25)。
17.1.2 国内第III相長期投与試験
ピタバスタチンカルシウム2mg又は4mg投与で効果不十分の高コレステロール血症患者を対象に、それぞれ本剤LD又は本剤HDを1日1回1錠食後に52週間投与したとき、最終評価時のLDL-コレステロール(Friedewald式)のベースラインからの変化率(LOCF(Last observation carried forward)法を適用)は、本剤投与例全体−30.28±14.30%(平均値±標準偏差(以下同様)、n=109)、本剤LD群−29.50±11.71%(n=62)、本剤HD群−31.32±17.20%(n=47)であった。また、治療期4週から52週までの各時点では、本剤投与例全体−26.68±15.52%〜−30.38±14.48%、本剤LD群−25.55±14.45%〜−30.62±11.13%、本剤HD群−26.93±15.16%〜−31.33±17.39%であり、その効果は持続した。
副作用発現割合は、本剤投与例全体で0.9%(1/109例)であり、その内訳は本剤HD群で血中クレアチンホスホキナーゼ増加2.1%(1/47例)であった26)。
副作用発現割合は、本剤投与例全体で0.9%(1/109例)であり、その内訳は本剤HD群で血中クレアチンホスホキナーゼ増加2.1%(1/47例)であった26)。
18. 薬効薬理
18.1 作用機序
18.1.1 ピタバスタチン
ピタバスタチンは、コレステロール生合成の律速酵素であるHMG-CoA還元酵素を拮抗的に阻害することにより、肝臓でのコレステロール合成を阻害する。その結果、肝臓のLDL受容体の発現が促進し、血液中から肝臓へのLDLの取り込み促進により血漿総コレステロールが低下する。また、肝臓での持続的なコレステロール合成阻害により血液中へのVLDL分泌が減少し、血漿トリグリセリドが低下する。
(1)LDL受容体発現促進作用
(2)VLDL分泌低下作用
ピタバスタチンの経口投与により、VLDL-トリグリセリドの分泌は有意に低下した29)(モルモット)。
18.1.2 エゼチミブ
エゼチミブは食事性及び胆汁性コレステロールの吸収を阻害する。エゼチミブの作用部位は小腸であり、ハムスター等を用いた動物試験において、小腸でのコレステロールの吸収を選択的に阻害し、その結果、肝臓のコレステロール含量を低下させ、血中コレステロールを低下させた30)31)32)33)。エゼチミブは小腸壁細胞に存在する蛋白質(Niemann-Pick C1 Like 1)を介してコレステロール及び植物ステロールの吸収を阻害する34)35)36)。このことから、エゼチミブの作用機序は他の高脂血症治療剤(HMG-CoA還元酵素阻害剤、陰イオン交換樹脂、フィブラート系薬剤、植物ステロール)とは異なる。18例の高コレステロール血症患者を対象とした海外の臨床薬理試験において、エゼチミブは2週間の投与により小腸でのコレステロール吸収をプラセボ群に比し54%阻害した37)。
エゼチミブは小腸でのコレステロール吸収阻害により肝臓のコレステロール含量を低下させるが、肝臓でのコレステロールの生合成が代償的に亢進する。コレステロールの生合成を抑制するHMG-CoA還元酵素阻害剤との併用により、血中コレステロールが相補的に低下することが、イヌを用いた試験32)及び海外の高コレステロール血症患者を対象とした試験38)39)40)において示された。
また、ラット等において、エゼチミブはコレステロールの吸収を選択的に阻害するが、脂肪酸、胆汁酸、プロゲステロン、エチニルエストラジオール並びに脂溶性ビタミンA及びDの吸収には影響しなかった30)。
エゼチミブは小腸でのコレステロール吸収阻害により肝臓のコレステロール含量を低下させるが、肝臓でのコレステロールの生合成が代償的に亢進する。コレステロールの生合成を抑制するHMG-CoA還元酵素阻害剤との併用により、血中コレステロールが相補的に低下することが、イヌを用いた試験32)及び海外の高コレステロール血症患者を対象とした試験38)39)40)において示された。
また、ラット等において、エゼチミブはコレステロールの吸収を選択的に阻害するが、脂肪酸、胆汁酸、プロゲステロン、エチニルエストラジオール並びに脂溶性ビタミンA及びDの吸収には影響しなかった30)。
18.2 薬理作用
18.2.1 ピタバスタチン
(1)HMG-CoA還元酵素阻害作用
ピタバスタチンは、ラット肝ミクロゾームを用いた試験において、HMG-CoA還元酵素を拮抗的に阻害し、阻害作用のIC50値は6.8nMであった41)(in vitro)。
(2)コレステロール合成阻害作用
(3)血漿脂質低下作用
(4)脂質蓄積及び内膜肥厚抑制作用
18.2.2 エゼチミブ
19. 有効成分に関する理化学的知見
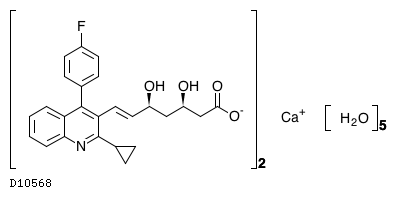
19.1. ピタバスタチンカルシウム水和物
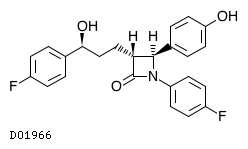
19.2. エゼチミブ
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて遮光して保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<リバゼブ配合錠LD>
PTP
100錠(10錠×10)、500錠(10錠×50)
<リバゼブ配合錠HD>
PTP
100錠(10錠×10)、500錠(10錠×50)
23. 主要文献
- Farnier M,et al., Eur Heart J., 26, 897-905, (2005) »PubMed
- McKenney JM,et al., J Am Coll Cardiol., 47, 1584-7, (2006) »PubMed
- 興和(株)社内資料:生物学的同等性及び食事の影響の検討試験(2022年9月26日承認、CTD2.7.6.1)
- Fujino H,et al., 薬物動態, 14, 415-24, (1999) »DOI
- Kosoglou T,et al., Clin Pharmacokinet., 44, 467-94, (2005) »PubMed
- Kojima J,et al., Biol Pharm Bull., 22, 142-50, (1999) »PubMed
- Fujino H,et al., 薬物動態, 14, 79-91, (1999) »DOI
- 中谷矩章他, 臨床医薬, 17, 957-70, (2001)
- 興和(株)社内資料:健康成人男性における代謝物(リバロ錠1mg・2mg:2003年7月17日承認、申請資料概要ヘ.3.(1))
- Patrick JE,et al., Drug Metab Dispos., 30, 430-7, (2002) »PubMed
- 中谷矩章他, 臨床医薬, 17, 741-66, (2001)
- 深瀬広幸他, 臨床医薬, 23, 397-406, (2007)
- 藤原豊博, 薬理と治療, 36, 81-116, (2008)
- 再審査報告書:製造販売後臨床試験(リバロ錠1mg・2mg:2013年12月19日再審査結果公表)
- 興和(株)社内資料:肝硬変患者における薬物動態(リバロ錠1mg・2mg:2003年7月17日承認、申請資料概要へ.4.(3))
- 森治樹他, 臨床医薬, 19, 371-9, (2003)
- 三上洋他, 臨床医薬, 23, 427-35, (2007)
- 蓮沼智子他, 臨床医薬, 19, 381-9, (2003)
- 興和(株)社内資料:エリスロマイシンとの相互作用
- 興和(株)社内資料:リファンピシンとの相互作用
- Mathew P., 診療と新薬, 40, 779-85, (2003)
- Hirano M,et al., Drug Metab Dispos., 34, 1229-36, (2006) »PubMed
- Bergman AJ,et al., J Clin Pharmacol., 46, 328-36, (2006) »PubMed
- Bergman AJ,et al., J Clin Pharmacol., 46, 321-7, (2006) »PubMed
- 興和(株)社内資料:第III相検証試験(2022年9月26日承認、CTD2.7.6.3)
- 興和(株)社内資料:第III相52週長期投与試験(2022年9月26日承認、CTD2.7.6.4)
- Morikawa S,et al., J Atheroscler Thromb., 7, 138-44, (2000) »PubMed
- 中川俊次他, 薬理と治療, 29, 51-7, (2001)
- Suzuki H,et al., Atherosclerosis., 146, 259-70, (1999) »PubMed
- van Heek M,et al., Br J Pharmacol., 134, 409-17, (2001) »PubMed
- Davis HR Jr,et al., Arterioscler Thromb Vasc Biol., 21, 2032-8, (2001) »PubMed
- Davis HR Jr,et al., Metabolism., 50, 1234-41, (2001) »PubMed
- van Heek M,et al., Eur J Pharmacol., 415, 79-84, (2001) »PubMed
- Altmann SW,et al., Science., 303, 1201-4, (2004) »PubMed
- Davis HR Jr,et al., J Biol Chem., 279, 33586-92, (2004) »PubMed
- Garcia-Calvo M,et al., Proc Natl Acad Sci USA., 102, 8132-7, (2005) »PubMed
- Sudhop T,et al., Circulation., 106, 1943-8, (2002) »PubMed
- Davidson MH,et al., J Am Coll Cardiol., 40, 2125-34, (2002) »PubMed
- Melani L,et al., Eur Heart J., 24, 717-28, (2003) »PubMed
- Ballantyne CM,et al., Circulation., 107, 2409-15, (2003) »PubMed
- Aoki T,et al., Arzneimittelforschung., 47, 904-9, (1997) »PubMed
- 興和(株)社内資料:脂質蓄積抑制作用(リバロ錠1mg・2mg:2003年7月17日承認、申請資料概要ホ.1.(3))
- Kitahara M,et al., Jpn J Pharmacol., 77, 117-28, (1998) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
興和株式会社
くすり相談センター 受付時間 9:00〜17:00(土・日・祝日・弊社休日を除く)
〒103-8433
東京都中央区日本橋本町三丁目4-14
電話:0120-508-514
03-3279-7587
03-3279-7587
製品情報問い合わせ先
興和株式会社
くすり相談センター 受付時間 9:00〜17:00(土・日・祝日・弊社休日を除く)
〒103-8433
東京都中央区日本橋本町三丁目4-14
電話:0120-508-514
03-3279-7587
03-3279-7587
26. 製造販売業者等
26.1 製造販売元
興和株式会社
東京都中央区日本橋本町三丁目4-14