医薬品情報
| 総称名 | ゾコーバ |
|---|---|
| 一般名 | エンシトレルビル フマル酸 |
| 欧文一般名 | Ensitrelvir Fumaric Acid |
| 製剤名 | エンシトレルビル フマル酸錠 |
| 薬効分類名 | 抗SARS-CoV-2剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AE16 |
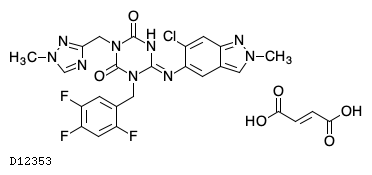
| KEGG DRUG |
D12353
エンシトレルビルフマル酸
|
| KEGG DGROUP |
DG03174
抗SARS-CoV-2薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第23版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ゾコーバ錠125mg | XOCOVA Tablets | 塩野義製薬 | 6250052F1023 | 7090円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 次の薬剤を投与中の患者:ピモジド、キニジン硫酸塩水和物、ベプリジル塩酸塩水和物、チカグレロル、エプレレノン、エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、エルゴメトリンマレイン酸塩、メチルエルゴメトリンマレイン酸塩、ジヒドロエルゴタミンメシル酸塩、シンバスタチン、トリアゾラム、アナモレリン塩酸塩、イバブラジン塩酸塩、ベネトクラクス〔再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期〕、イブルチニブ、ブロナンセリン、ルラシドン塩酸塩、アゼルニジピン、アゼルニジピン・オルメサルタン メドキソミル、スボレキサント、ダリドレキサント塩酸塩、ボルノレキサント水和物、タダラフィル(アドシルカ)、マシテンタン・タダラフィル、バルデナフィル塩酸塩水和物、ロミタピドメシル酸塩、リファブチン、フィネレノン、ボクロスポリン、ロナファルニブ、マバカムテン、リバーロキサバン、リオシグアト、アパルタミド、カルバマゼピン、エンザルタミド、ミトタン、フェニトイン、ホスフェニトインナトリウム水和物、リファンピシン、セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤の投与対象については最新のガイドラインを参考にすること。
5.2 「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤の使用の必要性を慎重に検討すること。[17.1.1参照]
5.3 重症度の高いSARS-CoV-2による感染症患者に対する有効性は検討されていない。
6. 用法及び用量
通常、12歳以上の小児及び成人にはエンシトレルビルとして1日目は375mgを、2日目から5日目は125mgを1日1回経口投与する。
7. 用法及び用量に関連する注意
SARS-CoV-2による感染症の症状が発現してから72時間以内に投与を開始すること。臨床試験において、症状発現から72時間経過後に投与を開始した患者における有効性を裏付けるデータは得られていない。[17.1.1参照]
8. 重要な基本的注意
8.1 本剤は併用薬剤と相互作用を起こすことがあるため、服薬中のすべての薬剤を確認すること。また、本剤で治療中に新たに他の薬剤を服用する場合、事前に相談するよう患者に指導すること。[10.、16.7.1、16.7.2参照]
8.2 妊娠する可能性のある女性への投与に際しては、本剤投与の必要性を十分に検討すること。また、投与が必要な場合には、次の注意事項に留意すること。[2.4、9.4、9.5参照]
8.2.1 本剤投与開始前に十分な問診により患者が妊娠していないこと及び妊娠している可能性がないことを確認すること。
8.2.2 次の事項について、本剤投与開始前に患者に説明すること。
・妊娠中に本剤を服用した場合、胎児に影響を及ぼす可能性があること。
・本剤服用中に妊娠が判明した又は疑われる場合は、直ちに服用を中止すること。
・本剤服用中及び最終服用後2週間における妊娠が判明した又は疑われる場合は、速やかに医師、薬剤師等に相談すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 肝機能障害のある患者で、コルヒチンを投与中の患者
9.3.2 重度の肝機能障害患者(コルヒチンを投与中の患者を除く)
重度の肝機能障害患者を対象とした臨床試験は実施していない。
9.4 生殖能を有する者
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。
ラットにおいて、乳汁への移行が認められるとともに、母動物に毒性が認められた用量(臨床曝露量の6.6倍相当)で出生児の生後4日生存率低下及び発育遅延が認められている。
ラットにおいて、乳汁への移行が認められるとともに、母動物に毒性が認められた用量(臨床曝露量の6.6倍相当)で出生児の生後4日生存率低下及び発育遅延が認められている。
9.7 小児等
12歳未満の小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP3A
薬物代謝酵素用語
P-gp
薬物代謝酵素用語
BCRP
薬物代謝酵素用語
OATP1B1
薬物代謝酵素用語
OATP1B3
10.1 併用禁忌
| ピモジド (オーラップ) キニジン硫酸塩水和物 ベプリジル塩酸塩水和物 (ベプリコール) [2.2参照] | これらの薬剤の血中濃度上昇により、QT延長が発現するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| チカグレロル (ブリリンタ) [2.2参照] | チカグレロルの血中濃度上昇により、血小板凝集抑制作用が増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| エプレレノン (セララ) [2.2参照] | エプレレノンの血中濃度上昇により、血清カリウム値の上昇を誘発するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン (クリアミン) エルゴメトリンマレイン酸塩 メチルエルゴメトリンマレイン酸塩 (パルタンM) ジヒドロエルゴタミンメシル酸塩 [2.2参照] | これらの薬剤の血中濃度上昇により、血管攣縮等の重篤な副作用が発現するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| シンバスタチン (リポバス) [2.2参照] | シンバスタチンの血中濃度上昇により、横紋筋融解症が発現するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| トリアゾラム (ハルシオン) [2.2参照] | トリアゾラムの血中濃度上昇により、過度の鎮静や呼吸抑制が発現するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| アナモレリン塩酸塩 (エドルミズ) [2.2参照] | アナモレリン塩酸塩の血中濃度が上昇し、副作用の発現が増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| イバブラジン塩酸塩 (コララン) [2.2参照] | 過度の徐脈があらわれることがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ベネトクラクス〔再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期〕 (ベネクレクスタ) [2.2参照] | ベネトクラクスの血中濃度が上昇し、腫瘍崩壊症候群の発現が増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| イブルチニブ (イムブルビカ) [2.2参照] | イブルチニブの血中濃度が上昇し、副作用の発現が増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ブロナンセリン (ロナセン) ルラシドン塩酸塩 (ラツーダ) [2.2参照] | これらの薬剤の血中濃度上昇により、作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| アゼルニジピン (カルブロック) アゼルニジピン・オルメサルタン メドキソミル (レザルタス配合錠) [2.2参照] | アゼルニジピンの作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| スボレキサント (ベルソムラ) ダリドレキサント塩酸塩 (クービビック) ボルノレキサント水和物 (ボルズィ) [2.2参照] | これらの薬剤の血中濃度上昇により、作用を著しく増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| タダラフィル (アドシルカ) マシテンタン・タダラフィル (ユバンシ配合錠) バルデナフィル塩酸塩水和物 (レビトラ) [2.2参照] | これらの薬剤の血中濃度を上昇させるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ロミタピドメシル酸塩 (ジャクスタピッド) [2.2参照] | ロミタピドメシル酸塩の血中濃度を著しく上昇させるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| リファブチン (ミコブティン) [2.2参照] | リファブチンの血中濃度上昇により、作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| フィネレノン (ケレンディア) [2.2参照] | フィネレノンの血中濃度を著しく上昇させるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ボクロスポリン (ルプキネス) [2.2参照] | ボクロスポリンの血中濃度上昇により、作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ロナファルニブ (ゾキンヴィ) [2.2参照] | ロナファルニブの血中濃度上昇により、副作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| マバカムテン (カムザイオス) [2.2参照] | マバカムテンの副作用が増強され、収縮機能障害による心不全のリスクが高まるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| リバーロキサバン (イグザレルト) [2.2参照] | リバーロキサバンの血中濃度上昇により、抗凝固作用が増強し、出血の危険性が増大するおそれがある。 | 本剤のCYP3A及びP-gp阻害作用により、リバーロキサバンのクリアランスが低下することが考えられる。 |
| リオシグアト (アデムパス) [2.2参照] | リオシグアトの血中濃度を上昇させるおそれがある。ケトコナゾールとの併用によりリオシグアトの血中濃度が上昇し、クリアランスが低下したとの報告がある。 | 本剤のCYP3A及びP-gp/BCRP阻害作用により、リオシグアトのクリアランスが低下することが考えられる。 |
| アパルタミド (アーリーダ) カルバマゼピン (テグレトール) [2.2参照] | 本剤の血中濃度が減少し、作用が減弱するおそれがある。また、これらの薬剤の血中濃度が上昇し、副作用が発現しやすくなるおそれがある。 | これらの薬剤のCYP3A誘導作用により、本剤の代謝が促進される。また、本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝を阻害する。 |
| エンザルタミド (イクスタンジ) ミトタン (オペプリム) フェニトイン (ヒダントール、アレビアチン) ホスフェニトインナトリウム水和物 (ホストイン) リファンピシン (リファジン) セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 [2.2参照] | 本剤の血中濃度が減少し、作用が減弱するおそれがある。 | これらの薬剤のCYP3A誘導作用により、本剤の代謝が促進される。 |
10.2 併用注意
| 副腎皮質ステロイド剤 ブデソニド、シクレソニド、デキサメタゾン、メチルプレドニゾロン [16.7.2参照] | これらの薬剤の血中濃度を上昇させ、これらの薬剤の副作用が発現しやすくなるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| オピオイド系鎮痛剤 フェンタニル、フェンタニルクエン酸塩、オキシコドン塩酸塩水和物、メサドン塩酸塩 | これらの薬剤の血中濃度を上昇させ、これらの薬剤の副作用が発現しやすくなるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| 免疫抑制剤 シクロスポリン、タクロリムス水和物 | これらの薬剤の血中濃度を上昇させ、これらの薬剤の副作用が発現しやすくなるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| 抗悪性腫瘍剤 ドセタキセル、エベロリムス、テムシロリムス、ゲフィチニブ、ダサチニブ水和物、エルロチニブ塩酸塩、ラパチニブトシル酸塩水和物、ボルテゾミブ、イマチニブメシル酸塩、スニチニブリンゴ酸塩、ボスチニブ水和物、カバジタキセル、クリゾチニブ、シロリムス、パノビノスタット乳酸塩、ポナチニブ塩酸塩、ルキソリチニブリン酸塩、アキシチニブ、ニロチニブ塩酸塩水和物 | これらの薬剤の血中濃度を上昇させ、これらの薬剤の副作用が発現しやすくなるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| マラビロク アプレピタント ロペラミド塩酸塩 サルメテロールキシナホ酸塩 シナカルセト塩酸塩 アルプラゾラム ゾピクロン トルテロジン酒石酸塩 オキシブチニン塩酸塩 グアンファシン塩酸塩 ジエノゲスト | これらの薬剤の血中濃度を上昇させ、これらの薬剤の副作用が発現しやすくなるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| アトルバスタチンカルシウム水和物 | アトルバスタチンの血中濃度を上昇させ、横紋筋融解症やミオパチーが発現するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ミダゾラム [16.7.2参照] | ミダゾラムの血中濃度上昇により、過度の鎮静や呼吸抑制が発現するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ブプレノルフィン塩酸塩 エレトリプタン臭化水素酸塩 | これらの薬剤の血中濃度を上昇させ、これらの薬剤の作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| カルシウム拮抗剤 ニフェジピン、フェロジピン、ベラパミル塩酸塩 | これらの薬剤の血中濃度を上昇させ、これらの薬剤の作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| 抗精神病剤 ハロペリドール、アリピプラゾール、クエチアピンフマル酸塩 | これらの薬剤の血中濃度を上昇させ、これらの薬剤の作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| 抗凝固剤 ワルファリンカリウム、アピキサバン | これらの薬剤の血中濃度を上昇させ、これらの薬剤の作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ジソピラミド シロスタゾール | これらの薬剤の血中濃度を上昇させ、これらの薬剤の作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ビンカアルカロイド系抗悪性腫瘍剤 ビンクリスチン硫酸塩、ビンブラスチン硫酸塩 | これらの薬剤の血中濃度を上昇させ、筋神経系の副作用を増強するおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ベネトクラクス〔再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の維持投与期、急性骨髄性白血病〕 | ベネトクラクスの副作用が増強されるおそれがあるので、ベネトクラクスを減量するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| PDE5阻害剤 シルデナフィルクエン酸塩、タダラフィル(シアリス、ザルティア) | これらの薬剤の血中濃度を上昇させるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| コルヒチン [2.3、9.2.1、9.3.1参照] | コルヒチンの血中濃度上昇により、作用が増強されるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| イトラコナゾール | イトラコナゾールの血中濃度を上昇させるおそれがある。 | 本剤のCYP3Aに対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| イリノテカン塩酸塩水和物 | イリノテカンの活性代謝物の血中濃度を上昇させるおそれがある。 | 本剤のCYP3A阻害作用により、イリノテカンの活性代謝物の無毒化が阻害されると考えられる。 |
| ダビガトランエテキシラートメタンスルホン酸塩 | ダビガトランの血中濃度を上昇させ、抗凝固作用を増強するおそれがある。 | 本剤のP-gp阻害作用により、これらの薬剤の排出を遅延させる。 |
| ジゴキシン [16.7.2参照] | 本剤との併用により、ジゴキシンの血中濃度の上昇が認められており、ジゴキシンの作用を増強するおそれがある。 | 本剤のP-gp阻害作用により、これらの薬剤の排出を遅延させる。 |
| ロスバスタチンカルシウム [16.7.2参照] | 本剤との併用により、ロスバスタチンの血中濃度の上昇が認められている。 | 本剤のBCRP、OATP1B1及びOATP1B3阻害作用により、ロスバスタチンのクリアランスが低下する。 |
| ボセンタン水和物 | 本剤の血中濃度が減少し、作用が減弱するおそれがある。また、ボセンタン水和物の血中濃度が上昇し、副作用が発現しやすくなるおそれがある。 | ボセンタン水和物のCYP3A誘導作用により、本剤の代謝が促進されるおそれがある。また、本剤のCYP3Aに対する阻害作用により、ボセンタン水和物の代謝が阻害される。 |
| 中程度のCYP3A誘導剤 エファビレンツ、エトラビリン、フェノバルビタール、プリミドン等 | 本剤の血中濃度が減少し、作用が減弱するおそれがある。 | これらの薬剤のCYP3A誘導作用により、本剤の代謝が促進されるおそれがある。 |
| メトトレキサート | メトトレキサートの血中濃度を上昇させ、中毒症状(口内炎、汎血球減少)が発現するおそれがある。 | in vitro試験より本剤はOAT3阻害作用を有することが示唆されており、メトトレキサートの尿中排出を遅延させるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | そう痒 | ||
| 消化器 | 悪心、嘔吐、下痢、腹部不快感 | |||
| 精神神経系 | 頭痛 | |||
| 代謝 | 脂質異常症 | |||
| その他 | HDLコレステロール低下(16.6%) | トリグリセリド上昇、ビリルビン上昇、血中コレステロール低下 | 血清鉄上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
カニクイザルに本薬を2又は4週間反復経口投与した毒性試験において、臨床曝露量の8倍相当以上で、肝臓門脈、胆嚢、肺/気管支等に単核細胞主体の炎症性細胞浸潤が認められている1)。
16. 薬物動態
16.1 血中濃度
健康成人女性8例に本剤を5日間空腹時反復経口投与した(エンシトレルビルとして1日目は375mg、2日目から5日目は125mg)ときの血漿中濃度推移を図16-1に、薬物動態パラメータ2)を表16-1に示す。
図16-1 反復投与時の平均血漿中濃度推移(健康成人)
| 投与日 | 例数 | Cmax※1(μg/mL) | Tmax※2(hr) | AUC0-τ※1(μg・hr/mL) | T1/2※1(hr) |
| 1日目 | 8 | 22.3(14.8) | 2.50(1.50,8.00) | 372.9(12.0) | − |
| 5日目 | 7 | 28.1(15.6) | 2.00(1.00,8.00) | 518.3(13.0) | 51.4(19.0) |
16.2 吸収
16.2.1 食事の影響
健康成人14例に本剤(エンシトレルビルとして375mg)を空腹時又は高脂肪・高カロリー食摂取後に単回経口投与注したときの薬物動態パラメータ2)を表16-2に示す。
| 食事条件 | 例数 | Cmax※1(μg/mL) | Tmax※2(hr) | AUC0-inf※1(μg・hr/mL) |
| 空腹時 | 13 | 21.4(23.5) | 2.50(1.50,4.00) | 1236(23.2) |
| 食後※3 | 14 | 20.0(16.4) | 6.00(1.50,16.00) | 1538(15.8) |
16.3 分布
エンシトレルビルのヒト血清蛋白結合率は、97.7〜98.7%であった3)(in vitro)。
16.4 代謝
16.5 排泄
健康成人男性6例に[14C]-エンシトレルビル フマル酸375mg注を空腹時単回投与したとき、投与量の64.8%及び25.8%がそれぞれ糞便中及び尿中に排泄された。未変化のエンシトレルビルの糞便中排泄率は投与量の50.7%、尿中排泄率は投与量の19.0%であり、投与量の18.7%(糞便中に投与量の12.0%、尿中に投与量の6.8%)が代謝物として排泄された4)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
軽度(60≦推算糸球体ろ過量[eGFR]<90mL/min)、中等度(30≦eGFR<60mL/min)、重度(eGFR<30mL/min)の腎機能障害患者各8例に本剤(エンシトレルビルとして375mg)を単回経口投与したとき注の薬物動態の比較を表16-3に示す。軽度、中等度及び重度腎機能障害患者のエンシトレルビルのAUCは、健康成人と比較してそれぞれ1.44倍、1.49倍及び1.60倍であった6)(外国人データ)。[9.2参照]
| 投与群 | 例数 | Cmax※1(μg/mL) | AUC0-inf※1(μg・hr/mL) | 健康成人に対する比※2 | ||
| Cmax | AUC0-inf | |||||
| 健康成人 | 8 | 15.5(34.7) | 996.0(26.0) | − | − | |
| 腎機能障害 | 軽度 | 8 | 20.5(18.9) | 1432(20.8) | 1.32(1.04-1.68) | 1.44(1.17-1.76) |
| 中等度 | 8 | 20.5(12.6) | 1483(26.0) | 1.33(1.06-1.66) | 1.49(1.19-1.86) | |
| 重度 | 8 | 17.2(19.8) | 1596(26.1) | 1.11(0.87-1.42) | 1.60(1.28-2.01) | |
16.6.2 肝機能障害患者
軽度(Child-Pugh分類A)肝機能障害患者9例及び中等度(Child-Pugh分類B)肝機能障害患者8例に本剤(エンシトレルビルとして375mg)を単回経口投与したとき注の薬物動態の比較を表16-4に示す。軽度及び中等度肝機能障害患者のエンシトレルビルのAUCは、健康成人と比較してそれぞれ1.03倍及び0.87倍であった7)(外国人データ)。[9.3参照]
| 投与群 | 例数 | Cmax※1(μg/mL) | AUC0-inf※1(μg・hr/mL) | 健康成人に対する比※2 | ||
| Cmax | AUC0-inf | |||||
| 健康成人 | 8 | 20.5(15.1) | 1150(24.4) | − | − | |
| 肝機能障害 | 軽度 | 9 | 18.2(17.0) | 1180(30.1) | 0.89(0.77-1.02) | 1.03(0.81-1.29) |
| 中等度 | 8 | 15.3(30.4) | 1003(24.6) | 0.74(0.60-0.91) | 0.87(0.71-1.08) | |
16.7 薬物相互作用
16.7.1 In vitro試験
16.7.2 臨床試験
健康成人を対象に薬物相互作用を評価した。併用薬の薬物動態に及ぼすエンシトレルビルの影響及びエンシトレルビルの薬物動態に及ぼす併用薬の影響を表16-5及び表16-6に示す2)9)。[8.1、10.、10.2参照]
| 併用薬 | 用法・用量 | 例数 | 併用薬の単独投与時に対する比※1 | |||
| 本薬 | 併用薬 | 評価日 | Cmax | AUC0-inf | ||
| ミダゾラム (CYP3A基質) | 1日目375mg、2〜5日目125mg (本剤) | 2mg単回 | 本薬投与5日目 | 14 | 2.80(2.38,3.30) | 6.77(6.16,7.44) |
| デキサメタゾン (合成副腎皮質ホルモン製剤) | 1日目750mg、2〜5日目250mg (錠剤)※2、注 | 1mg単回 | 本薬投与5日目 | 14 | 1.47(1.30,1.67) | 3.47(3.23,3.72)※3、※4 |
| 本薬最終投与から5日目 | 14 | 1.24(1.09,1.40) | 2.38(2.23,2.54)※4 | |||
| 本薬最終投与から10日目 | 14 | 1.17(1.04,1.33) | 1.58(1.47,1.70)※3、※4 | |||
| プレドニゾロン (合成副腎皮質ホルモン製剤) | 10mg単回 | 本薬投与5日目 | 14 | 1.11(1.00,1.24) | 1.25(1.22,1.28) | |
| 本薬最終投与から5日目 | 14 | 1.10(0.99,1.22) | 1.12(1.10,1.15) | |||
| 本薬最終投与から10日目 | 14 | 0.99(0.89,1.10) | 1.04(1.01,1.07) | |||
| ジゴキシン (P-gp基質) | 500mg単回 (本剤)注 | 0.25mg単回 | 本薬投与1日目 | 14 | 2.17(1.72,2.73) | 1.31(1.13,1.52)※3、※4 |
| ロスバスタチン (BCRP、OATP1B1及びOATP1B3基質) | 2.5mg単回 | 本薬投与1日目 | 14 | 1.97(1.73,2.25) | 1.65(1.47,1.84) | |
| メトホルミン (OCT1、OCT2、MATE1及びMATE2基質) | 500mg(塩酸塩として)単回 | 本薬投与1日目 | 14 | 1.03(0.91,1.16) | 1.02(0.94,1.11) | |
| 併用薬 | 投与量 | 例数 | 本薬の単独投与時に対する比※1 | ||||
| 併用薬 | 本薬 | 本薬投与 1日目 | 本薬投与 5日目 | ||||
| Cmax | AUC0-τ | Cmax | AUC0-τ | ||||
| イトラコナゾール | 200mg 1日1回※2 | 1日目375mg、2〜5日目125mg (本剤) | 14 | 1.05(0.98,1.14)※4 | 1.10(1.03,1.18)※4 | 1.24(1.18,1.30)※4 | 1.31(1.26,1.38)※4 |
| カルバマゼピン | 300mg 1日2回※3 | 14 | 0.92(0.66,1.28)※5 | 0.79(0.63,0.99)※5 | 0.62(0.55,0.69)※5 | 0.54(0.50,0.59)※5 | |
注)本薬の承認された剤形は125mg錠であり、用法・用量は「通常、12歳以上の小児及び成人にはエンシトレルビルとして1日目は375mgを、2日目から5日目は125mgを1日1回経口投与する」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第II/III相試験[T1221試験]第III相パート
12歳以上70歳未満(18歳未満は体重40kg以上に限る)のSARS-CoV-2による感染症患者を対象に、1日目は本剤375mgを、2日目から5日目は本剤125mgを1日1回経口投与したときの、本剤の有効性及び安全性を検討することを目的としてプラセボ対照無作為化二重盲検並行群間比較試験を実施した。主要評価項目はSARS-CoV-2による感染症の5症状が快復するまでの時間(※1)とした。
(※1)SARS-CoV-2による感染症の5症状〔[1]倦怠感又は疲労感、[2]熱っぽさ又は発熱、[3]鼻水又は鼻づまり、[4]喉の痛み、[5]咳〕の各症状を被験者本人が4段階(0:なし、1:軽度、2:中等度、3:重度)で評価し、快復の定義は5症状のすべてが以下の状態を少なくとも24時間持続した場合とされた。
・SARS-CoV-2による感染症の発症前から存在した既存症状で、ベースライン(投与前検査)時点で悪化していると被験者が判断した症状については、ベースライン時の重症度が重度のものは中等度以下、中等度のものは軽度以下、軽度のものは軽度以下へ重症度が改善又は維持した状態となること。
・SARS-CoV-2による感染症の発症前から存在した既存症状で、ベースライン(投与前検査)時点で悪化していないと被験者が判断した症状については、ベースライン時の重症度が重度のものは重度以下、中等度のものは中等度以下、軽度のものは軽度以下へ重症度が維持又は改善した状態となること。
・上記以外の症状[SARS-CoV-2による感染症の発症前には存在しておらず、ベースライン(投与前検査)時点以降に発現した症状]については、なしの状態となること。
無作為化された1215例(日本人662例)のうち、ベースラインの鼻咽頭ぬぐい検体を用いた定性RT-PCRにより陽性と判断され、さらにCOVID-19の症状発現から無作為化割付までの時間が72時間未満であった690例における、主要評価項目の結果は表17-1及び図17-1のとおりであった10)。
| 本剤群 | プラセボ群 | |
| 例数a) | 336 | 321 |
| 快復数 | 254 | 233 |
| SARS-CoV-2による感染症の5症状が快復するまでの時間(hr)の中央値 | 167.9 | 192.2 |
| p値b) | 0.0407 | / |
| ハザード比[95%信頼区間]c) | 1.14[0.95,1.36] | / |
図17-1 主要評価項目の結果のカプランマイヤー曲線
なお、本試験の主な選択・除外基準は表17-2のとおりであった。[7.参照]
| 選択基準 | 1.12歳以上18歳未満かつ体重40kg以上又は18歳以上70歳未満 2.SARS-CoV-2陽性(無作為化前120時間以内に採取された検体を用いたPCR検査等により確認) 3.SARS-CoV-2による感染症の症状(14症状a)のうち1つ以上)発現が無作為化前120時間以内 4.無作為化時点において、SARS-CoV-2による感染症の症状(12症状)b)のうち、中等度(スコア2)c)以上の症状が1つ以上認められる。ただし、SARS-CoV-2による感染症の発症前から存在した症状である場合は、SARS-CoV-2による感染症により悪化したと被験者が判断した症状に限る 5.治験薬投与開始〜投与終了後少なくとも10日間避妊が可能な者 6.(女性のみ)妊婦ではなく、妊娠している可能性もない者 |
| 除外基準 | 1.SpO2が93%以下(室内気) 2.酸素投与を要する 3.人工呼吸器を要する 4.中等度以上(CTCAE第5.0版Grade 2以上)の肝疾患の現病歴又は慢性病歴を有する 5.中等度以上(CTCAE第5.0版Grade 2以上)の腎疾患の現病歴又は慢性病歴を有する |
副作用発現頻度は、24.5%(148/604例)であり、主な副作用は、高比重リポ蛋白減少18.4%(111/604例)であった10)。
18. 薬効薬理
18.1 作用機序
エンシトレルビルはSARS-CoV-2 3CLプロテアーゼを阻害し、ポリタンパク質の切断を阻止することで、ウイルスの複製を抑制する11)。
18.2 薬理作用
18.2.1 In vitroウイルス増殖抑制効果
エンシトレルビルは細胞培養系を用いた試験において、SARS-CoV-2臨床分離株〔従来株(A系統)、alpha株(B.1.1.7系統)、beta株(B.1.351系統)、gamma株(P.1系統)、delta株(B.1.617.2系統)、theta株(P.3系統)、lambda株(C.37系統)、mu株(B.1.621系統)及びomicron株(BA.1.18、BA.1.1、BA.2、BA.2.12.1、BA.2.75、BA.4.1、BA.4.6、BA.5.2.1、BE.1、BF.7、BF.7.4.1、BQ.1.1、CH.1.1.11、XBB.1、XBB.1.5、XBB.1.9.1、XBB.1.16、XBF及びXE系統)〕に対して抗ウイルス活性を示し、50%有効濃度(EC50値)は、VeroE6/TMPRSS2細胞で0.22〜0.99μmol/L、HEK293T/ACE2-TMPRSS2細胞で0.026〜0.064μmol/Lであった。ヒト気道上皮3次元器官培養モデルを用いた細胞培養系において、SARS-CoV-2臨床分離株〔delta株(B.1.617.2系統)、omicron株(BA.1.18及びBE.1系統)〕に対するEC90は0.0514〜0.195μmol/Lであった12)。
18.2.2 In vivo抗ウイルス作用
SARS-CoV-2臨床分離株を接種した感染マウスにおいて、エンシトレルビルは、ウイルス接種直後からの投与及びウイルス接種24時間後からの投与のいずれの場合でも、肺組織内ウイルス力価を用量依存的に減少させた。また、SARS-CoV-2マウス馴化株を接種したマウス致死モデルにおいて、溶媒群と比較してエンシトレルビル群で生存率の改善、生存期間の延長及び体重減少の抑制が認められた13)。
18.3 耐性
18.3.1 臨床試験
国際共同第II/III相試験(T1221試験)第III相パートにおいて、本剤群345例中、ベースライン前後で塩基配列解析が可能であった被験者204例のうち、19例で本剤投与後にSARS-CoV-2 3CLプロテアーゼ領域にアミノ酸変異が認められた。そのうち、本剤群において2例以上認められたアミノ酸変異はM49L(12例)、M49I(3例)、S144A(2例)であり、M49L又はS144Aを導入した組換えSARS-CoV-2は、エンシトレルビルに対して、それぞれ17倍又は9.2倍の感受性低下を示した14)。
18.3.2 非臨床試験
19. 有効成分に関する理化学的知見
19.1. エンシトレルビル フマル酸
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
7錠[7錠(PTP)×1]
28錠[14錠(PTP)×2]
23. 主要文献
- 社内資料:エンシトレルビルのラット及びサルの反復投与毒性試験(2024/3/5承認、申請資料概要2.6.6.3)
- 社内資料:エンシトレルビルの健康成人対象第I相試験(薬物動態・安全性)(2024/3/5承認、申請資料概要2.7.6.1)
- 社内資料:[14C]-エンシトレルビルのin vitro血清中タンパク結合試験(2024/3/5承認、申請資料概要2.6.4.4.1.1)
- 社内資料:エンシトレルビルのマスバランス試験(2024/3/5承認、申請資料概要2.7.6.2、2.7.2.2.1.2)
- 社内資料:エンシトレルビルの代謝酵素同定試験(2024/3/5承認、申請資料概要2.6.4.5.1.2)
- 社内資料:エンシトレルビルの腎機能障害患者対象薬物動態試験(2024/3/5承認、申請資料概要2.7.6.6)
- 社内資料:エンシトレルビルの肝機能障害患者対象薬物動態試験(2024/3/5承認、申請資料概要2.7.6.5)
- 社内資料:エンシトレルビルの代謝酵素又はトランスポーターを介した薬物相互作用に関する試験(2024/3/5承認、申請資料概要2.6.4.5.4、2.6.4.7)
- 社内資料:エンシトレルビルの薬物相互作用試験(2024/3/5承認、申請資料概要2.7.6.3、2.7.6.7)
- 社内資料:エンシトレルビルのSARS-CoV-2感染者対象第II/III相試験(Phase 3 Part)(2024/3/5承認、申請資料概要2.7.6.4)
- 社内資料:エンシトレルビルのSARS-CoV-2 3CLプロテアーゼ活性に対する阻害試験(2024/3/5承認、申請資料概要2.6.2.2.1.1)
- 社内資料:エンシトレルビルのSARS-CoV-2感染細胞における抗ウイルス活性試験(2024/3/5承認、申請資料概要2.6.2.2.1.2)
- 社内資料:エンシトレルビルのSARS-CoV-2感染マウスモデルにおけるin vivo薬理作用に関する試験(2024/3/5承認、申請資料概要2.6.2.2.2)
- 社内資料:エンシトレルビルのSARS-CoV-2感染者対象第II/III相試験(Phase 3 Part)のアミノ酸変異(2024/3/5承認、申請資料概要2.7.2.4.1.2)
- 社内資料:エンシトレルビルに対するSARS-CoV-2耐性分離試験(2024/3/5承認、申請資料概要2.6.2.2.1.4)
- 社内資料:エンシトレルビルに対するリバースジェネティクス由来SARS-CoV-2変異体の薬剤感受性試験(2024/3/5承認、申請資料概要2.6.2.2.1.6)
24. 文献請求先及び問い合わせ先
文献請求先
製品情報問い合わせ先
26. 製造販売業者等
26.1 製造販売元
塩野義製薬株式会社
大阪市中央区道修町3丁目1番8号