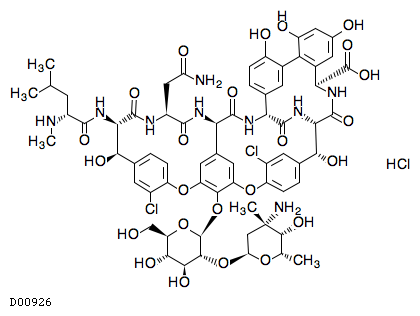
医薬品情報
| 総称名 | バンコマイシン塩酸塩 |
|---|---|
| 一般名 | バンコマイシン塩酸塩 |
| 欧文一般名 | Vancomycin Hydrochloride |
| 製剤名 | バンコマイシン塩酸塩散 |
| 薬効分類名 | グリコペプチド系抗生物質製剤 |
| 薬効分類番号 | 6113 |
| ATCコード | A07AA09 J01XA01 S01AA28 |
| KEGG DRUG |
D00926
バンコマイシン塩酸塩
|
| KEGG DGROUP |
DG01580
グリコペプチド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年11月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| バンコマイシン塩酸塩散0.5g「NIG」 | Vancomycin Hydrochloride Powder | 日医工岐阜工場 | 6113001B1160 | 909.6円/瓶 | 処方箋医薬品注) |
1. 警告
本剤の耐性菌の発現を防ぐため、「5.効能又は効果に関連する注意」、「8.重要な基本的注意」の項を熟読の上、適正使用に努めること。
2. 禁忌
次の患者には投与しないこと
本剤の成分によるショックの既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
<効能共通>
本剤の使用にあたっては、耐性菌の発現を防ぐため、原則として他の抗菌薬及び本剤に対する感受性を確認すること。
<感染性腸炎(偽膜性大腸炎を含む)>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
<感染性腸炎(偽膜性大腸炎を含む)>
用時溶解し、通常、成人1回0.125〜0.5g(力価)を1日4回経口投与する。
なお、年齢、体重、症状により適宜増減する。
なお、年齢、体重、症状により適宜増減する。
<骨髄移植時の消化管内殺菌>
用時溶解し、通常、成人1回0.5g(力価)を非吸収性の抗菌剤及び抗真菌剤と併用して1日4〜6回経口投与する。
なお、年齢、体重、症状により適宜増減する。
なお、年齢、体重、症状により適宜増減する。
7. 用法及び用量に関連する注意
<感染性腸炎(偽膜性大腸炎を含む)>
7〜10日以内に下痢、腹痛、発熱等の症状改善の兆候が全くみられない場合は投与を中止すること。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現を防ぐため、次のことに注意すること。
8.1.1 感染症の治療に十分な知識と経験を持つ医師又はその指導の下で行うこと。
8.1.2 投与期間は、感染部位、重症度、患者の症状等を考慮し、適切な時期に、本剤の継続投与が必要か否か判定し、疾病の治療上必要な最低限の期間の投与にとどめること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 本剤の成分又はペプチド系抗生物質、アミノグリコシド系抗生物質に対し過敏症の既往歴のある患者
9.1.2 ペプチド系抗生物質、アミノグリコシド系抗生物質による難聴又はその他の難聴のある患者
難聴が発現又は増悪するおそれがある。
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。静脈内投与により、ヒト母乳中への移行が認められている。
9.8 高齢者
腎機能等に注意して、慎重に投与すること。一般に生理機能が低下している。[9.2参照]
10. 相互作用
10.2 併用注意
| コレスチラミン | 同時に投与すると本剤の臨床効果が減弱するおそれがあるので、数時間間隔をあけて投与すること。 | コレスチラミンは腸管内でバンコマイシンと結合する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
血圧低下、不快感、口内異常感、喘鳴、眩暈、便意、耳鳴り、発汗等があらわれた場合には投与を中止し、適切な処置を行うこと。[9.2参照]
11.1.2 急性腎障害、間質性腎炎(いずれも頻度不明)[9.2参照]
11.1.3 汎血球減少、無顆粒球症、血小板減少(いずれも頻度不明)[9.2参照]
11.1.4 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、剥脱性皮膚炎(いずれも頻度不明)[9.2参照]
11.1.6 第8脳神経障害(頻度不明)[9.2参照]
11.1.7 偽膜性大腸炎(頻度不明)[9.2参照]
11.1.8 肝機能障害、黄疸(いずれも頻度不明)[9.2参照]
11.2 その他の副作用
| 3%以上 | 3%未満 | 頻度不明 | |
| 過敏症 | 発熱 | 発疹、潮紅、悪寒、蕁麻疹、そう痒 | |
| 血液 | 血小板減少 | 好酸球増多 | 白血球減少、貧血 |
| 肝臓 | AST上昇 | ALT上昇 | Al-P上昇 |
| 消化器 | 下痢 | 悪心、嘔吐、食欲不振 | |
| 腎臓 | BUN上昇、クレアチニン上昇 | ||
| その他 | 舌炎 | 口内炎 |
14. 適用上の注意
14.1 薬剤調製時の注意
<骨髄移植時の消化管内殺菌>
14.1.1 本剤はバイアル入りの散剤(無菌)である。注射器を用い5〜10mLの溶解液(注射用水等)で溶解する。用時溶解液は無菌のものを用いること。
<効能共通>
14.1.2 薬剤溶液そのままで服用しにくい場合には、単シロップ等で矯味してもよい。
14.2 薬剤投与時の注意
<骨髄移植時の消化管内殺菌>
溶解後は直ちに服用すること。また、服用にあたっては口腔内殺菌のために薬剤溶液で十分含嗽した後飲用することが望ましい。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
経口投与時の血中濃度を表1に示す3)。
| 1日投与量 投与期間 | n | 血中濃度(μg/mL) |
| 500mg(力価)×4/日 7日 | 1 | 測定限界 (2.5)以下 |
16.1.2 偽膜性大腸炎の患者
経口投与時の血中濃度を表2に示す4)。
| 1日投与量 投与期間 | n | 血中濃度(μg/mL) |
| 500mg(力価)×4/日 5〜7日 | 3 | 測定限界 (1.25)以下 |
16.1.3 メチシリン耐性黄色ブドウ球菌(MRSA)による感染性腸炎の患者
経口投与時の血清中濃度を表3に示す5)。
| 1日投与量 投与期間 | n | 血清中濃度(μg/mL) |
| 500mg(力価)×4/日 2〜19日※1 | 26 | 測定限界 (1.0)以下 |
16.2 吸収
16.3 分布
16.3.1 蛋白結合率
健康成人に1.0g(力価)点滴静注注)時の血清を用い、遠心限外ろ過法にて測定された血清蛋白結合率は34.3%であった6)。
16.4 代謝
バンコマイシン塩酸塩の代謝物は確認されていない7)。
16.5 排泄
16.5.1 健康成人
16.5.2 偽膜性大腸炎の患者
16.5.3 メチシリン耐性黄色ブドウ球菌(MRSA)による感染性腸炎の患者
経口投与時の糞便中濃度、尿中濃度を表6に示す5)。
| 1日投与量 投与期間 | 糞便中濃度(μg/g) | 尿中濃度(μg/mL) |
| 500mg(力価)×4/日 2〜19日※1 | 500〜5500(n=9) 10.5〜92.5※2(n=1) | 測定限界以下〜23.4(n=7) |
16.6 特定の背景を有する患者
16.6.1 腎機能障害を有する偽膜性大腸炎の患者
経口投与時の血清中濃度を表7に示す7)(外国人データ)。[9.2参照]
| No. | 年齢、性 | 基礎疾患 | 1日投与量 投与期間 | 血清中濃度(μg/mL) |
| 1 | 14歳、女8) | 無腎、血液透析中 | 250mg(力価)×4/日×8日 | 13.5〜34.0 |
| 2 | 62歳、男9) | 腎不全 | 500mg(力価)×4/日×8日 1000mg(力価)/日×9日 500mg(力価)/日×3日 | 11.4〜20.3 |
| 3 | 32歳、男10) | 糖尿病、血液透析中 | 250mg(力価)×4/日×11日 | 約4.5〜7.0 |
| 4 | 45歳、男10) | 血液透析中 | 250mg(力価)×4/日 投与期間不明 | 2.4〜2.6 |
| 5 | 45歳、男10) | 血液透析中 | 500mg(力価)×4/日×3日 | 11〜13 |
| 125mg(力価)×4/日 投与期間不明 | 2.4〜3.4 | |||
| 6 | 63歳、男10) | 糖尿病、血液透析中 | 250mg(力価)×4/日 投与期間不明 | 0.0 |
| 7 | 28歳、男10) | 糖尿病性腎症 | 500mg(力価)×4/日 投与期間不明 | 0.7〜9.8 |
注)本剤の承認された用法及び用量とは異なる。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<クロストリジウム・ディフィシルによる偽膜性大腸炎>
17.1.1 国内一般臨床試験
<メチシリン耐性黄色ブドウ球菌(MRSA)による感染性腸炎>
17.1.2 国内一般臨床試験
承認時における有効性評価対象例34例すべて(100.0%)が有効であった。下痢、腹痛、腹部膨満等の腸炎症状及び発熱の正常化日数は3〜4日であった。安全性評価対象例53例に副作用は認められなかった。臨床検査値の異常変動は51例中8例(15.7%)に認められた。主な副作用は、「AST、ALT上昇」、「AST、ALT上昇、Al-P上昇」各3例(5.9%)であった12)。
18. 薬効薬理
18.1 作用機序
18.2 抗菌作用
19. 有効成分に関する理化学的知見
19.1. バンコマイシン塩酸塩
21. 承認条件
21.1 使用施設を把握すると共に施設の抽出率、施設数を考慮して以下の対策を講ずること。
21.1.1 適切な市販後調査(感受性調査を含む)を継続し、情報を収集すること。
21.1.2 収集した情報を解析し、適正な使用を確保するために医療機関に対し、必要な情報提供を継続すること。
22. 包装
10バイアル
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- 厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
- 舟田 久ほか, 感染症学雑誌, 53, 182-204, (1979) »PubMed
- 島田 馨ほか, 最新医学, 37, 1558-1565, (1982)
- 小西敏郎ほか, Surg.Today., 27, 826-832, (1997) »PubMed
- 中島光好ほか, Chemotherapy., 40, 210-224, (1992) »DOI
- 第十八改正日本薬局方 医薬品情報 JPDI2021., 554-556, (2021), (じほう)
- Thompson,C.M.et al., Int.J.Pediatr.Nephrol., 4, 1-4, (1983) »PubMed
- Spitzer,P.G.et al., Ann.Intern.Med., 100, 533-534, (1984) »PubMed
- Matzke,G.R.et al., Am.J.Kidney Dis., 9, 422-425, (1987) »PubMed
- 厚生省薬務局, 医薬品研究, 24 (5), 566-567, (1993)
- 小西敏郎ほか, Chemotherapy., 42, 436-450, (1994) »DOI
- Barna,J.C.J.et al., Annu.Rev.Microbiol., 38, 339-357, (1984) »PubMed
- Watanakunakorn,C., Rev.Infect.Dis., 3, S210-215, (1981)
- 永田 弘ほか, Chemotherapy., 40, 581-591, (1992) »DOI
- 青木泰子ほか, 感染症学雑誌, 64, 549-556, (1990) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工岐阜工場株式会社
富山市総曲輪1丁目6番21
26.2 発売元
日医工株式会社
富山市総曲輪1丁目6番21
26.3 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号