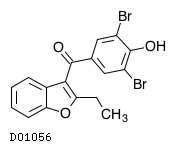
医薬品情報
| 総称名 | ベンズブロマロン |
|---|---|
| 一般名 | ベンズブロマロン |
| 欧文一般名 | Benzbromarone |
| 製剤名 | ベンズブロマロン錠 |
| 薬効分類名 | 尿酸排泄薬 |
| 薬効分類番号 | 3949 |
| ATCコード | M04AB03 |
| KEGG DRUG |
D01056
ベンズブロマロン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年3月 改訂(第2版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ベンズブロマロン錠25mg「NIG」 (後発品) | Benzbromarone Tablets | 日医工岐阜工場 | 3949002F1185 | 6.1円/錠 | 劇薬, 処方箋医薬品注) |
| ベンズブロマロン錠50mg「NIG」 (後発品) | Benzbromarone Tablets | 日医工岐阜工場 | 3949002F2246 | 6.1円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
下記の場合における高尿酸血症の改善
痛風、高尿酸血症を伴う高血圧症
6. 用法及び用量
<ベンズブロマロン錠25mg「NIG」>
痛風
通常成人1日1回1錠または2錠(ベンズブロマロンとして25mgまたは50mg)を経口投与し、その後維持量として1回2錠を1日1〜3回(ベンズブロマロンとして50〜150mg)経口投与する。
なお、年令、症状により適宜増減する。
なお、年令、症状により適宜増減する。
高尿酸血症を伴う高血圧症
通常成人1回2錠を1日1〜3回(ベンズブロマロンとして50〜150mg)経口投与する。
なお、年令、症状により適宜増減する。
なお、年令、症状により適宜増減する。
<ベンズブロマロン錠50mg「NIG」>
痛風
通常成人1日1回1/2錠または1錠(ベンズブロマロンとして25mgまたは50mg)を経口投与し、その後維持量として1回1錠を1日1〜3回(ベンズブロマロンとして50〜150mg)経口投与する。
なお、年令、症状により適宜増減する。
なお、年令、症状により適宜増減する。
高尿酸血症を伴う高血圧症
通常成人1回1錠を1日1〜3回(ベンズブロマロンとして50〜150mg)経口投与する。
なお、年令、症状により適宜増減する。
なお、年令、症状により適宜増減する。
8. 重要な基本的注意
8.2 本剤の投与にあたっては、重篤な肝障害が主に投与開始6ヶ月以内に発現しているので、投与開始後少なくとも6ヶ月間は必ず定期的な検査を行うこと。また、投与開始後6ヶ月以降も定期的に肝機能検査を行うこと。[1.1、1.2、11.1.1参照]
8.3 急性痛風発作がおさまるまで、本剤の投与を開始しないこと。
8.4 本剤の血中尿酸低下作用は著しく、本剤の投与初期に痛風発作を誘発することがある。
8.5 尿が酸性の場合、患者に尿酸結石及びこれに由来する血尿、腎仙痛等の症状を起こしやすいので、これを防止するため、水分の摂取による尿量の増加及び尿のアルカリ化をはかること。
なお、この場合には、患者の酸・塩基平衡に注意すること。
なお、この場合には、患者の酸・塩基平衡に注意すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 高度の腎機能障害のある患者
投与しないこと。効果が期待できないことがある。[2.3参照]
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験で催奇形作用が報告されている。[2.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP2C9
10.2 併用注意
| クマリン系抗凝血薬 ワルファリン | クマリン系抗凝血薬の作用を増強することがあるので、プロトロンビン時間を測定するなど観察を十分に行い、注意すること。 | 本剤は、CYP2C9を阻害するため、CYP2C9によって代謝されるクマリン系抗凝血薬の血中濃度を上昇させるなどの機序が考えられる。 |
| 抗結核薬 ピラジナミド | 本剤の効果が減弱することがある。 | ピラジナミドが腎尿細管における尿酸の分泌を抑制することが知られているため、本剤の効果が減弱することが考えられる。 |
| サリチル酸製剤 アスピリン等 | 本剤の効果が減弱することがある。 | サリチル酸製剤は尿酸の排泄を抑制することが知られているため、本剤の効果が減弱することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 重篤な肝障害(頻度不明)
11.2 その他の副作用
| 0.1%以上 | 0.1%未満 | 頻度不明 | |
| 過敏症 | そう痒感、発疹、蕁麻疹 | 顔面発赤、紅斑 | 光線過敏症 |
| 肝臓 | AST上昇、ALT上昇 | Al-P上昇 | 黄疸 |
| 消化器 | 胃部不快感、胃腸障害、下痢、軟便、胸やけ | 胃痛、腹痛、悪心、口内の荒れ | |
| その他 | 浮腫、心窩部不快感、頭痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
ラットに長期間経口投与(50mg/kg/day(臨床用量の約17倍)、104週間)したところ、肝細胞癌が発生したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子(6例)にベンズブロマロン(50mg錠)2錠(ベンズブロマロンとして100mg)注)を空腹時に単回経口投与した時の、薬物動態パラメータは以下の通りであった1)。
| Cmax(μg/mL) | Tmax(hr) | AUC0-∞(μg・hr/mL) | T1/2(hr) | |
| 未変化体 | 2.3±0.8 | 2.7±1.0 | 15.9±3.3 | 5.4±1.9 |
| 6-ヒドロキシ体 | 1.7±0.4 | 4.8±1.3 | 39.9±4.4 | 18.0±2.9 |
16.1.2 生物学的同等性試験
<ベンズブロマロン錠25mg「NIG」>
(1)ベンズブロマロン錠25mg「NIG」とユリノーム錠25mgを、クロスオーバー法によりそれぞれ1錠(ベンズブロマロンとして25mg)健康成人男子に絶食単回経口投与して血清中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された3)。
| 投与量(mg) | AUC0-24(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | |
| ベンズブロマロン錠25mg「NIG」 | 25 | 4.9083±2.2819 | 0.9716±0.3400 | 2.63±1.16 | 2.23±0.94 |
| ユリノーム錠25mg | 25 | 5.0540±2.1263 | 0.9394±0.2713 | 2.84±0.96 | 2.07±0.41 |
血清中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<ベンズブロマロン錠50mg「NIG」>
(2)ベンズブロマロン錠50mg「NIG」とユリノーム錠50mgを、クロスオーバー法によりそれぞれ1錠(ベンズブロマロンとして50mg)健康成人男子に絶食単回経口投与して血清中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| 投与量(mg) | AUC0-12(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | |
| ベンズブロマロン錠50mg「NIG」 | 50 | 10.6±2.4 | 2.6±0.5 | 2.0±0.8 | 2.3±1.1 |
| ユリノーム錠50mg | 50 | 11.0±2.0 | 2.7±0.6 | 2.0±1.0 | 2.0±0.4 |
血清中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.4 代謝
16.4.1 ヒトにおける成績
(1)健康成人男子(6例)にベンズブロマロン(50mg錠)2錠(ベンズブロマロンとして100mg)を空腹時に単回経口投与した時の、血漿中及び尿中の主要代謝物は、6-ヒドロキシ体であった1)。
(2)外国人患者にベンズブロマロン製剤100mgを経口投与した結果、胆汁中に2種類のヒドロキシ体が検出されたとの報告がある4)。
16.4.2 in vitro試験の成績[10.参照]
16.5 排泄
18. 薬効薬理
18.1 作用機序
ベンズブロマロンは、尿細管における尿酸の再吸収を特異的に抑制し、尿酸の尿中への排泄を促進させ、血清尿酸値を低下させると考えられる。
18.2 血清尿酸値低下作用
ベンズブロマロンを痛風患者に投与した結果、血清尿酸値の低下と尿酸クリアランスの上昇を認めたが、クレアチニンクリアランスはほとんど変化しなかった。また、血清尿酸値の低下とほぼ平行する尿酸プールの縮小を認めたが、尿酸の一日産生量には著変はなかった。従って、ベンズブロマロンは尿酸の尿中への排泄を選択的に促進するものと考えられる6)。
18.3 ペニシリン、フェノールスルフォフタレイン負荷試験
ベンズブロマロンを健康成人に投与し、ペニシリン、フェノールスルフォフタレインの尿中排泄及び血中濃度を指標としてベンズブロマロンの尿細管における作用を検討したところ、ベンズブロマロンはこれらの尿中排泄及び血中濃度にはほとんど影響を及ぼさなかったことから、プロベネシドとは異なり尿細管における尿酸の再吸収のみを抑制するものと考えられる7)(外国人データ)。
18.4 尿酸トランスポーター(URAT1)阻害作用
19. 有効成分に関する理化学的知見
19.1. ベンズブロマロン
20. 取扱い上の注意
光によって着色するため、アルミピロー包装開封後は遮光して保存すること。
22. 包装
<ベンズブロマロン錠25mg「NIG」>
100錠[PTP(10錠×10)]
<ベンズブロマロン錠50mg「NIG」>
100錠[PTP(10錠×10)]
23. 主要文献
- 及川寿浩ほか, 新薬と臨床, 53 (6), 682-691, (2004)
- 及川寿浩ほか, 痛風と核酸代謝, 35 (1), 19-30, (2011) »DOI
- 社内資料:生物学的同等性試験
- Walter-Sack I,et al., Eur J Med Res., 3 (1-2), 45-49, (1998) »PubMed
- 第十八改正日本薬局方解説書, C-5345-C-5349, (2021), (廣川書店)
- 中村徹ほか, リウマチ, 11 (4), 342-348, (1971)
- Politta G,et al., Schweiz Rundschau Med(Praxis)., 62 (44), 1345-1350, (1973) »PubMed
- Enomoto A,et al., Nature., 417 (6887), 447-452, (2002) »PubMed
- 及川寿浩ほか, 新薬と臨床, 54 (6), 645-650, (2005)
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工岐阜工場株式会社
富山市総曲輪1丁目6番21
26.2 発売元
日医工株式会社
富山市総曲輪1丁目6番21
26.3 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号