医薬品情報
| 総称名 | アカルボース |
|---|---|
| 一般名 | アカルボース |
| 欧文一般名 | Acarbose |
| 製剤名 | アカルボース錠 |
| 薬効分類名 | 食後過血糖改善剤 |
| 薬効分類番号 | 3969 |
| ATCコード | A10BF01 |
| KEGG DRUG |
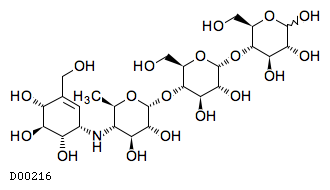
D00216
アカルボース
|
| KEGG DGROUP |
DG01663
α-グルコシダーゼ阻害薬
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アカルボース錠50mg「NIG」 (後発品) | Acarbose Tablets | 日医工岐阜工場 | 3969003F1140 | 7.3円/錠 | 処方箋医薬品注) |
| アカルボース錠100mg「NIG」 (後発品) | Acarbose Tablets | 日医工岐阜工場 | 3969003F2146 | 12.8円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重症ケトーシス、糖尿病性昏睡又は前昏睡の患者[輸液及びインスリンによる速やかな高血糖の是正が必須となる。]
2.2 重症感染症、手術前後、重篤な外傷のある患者[インスリンによる血糖管理が望まれる。]
2.3 本剤の成分に対して過敏症の既往歴のある患者
2.4 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
糖尿病の食後過血糖の改善(ただし、食事療法・運動療法によっても十分な血糖コントロールが得られない場合、又は食事療法・運動療法に加えて経口血糖降下薬若しくはインスリン製剤を使用している患者で十分な血糖コントロールが得られない場合に限る)
5. 効能または効果に関連する注意
5.1 本剤の投与は、糖尿病治療の基本である食事療法・運動療法のみを行っている患者では投与の際、食後血糖2時間値が200mg/dL以上を示す場合に限る。
5.2 食事療法・運動療法に加えて経口血糖降下薬又はインスリン製剤を使用している患者では、投与の際の空腹時血糖値は140mg/dL以上を目安とする。
6. 用法及び用量
アカルボースとして、成人では通常1回100mgを1日3回、食直前に経口投与する。ただし、1回50mgより投与を開始し、忍容性を確認したうえ1回100mgへ増量することもできる。
なお、年齢、症状に応じ適宜増減する。
なお、年齢、症状に応じ適宜増減する。
7. 用法及び用量に関連する注意
高齢者等忍容性の低下が懸念される患者に対しては低用量(1回50mg)から投与を開始すること。[9.8参照]
8. 重要な基本的注意
8.1 患者に対し低血糖症状及びその対処方法について十分説明すること。[11.1.1参照]
8.2 本剤の投与により、「腹部膨満・鼓腸」、「放屁増加」等の消化器系副作用が発現することがある。これらは、一般に時間の経過とともに消失することが多いが、症状に応じて減量あるいは消化管内ガス駆除剤の併用を考慮し、高度で耐えられない場合は投与を中止すること。[11.1.2参照]
8.3 劇症肝炎等の重篤な肝機能障害があらわれることがある。これらは投与開始後概ね6ヵ月以内に認められる場合が多いので、投与開始後6ヵ月までは月1回、その後も定期的に肝機能検査を行うこと。[11.1.3参照]
8.4 本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、常に投与継続の必要性について注意を払うこと。本剤を2〜3ヵ月投与しても食後血糖に対する効果が不十分な場合(静脈血漿で食後血糖2時間値が200mg/dL以下にコントロールできないなど)には、より適切と考えられる治療への変更を考慮すること。
なお、食後血糖の十分なコントロール(静脈血漿で食後血糖2時間値が160mg/dL以下)が得られ、食事療法・運動療法又はこれらに加えて経口血糖降下薬若しくはインスリン製剤を使用するのみで十分と判断される場合には、本剤の投与を中止して経過観察を行うこと。
なお、食後血糖の十分なコントロール(静脈血漿で食後血糖2時間値が160mg/dL以下)が得られ、食事療法・運動療法又はこれらに加えて経口血糖降下薬若しくはインスリン製剤を使用するのみで十分と判断される場合には、本剤の投与を中止して経過観察を行うこと。
8.5 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 開腹手術の既往又は腸閉塞の既往のある患者
9.1.2 胃腸障害のある患者
本剤の投与により鼓腸、放屁、下痢等の消化器症状を増強する可能性がある。
9.1.3 ロエムヘルド症候群、重度のヘルニア、大腸の狭窄・潰瘍等のある患者
腸内ガスの発生増加によって、症状が悪化することがある。
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
クレアチニンクリアランス25mL/min未満の患者では血中活性物質(未変化体及び活性代謝物)濃度は腎機能正常者に比べて約4〜5倍上昇することが報告されている(外国人データ)。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
代謝状態が不安定であり、血糖管理状況が大きく変化するおそれがある。肝機能障害患者を対象とした臨床試験は実施していない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。妊娠中の投与に関する安全性は確立していない。[2.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(授乳ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
経過を十分に観察しながら慎重に投与すること。[7.参照]
10. 相互作用
10.2 併用注意
| スルホニルウレア系薬剤 スルホンアミド系薬剤 ビグアナイド系薬剤 インスリン製剤 インスリン抵抗性改善剤 速効型食後血糖降下剤 [11.1.1参照] | 低血糖があらわれることがある。併用時には低用量から開始する、又は他の糖尿病用薬の用量を調整するなど慎重に投与すること。 | 左記糖尿病用薬の血糖降下作用に本剤の糖質吸収遅延作用が加わる。 |
| 上記糖尿病用薬とその血糖降下作用を増強する薬剤 β遮断剤 サリチル酸剤 モノアミン酸化酵素阻害剤等 | 糖尿病用薬の使用上の注意に記載の相互作用に留意するとともに、本剤の糖質吸収遅延作用が加わることによる影響に十分注意すること。 | 左記薬剤により他の糖尿病用薬の血糖降下作用が増強されるところに、本剤の糖質吸収遅延作用が加わる。 |
| 上記糖尿病用薬とその血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン等 | 糖尿病用薬の使用上の注意に記載の相互作用に留意するとともに、本剤の糖質吸収遅延作用が加わることによる影響に十分注意すること。 | 左記薬剤により他の糖尿病用薬の血糖降下作用が減弱されるところに、本剤の糖質吸収遅延作用が加わる。 |
| ジゴキシン | ジゴキシンの血中濃度が低下することがある。また、少数例で血中濃度の上昇も認められている。ジゴキシンの血中濃度が変動した場合には、ジゴキシンの投与量を調節するなど適切な処置を行うこと。 | 発現機序の詳細は不明である。 |
| ラクツロース ラクチトール水和物 | 消化器系の副作用が増強される可能性がある。 | 左記薬剤が、本剤の作用による未消化の他の二糖類とともに下部消化管へと移行し、腸内細菌によって分解を受けることから、併用により腸内ガス等が更に増加する可能性がある。 |
| 炭水化物消化酵素製剤 ジアスターゼ等 | 両剤の薬効に影響を及ぼす可能性がある。 | 本剤はα-アミラーゼ活性の阻害作用を有し、一方、炭水化物消化酵素製剤はα-アミラーゼ活性を有している。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖
11.1.2 腸閉塞
11.1.3 肝機能障害、黄疸
AST、ALTの上昇等を伴う重篤な肝機能障害、黄疸(0.1%未満)があらわれることがある。また、劇症肝炎(0.1%未満)の報告がある。[8.3参照]
11.1.4 重篤な肝硬変例での意識障害を伴う高アンモニア血症(頻度不明)
重篤な肝硬変例に投与した場合、便秘等を契機として高アンモニア血症が増悪し、意識障害を伴うとの報告があるので、排便状況等を十分に観察すること。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 消化器 | 腹部膨満・鼓腸、放屁増加、軟便 | 排便回数増加、下痢、腹痛、便秘、嘔気、嘔吐、食欲不振、食欲亢進、消化不良 | 口渇、腸管のう腫状気腫症 |
| 過敏症 | 発疹、そう痒 | ||
| 精神神経系 | 頭痛・頭重感、めまい、しびれ感 | ||
| 肝臓 | AST上昇、ALT上昇、γ-GTP上昇、Al-P上昇、LDH上昇 | ||
| 血液 | 白血球減少、血小板減少 | 貧血 | |
| その他 | 胸部圧迫感 | 浮腫、ほてり、味覚異常、頻尿 |
12. 臨床検査結果に及ぼす影響
本剤服用中に血清1,5-AG(1,5-アンヒドログルシトール)低値を示すことがある。1,5-AGの検査結果は、血糖コントロールの参考とはならないので注意すること。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は吸湿性が強いのでPTPシートの状態で保存するよう指導すること。[20.参照]
15. その他の注意
15.1 臨床使用に基づく情報
健康成人を対象としたコレスチラミン製剤との併用試験において、本剤の効果(特に食後インスリン値の上昇の抑制)が増強されたとの報告がある。コレスチラミン製剤は本剤の作用に影響を及ぼすおそれがあるので併用しないことが望ましい(外国人データ)。
16. 薬物動態
16.1 血中濃度
健康成人に100mgを単回経口投与した場合、未変化体及び活性代謝物の血中濃度はほとんどの測定時点で検出限界(3ng/mL)以下である1)。
16.3 分布
ラットに経口投与した試験では、腎、副腎、次いで肝で高く、その他の臓器、組織ではいずれも血漿とほぼ同程度又はそれ以下である。なお、授乳ラットに経口投与した試験では、乳汁中に高濃度に移行するのが認められた2)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 単独療法(国内プラセボ対照二重盲検比較試験)
(1)インスリン非依存型糖尿病(NIDDM)患者を対象として、アカルボース1回100mg又はプラセボを1日3回8週間投与した。有用度は、有用以上がアカルボース群33/85例(38.8%)、プラセボ群12/87例(13.8%)であり、アカルボースの有用性が認められた(p<0.001)3)。
(2)NIDDM患者を対象として、アカルボース1回100mg又はプラセボを1日3回24〜28週間投与した。有用度は、有用以上がアカルボース群10/17例(58.8%)、プラセボ群3/15例(20.0%)であり、アカルボースの有用性が認められた(p<0.05)4)。
17.1.2 併用療法(国内一般臨床試験)
(1)SU剤との併用試験
・NIDDM患者を対象として、アカルボース1回50mg〜100mgを1日3回12週間投与した。12週間後における食後血糖改善度は中等度改善以上が18/55(32.7%)であった。副作用は70例中14例(20.0%)に21件認められ、放屁の増加11件、腹部膨満感9件、下痢1件であった5)。
・NIDDM患者を対象として、アカルボース1回50mg〜100mgを1日3回12週間投与した。12週間後における食後血糖改善度は中等度改善以上が40/103例(38.8%)であった。副作用は122例中25例(20.5%)に45件認められ、主な副作用は放屁の増加19件、腹部膨満感14件、軟便2件等であった6)。
(2)SU剤との併用試験(国内長期投与試験)
NIDDM患者を対象として、アカルボース1回50mg〜100mgを1日3回28週間以上投与※した。治療期終了時における食後血糖改善度は中等度改善以上が30/80例(37.5%)であった。投与期間6ヵ月以上では効果の持続が確認され、安定した血糖コントロールが得られていた。副作用は86例中16例(18.6%)に27件認められ、主な副作用は放屁の増加13件、腹部膨満感6件等であった7)。
(3)インスリン製剤との併用試験
インスリン製剤投与中のNIDDM患者及びインスリン依存型糖尿病(IDDM)患者を対象として、アカルボース1回50mg〜100mgを1日3回12週間投与した。12週間後における食後血糖改善度は、中等度改善以上が39/81例(48.1%)であった。副作用は114例中21例(18.4%)に34件認められ、主な副作用は放屁の増加12件、腹部膨満感11件等であった8)。
(4)インスリン製剤との併用試験(国内長期投与試験)
インスリン製剤投与中のNIDDM患者及びIDDM患者を対象として、アカルボース1回50mg〜100mgを1日3回28週間以上投与※した。治療期終了時における食後血糖改善度は、中等度改善以上が19/37例(51.4%)であった。投与期間6ヵ月以上では効果の持続が確認され、安定した血糖コントロールが得られていた。副作用は52例中11例(21.2%)に19件認められ、主な副作用は放屁の増加5件、腹部膨満感5件等であった9)。
※12週間投与試験の終了時の用法・用量をそのまま継続した。忍容性を考慮して、300mg/日から減量が必要と判断した場合には150mg/日で継続投与した。
18. 薬効薬理
18.1 作用機序
アカルボースは小腸粘膜微絨毛膜に存在するグルコアミラーゼ、スクラーゼ、マルターゼを用量依存的に阻害するほか、膵液及び唾液のα-アミラーゼを阻害し、食後の著しい血糖上昇を抑制する10)11)12)13)14)。
・炭水化物(デンプン、マルトース、スクロース等)のα-グルコシダーゼによる加水分解を阻害し、消化管でのグルコース、フルクトースへの分解を直接抑制することにより糖質の吸収を遅延させる。
・食後の過血糖を改善するとともに、血糖の日内変動幅を小さくし、良好な血糖コントロールが得られる。
・食後の血糖上昇を抑制するに伴い、インスリンの上昇も抑制するので高インスリン血症を招かない。またアカルボースによるインスリン分泌に対する直接作用がないので、膵β細胞の負担を軽減する。
18.2 血糖値に対する作用
18.2.1 健康成人7例に50mg、100mg、200mgを食事とともに単回経口投与した場合注)、食後の血糖上昇、血清インスリン上昇は用量依存的に抑制される12)。
18.2.2 NIDDM患者12例に100mgを1日3回、毎食事とともに3ヵ月間経口投与した場合、空腹時血糖は有意に低下する13)。
注)本剤の承認用量は1回100mg、1日3回である。
18.3 血糖日内変動に対する作用
NIDDM患者19例に50mg又は100mgを1日3回毎食事とともに2週間経口投与した場合、血糖日内変動曲線は下方移動し、血糖日内変動曲線下面積は用量依存的に低下する14)。
18.4 グリコヘモグロビン(HbA1)に対する作用
NIDDM患者12例に100mgを1日3回、毎食事とともに3ヵ月間経口投与した場合、HbA1は有意に低下する13)。
18.5 生物学的同等性試験
<アカルボース錠50mg「NIG」>
18.5.1 アカルボース錠50mg「NIG」とグルコバイ錠50mgを、それぞれ1錠(アカルボースとして50mg)健康成人男子に単回経口投与※した時の血糖値は、いずれもプラセボ投与時に比して有意な上昇抑制を示した。得られたパラメータ(AUC)について統計解析を行った結果、両剤の生物学的同等性が確認された15)。
※投与直後に高炭水化物食を負荷した時の血糖値を測定した。
| アカルボース錠50mg「NIG」 | グルコバイ錠50mg | プラセボ | 被験者数 |
| 12476±1628 | 12602±1824 | 13908±1195 | n=10 |
血糖値並びにAUCのパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<アカルボース錠100mg「NIG」>
18.5.2 アカルボース錠100mg「NIG」とグルコバイ錠100mgを、それぞれ1錠(アカルボースとして100mg)健康成人男子に単回経口投与※した時の血糖値は、いずれもプラセボ投与時に比して有意な上昇抑制を示した。得られたパラメータ(AUC)について統計解析を行った結果、両剤の生物学的同等性が確認された15)。
※投与直後に高炭水化物食を負荷した時の血糖値を測定した。
| アカルボース錠100mg「NIG」 | グルコバイ錠100mg | プラセボ | 被験者数 |
| 11263±793 | 11805±998 | 13602±1927 | n=10 |
血糖値並びにAUCのパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
19. 有効成分に関する理化学的知見
19.1. アカルボース
20. 取扱い上の注意
吸湿性が強いのでPTPシートの状態で保存すること。[14.1.2参照]
22. 包装
<アカルボース錠50mg「NIG」>
100錠[10錠(PTP)×10]、500錠[10錠(PTP)×50]
<アカルボース錠100mg「NIG」>
100錠[10錠(PTP)×10]、500錠[10錠(PTP)×50]
23. 主要文献
- 東純一他, 医学と薬学, 22, 365-381, (1989)
- Ahr HJ, et al., Arzneim-Forsch/Drug Res., 39, 1261-1267, (1989) »PubMed
- 五島雄一郎他, 医学のあゆみ, 149, 591-618, (1989)
- 坂本信夫他, 臨床と研究, 67, 219-233, (1990)
- 河盛隆造, 薬理と治療, 24, 837-852, (1996)
- 豊田隆謙他, 薬理と治療, 24, 639-657, (1996)
- 豊田隆謙他, 薬理と治療, 24, 1375-1392, (1996)
- 河盛隆造, 薬理と治療, 24, 853-872, (1996)
- 河盛隆造, 薬理と治療, 24, 1109-1129, (1996)
- Caspary WF, et al., Res Exp Med (Berl)., 175, 1-6, (1979) »PubMed
- 末広逸夫他, Clinica Chimica Acta., 117, 145-152, (1981)
- 三村悟郎他, 医学と薬学, 18, 1891-1898, (1987)
- 早川哲夫他, Nagoya J Med Sci., 47, 35-41, (1984)
- 中埜幸治他, 糖尿病, 28, 701-706, (1985) »DOI
- 社内資料:生物学的同等性試験
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工岐阜工場株式会社
富山市総曲輪1丁目6番21
26.2 発売元
日医工株式会社
富山市総曲輪1丁目6番21
26.3 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号