医薬品情報
| 総称名 | トレプロスト |
|---|---|
| 一般名 | トレプロスチニル |
| 欧文一般名 | Treprostinil |
| 製剤名 | トレプロスチニル |
| 薬効分類名 | プロスタグランジンI2誘導体製剤 |
| 薬効分類番号 | 2190 |
| ATCコード | B01AC21 |
| KEGG DRUG |
D06213
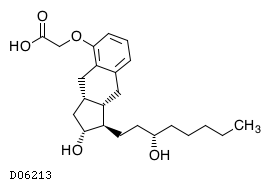
トレプロスチニル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年1月 改訂(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トレプロスト吸入液1.74mg | TREPROST Inhalation Solution 1.74mg | 持田製薬 | 2190702G1020 | 21751.3円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
○間質性肺疾患に伴う肺高血圧症
5. 効能または効果に関連する注意
<効能共通>
5.1 本剤の使用にあたっては、最新の治療ガイドラインを参考に投与の要否を検討すること。
<肺動脈性肺高血圧症>
5.2 WHO機能分類クラスIにおける有効性及び安全性は確立していない。
5.3 特発性肺動脈性肺高血圧症、遺伝性肺動脈性肺高血圧症及び結合組織病に伴う肺動脈性肺高血圧症以外の肺動脈性肺高血圧症における有効性及び安全性は確立していない。
<間質性肺疾患に伴う肺高血圧症>
5.4 「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(間質性肺疾患の臨床分類等)を十分に理解した上で、適応患者を選択すること。
5.5 WHO機能分類クラスIVにおける有効性及び安全性は確立していない。
6. 用法及び用量
<肺動脈性肺高血圧症>
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、7日以上の間隔で、1回3吸入ずつ、最大9吸入(トレプロスチニルとして54μg)まで漸増する。3吸入の増量に対して忍容性に懸念がある場合は、増量幅を1又は2吸入としてもよい。忍容性がない場合は減量し、1回最小量は1吸入とすること。
<間質性肺疾患に伴う肺高血圧症>
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、3日以上の間隔で、1回1吸入ずつ、最大12吸入(トレプロスチニルとして72μg)まで漸増する。忍容性がない場合は減量し、1回最小量は1吸入とすること。
7. 用法及び用量に関連する注意
7.1 吸入間隔は約4時間あけること。
7.2 本剤の吸入にはTD-300/Jネブライザを使用すること。[14.1参照]
8. 重要な基本的注意
8.1 本剤の投与は、病状の変化への適切な対応が重要であるため、緊急時に十分な対応が可能な医療施設において肺高血圧症及び心不全の治療に十分な知識と経験をもつ医師のもとで、本剤の投与が適切と判断される症例にのみ行うこと。
8.2 本剤は血管拡張作用を有するため、本剤の投与に際しては、血管拡張作用により患者が有害な影響を受ける状態(降圧剤投与中、安静時低血圧、血液量減少、重度の左室流出路閉塞、自律神経機能障害等)にあるのかを十分検討すること。
8.3 血小板減少、好中球減少があらわれることがあるので、定期的に臨床検査を行うなど観察を十分に行うこと。[11.1.3参照]
8.4 甲状腺機能亢進症があらわれることがあるので、必要に応じて甲状腺機能検査を実施するなど観察を十分に行うこと。[11.1.4参照]
8.5 臨床試験において、めまい等が認められているので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.6 類薬では、吸入時に致死的な気管支痙攣が報告されている。気管支痙攣が認められた場合は、直ちに投与を中止し、適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 肺静脈閉塞性疾患を有する患者
投与しないことが望ましい。本剤の血管拡張作用により、心血管系の状態を著しく悪化させるおそれがある。
9.1.2 高度に肺血管抵抗が上昇している患者
肺血管抵抗が高度に上昇した病態を示す肺高血圧症の末期と考えられる患者では、心機能も著しく低下している。
9.1.3 出血傾向のある患者
本剤の血小板凝集抑制作用により、出血を助長するおそれがある。
9.1.4 低血圧の患者
本剤の血管拡張作用により、血圧をさらに低下させるおそれがある。
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ウサギ)において骨格変異(腰肋骨)を有する胎児の発生率の増加が臨床曝露量(トレプロスチニルとして72μg吸入投与時)の3.1倍に相当する曝露量で認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。類薬の動物試験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下していることが多い。
10. 相互作用
相互作用序文
本剤は主にCYP2C8により代謝される。[16.4参照]
薬物代謝酵素用語
CYP2C8
10.2 併用注意
| 降圧作用を有する薬剤 カルシウム拮抗剤 アンジオテンシン変換酵素阻害剤 利尿剤 プロスタグランジンE1、E2、I2誘導体製剤 等 | 過度の血圧低下が起こることがある。併用薬もしくは本剤を増量する場合は血圧を十分観察すること。 | 相互に降圧作用を増強することが考えられる。 |
| 抗凝固剤 ワルファリンカリウム 等 血栓溶解剤 ウロキナーゼ 等 血小板凝集抑制作用を有する薬剤 アスピリン チクロピジン塩酸塩 プロスタグランジンE1、E2、I2誘導体製剤 等 [16.7.1(2)参照] | 出血の危険性を増大させるおそれがある。定期的にプロトロンビン時間等の血液検査を行い、必要に応じてこれらの併用薬を減量又は投与を中止すること。 | 相互に抗凝固作用を増強することが考えられる。 |
| CYP2C8誘導剤 リファンピシン 等 [16.7.2(3)参照] | 本剤のAUC及びCmaxが低下し、本剤の効果が減弱するおそれがある。肺高血圧症状の観察を十分に行うこと。 | 本剤の代謝酵素であるCYP2C8を誘導することにより、本剤の代謝が促進されると考えられる。 |
| CYP2C8阻害剤 デフェラシロクス [16.7.2(4)参照] | 本剤のAUC及びCmaxが上昇し、本剤の副作用が発現するおそれがある。 | 本剤の代謝酵素であるCYP2C8を阻害することにより、本剤の代謝が抑制されると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 血圧低下(1.6%)、失神(1.3%)
過度の血圧低下、失神があらわれることがある。
11.1.2 出血(頻度不明)
消化管出血又は鼻出血等があらわれることがある。
11.1.3 血小板減少(頻度不明)、好中球減少(頻度不明)[8.3参照]
11.1.4 甲状腺機能亢進症(頻度不明)[8.4参照]
11.2 その他の副作用
| 10%以上 | 10%未満 | 頻度不明 | |
| 出血傾向 | 喀血、肺出血、鼻出血 | 不正子宮出血、結膜出血、紫斑 | |
| 循環器 | 潮紅、ほてり、動悸、低血圧 | ||
| 消化器 | 悪心 | 下痢、軟便、嘔吐、腹痛 | 上腹部痛 |
| 筋骨格 | 顎痛、四肢痛、筋骨格痛、筋肉痛 | ||
| 精神神経系 | 頭痛、浮動性めまい | 頭部不快感、異常感、不眠症 | |
| 呼吸器 | 咳嗽(45.7%)、咽喉刺激感、呼吸困難 | 口腔咽頭痛、口腔咽頭不快感、口腔内不快感、鼻閉、喘鳴 | 喀痰 |
| 皮膚 | 発疹、そう痒症 | ||
| その他 | 発熱、倦怠感、浮腫 |
13. 過量投与
14. 適用上の注意
14.1 薬剤交付時の注意
医療従事者は、患者にTD-300/Jネブライザを渡す際に、正しい使用方法を十分に指導すること。また、以下の点に注意するよう指導すること。[7.2、20.参照]
・本剤の変色又はアンプル内に微粒子が認められるものは使用しないこと。
・吸入にあたり1アンプル全量をネブライザに移し、1日の吸入が終了後ネブライザ内に残った液は捨てること。
・本剤の希釈又は他剤との混合は避けること。
・本剤が皮膚に付着したり、眼に入らないように気をつけること。また、本剤を吸入する際には、十分に換気すること。
・本剤を飲み込まないこと。
・アルミ袋を開封後、2ヵ月以内に使用すること。また、未使用アンプルはアルミ袋に入れ、遮光保存すること。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人12例に本剤18μg及び36μgを単回吸入投与したときの薬物動態パラメータ(Cmax、AUClast、tmax及びt1/2)は、以下のとおりであった。Cmax及びAUClastは投与量に応じて増加した1)。
単回吸入投与時の血漿中濃度推移
| 投与量 | n | Cmaxa)(ng/mL) | AUClasta)(ng・hr/mL) | tmaxb)(hr) | t1/2a)(hr) |
| 18μg | 12 | 0.42633±0.06633 | 0.32846±0.07441 | 0.1667[0.083〜0.250] | 0.4523±0.0955 |
| 36μg | 12 | 0.86983±0.18213 | 0.68544±0.17670 | 0.1667[0.167〜0.250] | 0.5229±0.1382 |
<肺動脈性肺高血圧症>
16.1.2 反復投与
肺動脈性肺高血圧症患者に本剤を12週間吸入投与したとき、12週時に本剤1回の投与量が9吸入(54μg)であった被験者12例におけるCmax、AUClast、AUCinf及びt1/2(平均値±標準偏差)は、それぞれ1.03467±0.54191ng/mL、0.99429±0.56639ng・hr/mL、1.04735±0.60064ng・hr/mL及び0.7219±0.1115hrであり、tmax(中央値[最小値〜最大値])は0.1667[0.067〜1.017]hrであった2)。
<間質性肺疾患に伴う肺高血圧症>
16.1.3 反復投与
間質性肺疾患(気腫合併肺線維症を含む)に伴う肺高血圧症患者に本剤を16週間吸入投与したとき、16週時に本剤1回の投与量が12吸入(72μg)であった被験者15例におけるCmax、AUClast、AUCinf及びt1/2(平均値±標準偏差)は、それぞれ1.95653±0.97303ng/mL、1.70530±0.93260ng・hr/mL、1.79127±0.95409ng・hr/mL及び0.9523±0.1645hrであり、tmax(中央値[最小値〜最大値])は0.1667[0.067〜0.267]hrであった3)。
16.2 吸収
健康成人18例に本剤18μg及び36μgを単回吸入投与したときの絶対的生物学的利用率は、それぞれ61.52±18.26%及び74.05±15.72%であった4)(外国人データ)。
16.3 分布
16.3.1 分布容積
健康成人12例に本剤18μg及び36μgを単回吸入投与したときの消失相の見かけの分布容積(Vz/F)は、それぞれ35.59644±9.37359L及び40.57935±14.75002Lであった1)。
16.3.2 血漿蛋白結合率
In vitro試験において、トレプロスチニルのヒト血漿蛋白結合率は、96.1〜96.3%(平衡透析法)、91.0%(限外ろ過法)であり、結合率に濃度依存性は認められなかった5)。
16.4 代謝
16.5 排泄
健康成人24例にトレプロスチニルの注射剤を持続皮下投与又は持続静脈内投与(2.5、5、10又は15ng/kg/分、150分間)したとき、投与開始後48時間までに、未変化体及び未変化体のグルクロナイドとして、皮下投与ではそれぞれ投与量の5.4〜6.8%及び11.2〜15.0%、静脈内投与ではそれぞれ投与量の4.5〜6.1%及び11.0〜13.5%が尿中に排泄された8)。
健康成人6例に14Cで標識したトレプロスチニルの注射剤を持続皮下投与(15ng/kg/分、8時間)したとき、投与開始後224時間までに、投与放射能の78.6%が尿中に、13.4%が糞中に排泄された。尿中には、未変化体として投与放射能の3.7%が排泄され、5種の代謝物(3種のトレプロスチニル3-ヒドロキシオクチル側鎖の酸化体、未変化体のグルクロナイド、1種の構造未同定代謝物)が、それぞれ投与放射能の10.2〜15.5%排泄された9)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 本剤の有効成分であるトレプロスチニルの注射剤を用いた海外臨床試験の成績
(1)アセトアミノフェン
健康成人26例にアセトアミノフェン1000mgを6時間ごとに7回反復経口投与し、5回目の投与の後、トレプロスチニルの注射剤を15ng/kg/分で6時間併用持続皮下投与したとき、トレプロスチニルの薬物動態に影響は認められなかった12)(外国人データ)。
(2)ワルファリン
16.7.2 本剤の有効成分であるトレプロスチニルの経口剤を用いた海外臨床試験の成績
(1)ボセンタン
健康成人23例にトレプロスチニルの経口剤1mgを1日2回とボセンタン125mgを1日2回、4.5日間反復併用経口投与したとき、トレプロスチニル及びボセンタンの薬物動態に影響は認められなかった14)(外国人データ)。
(2)シルデナフィル
健康成人18例にトレプロスチニルの経口剤1mgを1日2回とシルデナフィル20mgを1日3回、4.5日間反復併用経口投与したとき、トレプロスチニル及びシルデナフィルの薬物動態に影響は認められなかった15)(外国人データ)。
(3)リファンピシン
(4)ゲムフィブロジル
(5)フルコナゾール
健康成人20例にフルコナゾールを7日間反復経口投与(1日目400mg、引き続き200mgを6日間)し、6日目にトレプロスチニルの経口剤1mgを併用経口投与したとき、AUCがやや低下したものの(14.6%低下)、トレプロスチニルの薬物動態に顕著な影響は認められなかった17)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<肺動脈性肺高血圧症>
17.1.1 国内第II/III相試験
肺動脈性肺高血圧症患者17例を対象とした非盲検非対照臨床試験において、本剤を1日4回吸入投与した。1回3吸入(18μg)から投与を開始し、忍容性を確認しながら最大1回9吸入(54μg)まで漸増した。治験期間を通じて、忍容性に問題があると認められた場合には、1回1吸入(6μg)までの減量を可能とした。
主要評価項目である投与12週時の肺血管抵抗係数の変化率及び副次評価項目である投与12週時の投与後10〜60分に評価した6分間歩行距離の開始時からの変化量に改善が認められた。
主要評価項目である投与12週時の肺血管抵抗係数の変化率及び副次評価項目である投与12週時の投与後10〜60分に評価した6分間歩行距離の開始時からの変化量に改善が認められた。
| 評価項目 | n | 開始時 | 変化量(12週時) | 変化率(12週時) |
| 肺血管抵抗係数a,b)(Wood単位・m2) | 17 | 11.621±2.670[10.248,12.994] | −4.675±2.999[−6.217,−3.133] | −39.43±25.53%[−52.55%,−26.30%] |
| 6分間歩行距離c,d)(m) | 17 | 487.8±112.4 525.0 | 24.8±34.2 34.0 | − |
副作用発現頻度は、100%(17/17例)であった。主な副作用は、頭痛58.8%(10/17例)、咳嗽47.1%(8/17例)、咽喉刺激感29.4%(5/17例)、ほてり23.5%(4/17例)であった2)。
17.1.2 海外第III相試験
肺動脈性肺高血圧症患者235例を対象とした無作為割付二重盲検プラセボ対照多国間多施設共同並行群間比較試験において、本剤を1日4回吸入投与した。1回3吸入(18μg)から投与を開始し、忍容性を確認しながら4週時までに最大1回9吸入(54μg)まで増量した。忍容性に問題があると認められた場合には、1回1吸入(6μg)までの減量を可能とした。
主要評価項目である投与12週時の投与後10〜60分に評価した6分間歩行距離の開始時からの変化量は、プラセボ投与群と比較して本剤投与群で有意に大きかった(ノンパラメトリックANCOVA、p=0.00044)。
主要評価項目である投与12週時の投与後10〜60分に評価した6分間歩行距離の開始時からの変化量は、プラセボ投与群と比較して本剤投与群で有意に大きかった(ノンパラメトリックANCOVA、p=0.00044)。
| 評価項目 | 投与群 | n | 開始時 | 変化量(12週時) | 差(Hodges-Lehmann推定値) |
| 6分間歩行距離a,b)(m) | 本剤 | 115 | 359.0[211〜450] | 21.6[−318〜135] | 20.0[8.0,32.8]c) |
| プラセボ | 120 | 361.0[204〜448] | 3.0[−303〜146] |
副作用発現頻度は、本剤投与群で76.5%(88/115例)であった。本剤投与群の主な副作用は、咳嗽51.3%(59/115例)、頭痛33.9%(39/115例)、浮動性めまい、悪心及び潮紅各14.8%(17/115例)、咽喉刺激感13.9%(16/115例)、口腔咽頭痛11.3%(13/115例)であった18)。
<間質性肺疾患に伴う肺高血圧症>
17.1.3 国内第II/III相試験
間質性肺疾患(気腫合併肺線維症を含む)に伴う肺高血圧症患者20例を対象とした非盲検非対照臨床試験において、本剤を1日4回吸入投与した。1回3吸入(18μg)から投与を開始し、忍容性を確認しながら最大1回12吸入(72μg)まで漸増した。治験期間を通じて、忍容性に問題があると認められた場合には、1回1吸入(6μg)までの減量を可能とした。なお、当該試験に組み入れられた患者の間質性肺疾患の臨床分類の内訳は、特発性間質性肺炎が12例、膠原病(結合組織病)に伴う間質性肺疾患が5例、気腫合併肺線維症が2例、慢性過敏性肺炎が1例であった。
主要評価項目である投与16週時の肺血管抵抗係数の変化率に改善が認められ、また、投与16週時の投与後10〜60分に評価した6分間歩行距離の開始時からの変化量(中央値)は、13.00mであった。
主要評価項目である投与16週時の肺血管抵抗係数の変化率に改善が認められ、また、投与16週時の投与後10〜60分に評価した6分間歩行距離の開始時からの変化量(中央値)は、13.00mであった。
| 評価項目 | n | 開始時 | 変化量(16週時) | 変化率(16週時) |
| 肺血管抵抗係数a,b)(Wood単位・m2) | 20 | 9.736±5.013[7.389,12.082] | −4.089±3.655[−5.799,−2.378] | −40.14±27.69%[−53.10%,−27.18%] |
| 6分間歩行距離c,d)(m) | 20 | 313.85±106.95 326.50 | 18.77±58.58 13.00 | − |
副作用発現頻度は、70.0%(14/20例)であった。主な副作用は、咳嗽50.0%(10/20例)、倦怠感及び血圧低下各10.0%(2/20例)であった。なお、重篤な副作用として、薬剤性肺炎5.0%(1/20例)の発現が認められ、投与中止により回復した3)。
17.1.4 海外第II/III相試験
間質性肺疾患(気腫合併肺線維症を含む)に伴う肺高血圧症患者326例を対象とした無作為割付二重盲検プラセボ対照多施設共同並行群間比較試験において、本剤を1日4回吸入投与した。1回3吸入(18μg)から投与を開始し、忍容性を確認しながら最大1回12吸入(72μg)まで増量した。忍容性に問題があると認められた場合には、1回1吸入(6μg)までの減量を可能とした。なお、当該試験に組み入れられた患者の間質性肺疾患の臨床分類の内訳は、特発性間質性肺炎が146例(プラセボ投与群81例、本剤投与群65例)、気腫合併肺線維症が82例(プラセボ投与群40例、本剤投与群42例)、膠原病(結合組織病)に伴う間質性肺疾患が72例(プラセボ投与群32例、本剤投与群40例)、慢性過敏性肺炎が19例(プラセボ投与群9例、本剤投与群10例)、職業性肺疾患(環境性肺疾患)が6例(プラセボ投与群1例、本剤投与群5例)、その他が1例(プラセボ投与群0例、本剤投与群1例)であった。
主要評価項目である投与16週時の投与後10〜60分に評価した6分間歩行距離の開始時からの変化量は、プラセボ投与群と比較して本剤投与群で有意に大きかった(ノンパラメトリックANCOVA、p=0.0043)。
主要評価項目である投与16週時の投与後10〜60分に評価した6分間歩行距離の開始時からの変化量は、プラセボ投与群と比較して本剤投与群で有意に大きかった(ノンパラメトリックANCOVA、p=0.0043)。
| 評価項目 | 投与群 | n | 開始時 | 変化量(16週時) | 差(Hodges-Lehmann推定値) |
| 6分間歩行距離a,b)(m) | 本剤 | 163 | 256.0[100〜538] | 6.0[−396〜183] | 21.0[7.0,37.0]c) |
| プラセボ | 163 | 260.0[30〜505] | −9.0[−426〜179] |
副作用発現頻度は、本剤投与群で76.7%(125/163例)であった。本剤投与群の主な副作用は、咳嗽41.1%(67/163例)、頭痛22.7%(37/163例)、呼吸困難16.6%(27/163例)、浮動性めまい13.5%(22/163例)、咽喉刺激感12.3%(20/163例)、下痢10.4%(17/163例)であった19)。
18. 薬効薬理
18.1 作用機序
プロスタサイクリンと同様に、トレプロスチニルは、血管拡張作用及び血小板凝集抑制作用により、肺動脈の収縮及び血栓形成を抑制し、肺動脈圧及び肺血管抵抗を低下させることで、肺動脈性肺高血圧症及び間質性肺疾患に伴う肺高血圧症に対する有効性を示すと考えられる。
18.2 肺高血圧症モデルにおける有効性
18.2.1 ウサギ摘出灌流肺に対して換気ガス中にトレプロスチニルを噴霧した結果、トロンボキサンA2誘導体による肺動脈圧の上昇を抑制した20)。
18.2.2 麻酔ラット及び麻酔ウサギに対してトレプロスチニルを吸入投与した結果、トロンボキサンA2誘導体による肺動脈圧の上昇を抑制した20)。
18.2.3 モノクロタリン誘発肺高血圧ラットに対してトレプロスチニルを吸入投与した結果、生存率の低下を抑制した20)。
18.2.4 麻酔ネコに対してトレプロスチニルを持続静脈内投与した結果、低酸素負荷による肺動脈圧及び肺血管抵抗の上昇を抑制した21)。
18.2.5 麻酔ブタ新生児に対してトレプロスチニルを急速静脈内投与した結果、低酸素負荷による肺動脈圧及び肺血管抵抗の上昇を抑制した22)。
18.3 血管拡張作用
18.3.1 トロンボキサンA2誘導体であるU-46619により収縮させたウサギ腸間膜動脈血管平滑筋を弛緩させた23)(in vitro)。
18.3.2 イヌ及びネコへの持続静脈内投与により、肺動脈圧、肺血管抵抗、血圧及び全末梢血管抵抗が低下した24)。
18.4 血小板凝集抑制作用
19. 有効成分に関する理化学的知見
19.1. トレプロスチニル
20. 取扱い上の注意
アルミ袋開封後は遮光して保存すること。[14.1参照]
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
アンプル
2.9mL×30管(1袋中に6管×5袋)
23. 主要文献
- 持田製薬社内資料:国内第I相試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.1)
- 持田製薬社内資料:国内第II/III相試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.8)
- 持田製薬社内資料:国内第II/III相試験(トレプロスト吸入液:2024年9月24日承認、CTD 2.7.6.2)
- 持田製薬社内資料:海外第I相(BA)試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.2)
- 持田製薬社内資料:薬物動態試験−トレプロスチニルのたん白結合の検討−(トレプロスト注射液:2014年3月24日承認、CTD 2.6.4.4.3)
- 持田製薬社内資料:薬物動態試験−トレプロスチニルの代謝に関する検討(in vitro)−(トレプロスト注射液:2014年3月24日承認、CTD 2.6.4.5)
- 持田製薬社内資料:薬物動態試験−In vitroにおけるヒト肝・肺ミクロソーム及びS9による代謝比較−(トレプロスト吸入液:2022年12月23日承認、CTD 2.6.4.5.1)
- 大森庸子 他, Prog.Med., 34 (2), 333-348, (2014)
- 持田製薬社内資料:海外臨床薬物動態試験−トレプロスチニルのマスバランス−(トレプロスト注射液:2014年3月24日承認、CTD 2.7.6.1.5)
- 持田製薬社内資料:海外第I相試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.5)
- 持田製薬社内資料:海外臨床薬物動態試験−肝機能障害患者におけるトレプロスチニルの薬物動態−(トレプロスト注射液:2014年3月24日承認、CTD 2.7.6.3.1)
- 持田製薬社内資料:海外臨床薬物動態試験−アセトアミノフェンとの薬物相互作用−(トレプロスト注射液:2014年3月24日承認、CTD 2.7.6.4.1)
- Wade,M.et al., J.Cardiovasc.Pharmacol., 41 (6), 908-915, (2003) »PubMed
- Gotzkowsky,S.K.et al., J.Clin.Pharmacol., 50 (7), 829-834, (2010) »PubMed
- 持田製薬社内資料:海外臨床薬物動態試験−シルデナフィルとの薬物相互作用−(トレプロスト注射液:2014年3月24日承認、CTD 2.7.6.4.4)
- 持田製薬社内資料:海外臨床薬物動態試験−リファンピシンとの薬物相互作用−(トレプロスト注射液:2014年3月24日承認、CTD 2.7.6.4.5)
- 持田製薬社内資料:海外臨床薬物動態試験−ゲムフィブロジル及びフルコナゾールとの薬物相互作用−(トレプロスト注射液:2014年3月24日承認、CTD 2.7.6.4.6)
- 持田製薬社内資料:海外第III相試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.6)
- 持田製薬社内資料:海外第II/III相試験(トレプロスト吸入液:2024年9月24日承認、CTD 2.7.6.1)
- 持田製薬社内資料:薬理試験−トレプロスチニル吸入投与における効力を裏付ける試験−(トレプロスト吸入液:2022年12月23日承認、CTD 2.6.2.2)
- 持田製薬社内資料:薬理試験−低酸素負荷によるネコ肺高血圧症モデルにおける有効性−(トレプロスト注射液:2014年3月24日承認、CTD 2.6.2.2.1)
- 持田製薬社内資料:薬理試験−低酸素負荷によるブタ肺高血圧症モデルにおける有効性−(トレプロスト注射液:2014年3月24日承認、CTD 2.6.2.2.1)
- 持田製薬社内資料:薬理試験−ウサギ摘出腸間膜動脈における血管拡張作用(in vitro)−(トレプロスト注射液:2014年3月24日承認、CTD 2.6.2.2.2)
- 持田製薬社内資料:薬理試験−イヌ及びネコにおける肺動脈圧及び肺血管抵抗に及ぼす影響−(トレプロスト注射液:2014年3月24日承認、CTD 2.6.2.2.2)
- 持田製薬社内資料:薬理試験−ヒト、ラット及びウサギ血小板凝集に及ぼす影響(in vitro及びin vivo)−(トレプロスト注射液:2014年3月24日承認、CTD 2.6.2.2.2)
- 持田製薬社内資料:薬理試験−イヌにおける冠動脈狭窄による冠血流量減少に及ぼす影響−(トレプロスト注射液:2014年3月24日承認、CTD 2.6.2.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
持田製薬株式会社
くすり相談窓口
〒160-8515
東京都新宿区四谷1丁目7番地
電話:03-5229-3906
0120-189-522
0120-189-522
FAX:03-5229-3955
製品情報問い合わせ先
持田製薬株式会社
くすり相談窓口
〒160-8515
東京都新宿区四谷1丁目7番地
電話:03-5229-3906
0120-189-522
0120-189-522
FAX:03-5229-3955
26. 製造販売業者等
26.1 製造販売元
持田製薬株式会社
東京都新宿区四谷1丁目7番地