医薬品情報
| 総称名 | アルファカルシドール |
|---|---|
| 一般名 | アルファカルシドール |
| 欧文一般名 | Alfacalcidol |
| 製剤名 | アルファカルシドール |
| 薬効分類名 | 活性型ビタミンD3製剤 |
| 薬効分類番号 | 3112 |
| ATCコード | A11CC03 |
| KEGG DRUG |
D01518
アルファカルシドール
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第2版)

|
4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アルファカルシドールカプセル0.25μg「フソー」 (後発品) | Alfacalcidol Capsules"FUSO" | 扶桑薬品工業 | 3112001M1267 | 6.1円/カプセル | 劇薬 |
| アルファカルシドールカプセル0.5μg「フソー」 (後発品) | Alfacalcidol Capsules"FUSO" | 扶桑薬品工業 | 3112001M2310 | 6.1円/カプセル | 劇薬 |
| アルファカルシドールカプセル1.0μg「フソー」 (後発品) | Alfacalcidol Capsules"FUSO" | 扶桑薬品工業 | 3112001M3308 | 6.1円/カプセル | 劇薬 |
4. 効能または効果
6. 用法及び用量
<効能共通>
本剤は患者の血清カルシウム濃度の十分な管理のもとに投与量を調整する。
<慢性腎不全、骨粗鬆症>
通常、成人1日1回アルファカルシドールとして0.5〜1.0μgを経口投与する。
ただし、年齢、症状により適宜増減する。
ただし、年齢、症状により適宜増減する。
<副甲状腺機能低下症、その他のビタミンD代謝異常に伴う疾患>
通常、成人1日1回アルファカルシドールとして1.0〜4.0μgを経口投与する。
ただし、疾患、年齢、症状、病型により適宜増減する。
ただし、疾患、年齢、症状、病型により適宜増減する。
(小児用量)
通常、小児に対しては骨粗鬆症の場合には1日1回アルファカルシドールとして0.01〜0.03μg/kgを、その他の疾患の場合には1日1回アルファカルシドールとして0.05〜0.1μg/kgを経口投与する。
ただし、疾患、症状により適宜増減する。
ただし、疾患、症状により適宜増減する。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 高リン血症のある患者
リン酸結合剤を併用し、血清リン値を下げること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で大量投与の場合、胎児化骨遅延等がみられている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で授乳による新生児への移行率は、母動物投与量の1/20に相当する。
9.7 小児等
血清カルシウム値等の観察を十分に行いながら少量から投与を開始し、漸増投与するなど、過量投与にならぬよう慎重に投与すること。幼若ラット経口投与における急性毒性は成熟ラットに比べ強くあらわれている。[8.2参照]
9.8 高齢者
用量に注意すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| マグネシウムを含有する製剤 酸化マグネシウム、炭酸マグネシウム等 | 高マグネシウム血症が起きたとの報告がある。 | 他のビタミンD誘導体と同様に腸管でのマグネシウムの吸収を促進させると考えられる。 |
| マグネシウムを含有する製剤 酸化マグネシウム、炭酸マグネシウム等 | ミルク・アルカリ症候群(高カルシウム血症、高窒素血症、アルカローシス等)があらわれるおそれがある。 | 血中マグネシウムの増加により代謝性アルカローシスが持続するため、尿細管でのカルシウム再吸収が増加する。 |
| ジギタリス製剤 ジゴキシン等 [8.1-8.3参照] | 不整脈があらわれるおそれがある。 | 本剤により高カルシウム血症が発症した場合、ジギタリス製剤の作用が増強される。 |
| カルシウム製剤 乳酸カルシウム水和物、炭酸カルシウム等 [8.1-8.3参照] | 高カルシウム血症があらわれるおそれがある。 | 本剤は腸管でのカルシウムの吸収を促進させる。 |
| ビタミンD及びその誘導体 カルシトリオール等 [8.1-8.3参照] | 高カルシウム血症があらわれるおそれがある。 | 相加作用による。 |
| PTH製剤 テリパラチド等 PTHrP製剤 アバロパラチド酢酸塩 [8.1-8.3参照] | 高カルシウム血症があらわれるおそれがある。 | 相加作用による。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 急性腎障害(頻度不明)
11.1.2 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、Al-Pの上昇等を伴う肝機能障害、黄疸があらわれることがある。
注)副作用の発現頻度は使用成績調査を含む
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 消化器 | 食欲不振、悪心・嘔気、下痢、便秘、胃痛 | 嘔吐、腹部膨満感、胃部不快感、消化不良、口内異和感、口渇等 |
| 精神神経系 | 頭痛・頭重、不眠・いらいら感、脱力・倦怠感、めまい、しびれ感、眠気、記憶力・記銘力の減退、耳鳴り、老人性難聴、背部痛、肩こり、下肢のつっぱり感、胸痛等 | |
| 循環器 | 軽度の血圧上昇、動悸 | |
| 肝臓 | AST、ALTの上昇 | LDH、γ-GTPの上昇 |
| 腎臓 | BUN、クレアチニンの上昇(腎機能の低下) | 腎結石 |
| 皮膚 | そう痒感 | 発疹、熱感 |
| 眼 | 結膜充血 | |
| 骨 | 関節周囲の石灰化(化骨形成) | |
| その他 | 嗄声、浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するように指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人にアルファカルシドールとして5μg注)単回経口投与した場合、血漿中1α,25-(OH)2D濃度は速やかに上昇し9時間後に最高値となり以後漸減した。その半減期は17.6時間であった1)。
16.1.2 生物学的同等性試験
<アルファカルシドールカプセル0.25μg「フソー」>
アルファカルシドールカプセル0.25μg「フソー」とアルファロールカプセル0.25μgを、クロスオーバー法によりそれぞれ20カプセル(アルファカルシドールとして5μg注))健康成人男子に絶食時単回経口投与して血清中1α,25(OH)2D3濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された2)。
| 判定パラメータ | 参考パラメータ | ||
| AUC0-48hr(pg・hr/mL) | Cmax(pg/mL) | tmax(hr) | |
| アルファカルシドールカプセル0.25μg「フソー」 | 2021.4(402.1) | 63.4(14.5) | 8.6(2.2) |
| アルファロールカプセル0.25μg | 2041.7(473.1) | 65.1(16.3) | 9.0(2.3) |
<アルファカルシドールカプセル0.5μg「フソー」>
アルファカルシドールカプセル0.5μg「フソー」とアルファロールカプセル0.5μgを、クロスオーバー法によりそれぞれ10カプセル(アルファカルシドールとして5μg注))健康成人男子に絶食時単回経口投与して血清中1α,25(OH)2D3濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | ||
| AUC0-48hr(pg・hr/mL) | Cmax(pg/mL) | tmax(hr) | |
| アルファカルシドールカプセル0.5μg「フソー」 | 1840.0(476.8) | 56.2(11.8) | 8.9(2.5) |
| アルファロールカプセル0.5μg | 2071.3(281.0) | 62.4(10.7) | 8.4(2.3) |
<アルファカルシドールカプセル1.0μg「フソー」>
アルファカルシドールカプセル1.0μg「フソー」とアルファロールカプセル1μgを、クロスオーバー法によりそれぞれ5カプセル(アルファカルシドールとして5μg注))健康成人男子に絶食時単回経口投与して血清中1α,25(OH)2D3濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された4)。
| 判定パラメータ | 参考パラメータ | ||
| AUC0-48hr(pg・hr/mL) | Cmax(pg/mL) | tmax(hr) | |
| アルファカルシドールカプセル1.0μg「フソー」 | 2002.4(312.4) | 60.9(11.0) | 8.4(2.1) |
| アルファロールカプセル1μg | 2015.8(363.6) | 62.4(12.4) | 8.6(2.2) |
血清中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
注)承認された最大用量は、1回4.0μgである。
17. 臨床成績
18. 薬効薬理
18.1 作用機序
18.1.1 作用の発現(アルファカルシドールの25位水酸化)
18.2 作用・効果
18.2.1 骨石灰化促進作用
ビタミンD欠乏あるいは低リン・高Ca食飼育ラットに対し、抗クル病作用、骨石灰化前線形成の促進作用を示す10)。
18.2.2 骨吸収作用・再構成作用
アルファカルシドールの活性型代謝産物1α,25-(OH)2D3は骨吸収作用及び骨再構成作用(軟骨細胞の骨細胞への増殖・分化)を有する11)(in vitro)。
18.2.3 骨形成促進作用
骨形態計測においてアルファカルシドール投与により、骨芽細胞を有する類骨面比率が増加し、骨芽細胞に直接作用して骨形成を促進することが示唆されている12)(ヒト骨粗鬆症)。
18.2.4 腸管におけるCa吸収作用
連日投与により、血清1α,25-(OH)2D値の上昇とともに低下している小腸でのCa吸収率を改善する13)(ヒト骨粗鬆症)。
18.2.5 血清Ca上昇作用
18.2.6 腎不全時の骨代謝改善作用
18.2.7 1α,25-(OH)2Dとの作用比較
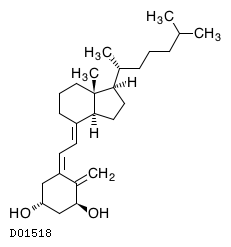
19. 有効成分に関する理化学的知見
19.1. アルファカルシドール
22. 包装
<アルファカルシドールカプセル0.25μg「フソー」>
(PTP)100カプセル[10カプセル×10]
(PTP)500カプセル[10カプセル×50]
<アルファカルシドールカプセル0.5μg「フソー」>
(PTP)100カプセル[10カプセル×10]
(PTP)500カプセル[10カプセル×50]
<アルファカルシドールカプセル1.0μg「フソー」>
(PTP)100カプセル[10カプセル×10]
(PTP)500カプセル[10カプセル×50]
23. 主要文献
- 東平靖雄 ほか, 骨代謝, 12, 152-162, (1979)
- 社内資料:生物学的同等性試験(0.25μg)
- 社内資料:生物学的同等性試験(0.5μg)
- 社内資料:生物学的同等性試験(1.0μg)
- 藤田拓男 ほか, 腎と透析, 5, 583-611, (1978)
- 藤田拓男 ほか, ホルモンと臨床, 27, 99-113, (1979) »PubMed
- 伊丹康人 ほか, 医学のあゆみ, 123, 958-973, (1982)
- Fukushima M.,et al., Biochem Biophys Res Commun., 66, 632-638, (1975) »PubMed
- 須田立雄 ほか, 診療と新薬, 15, 1295-1306, (1978)
- 須田立雄 ほか, 診療と新薬, 13, 1595-1617, (1976)
- 鈴木不二男, ビタミン, 56, 457-468, (1982) »DOI
- 渡辺正美 ほか, 整形外科基礎科学, 10, 175-180, (1983)
- 滋野長平 ほか, 日本内分泌学会雑誌, 58, 1473-1481, (1982) »DOI
- 鈴木正司 ほか, 診療と新薬, 15, 1355-1374, (1978)
- 福永仁夫 ほか, 診療と新薬, 15, 1521-1524, (1978)
- Kaneko C.,et al., Steroids., 23, 75-92, (1974) »PubMed
- Kanis JA.,et al., Br Med J., 1, 78-81, (1977) »PubMed
- Nishii Y.,et al., Endocrinology., 107, 319-27, (1980) »PubMed
- Fukushima M.,et al., Endocrinology., 107, 328-33, (1980) »PubMed
- 須田立雄, ビタミン, 54, 407-21, (1980) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
扶桑薬品工業株式会社
大阪市城東区森之宮二丁目3番11号
26.2 販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30