医薬品情報
| 総称名 | オファコル |
|---|---|
| 一般名 | コール酸 |
| 欧文一般名 | Cholic Acid |
| 製剤名 | コール酸カプセル |
| 薬効分類名 | 先天性胆汁酸代謝異常症治療薬 |
| 薬効分類番号 | 3999 |
| ATCコード | A05AA03 |
| KEGG DRUG |
D10699
コール酸
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 作成(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オファコルカプセル50mg | Orphacol Capsules 50mg | レクメド | 3999059M1020 | 12596円/カプセル | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
一次胆汁酸のアミノ酸抱合不全をきたす以下の欠損症は本剤の効果は期待できない。
○bile acid-CoA:amino acid N-acyltransferase(BAAT)欠損症
○bile acid CoA ligase(SLC27A5,BACL)欠損症
6. 用法及び用量
通常、コール酸として1日量5〜15mg/kgを1回又は数回に分けて食事中に経口投与する。なお、患者の状態に応じて適宜増減すること。
7. 用法及び用量に関連する注意
7.1 通常、本剤は1日1回又は1日2回に分けて投与するが、乳幼児等で必要な場合には1日3回以上に分けて投与できる。なお、投与の時間帯は原則一定とすること。
7.2 定期的に肝機能(AST、ALT、γ-GTP等)や総胆汁酸濃度等を確認し、用量調整を行うこと。また、必要に応じて、血清又は尿中の胆汁酸分画(コール酸や胆汁酸異常代謝産物を含む)の濃度も確認すること。
7.3 投与量の決定に際しては、以下の点も考慮の上で、各患者に対して適切な用量を決定すること。
○通常は1日投与量として500mgまでの範囲で用量調整が可能である。1日投与量として500mgを超える用量を投与する場合には肝機能(AST、ALT、γ-GTP等)や総胆汁酸濃度等を確認すること。
○先天性胆汁酸代謝異常症患者に対して1日750mgを超える投与経験は報告されていない。
8. 重要な基本的注意
8.1 肝機能障害があらわれることがあるので、定期的に肝機能検査を行うこと。また、重度の肝機能障害が認められた場合は、本剤の投与を中止すること。
8.2 本剤投与により効果が認められない場合には、漫然と投与しないこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 家族性IV型高脂血症を有する患者
回腸末端部に発現する胆汁酸トランスポーター(IBAT)の発現が低下しているとの報告があり1)、本剤を含む胆汁酸の取り込みが低下しているおそれがある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。健康な授乳婦28例における乳汁中コール酸濃度は、0.89μmol/L(平均値)であったことが報告されている5)。
9.7 小児等
新生児を対象とした臨床試験は実施されていない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| フェノバルビタール(フェノバール等)、プリミドン [16.7.1参照] | 肝毒性のある胆汁酸異常代謝産物が増加することで、肝トランスアミナーゼの上昇が認められることがあるので、これらの薬剤との併用は、治療上の有益性が危険性を上回る場合のみとすること。 | フェノバルビタールの投与により健康成人において内因性の一次胆汁酸(コール酸及びケノデオキシコール酸)のプールサイズ及び合成速度を増加させることが報告されている。フェノバルビタール、プリミドン(投与後その一部がフェノバルビタールへ代謝される)は、患者においてコレステロールから胆汁酸異常代謝産物の合成を促進する作用を有していると考えられることから、原疾患を悪化させるおそれがある。 |
| シクロスポリン [16.7.2参照] | 投与する場合、総胆汁酸濃度を慎重にモニタリングし、必要に応じて本剤の用量を調整すること。また、必要に応じて血清又は尿中における各胆汁酸(コール酸や胆汁酸異常代謝産物を含む)の濃度も確認すること。 | 胆汁酸の肝臓取込み及び肝胆汁分泌を阻害することから、本剤の薬物動態を変化させるおそれがある。 |
| コレスチラミン、コレスチミド | 本剤の効果が減弱するおそれがあるため、可能な限り間隔をあけて投与すること。 | 陰イオン交換樹脂であるこれらの薬剤は本剤を吸着するため、本剤の吸収が阻害されるおそれがある。 |
| 制酸剤 水酸化アルミニウムゲル等 | 本剤の効果が減弱するおそれがあるため、可能な限り間隔をあけて投与すること。 | アルミニウムを含有する制酸剤は本剤を吸着するため、本剤の吸収が阻害されるおそれがある。 |
| ウルソデオキシコール酸 [16.7.3参照] | 本剤及びウルソデオキシコール酸の効果が減弱するおそれがあるため、可能な限り間隔をあけて投与すること。 | 本剤及びウルソデオキシコール酸の吸収が競合するおそれがある。 |
| エロビキシバット | 本剤の効果が減弱するおそれがある。 | 回腸末端部に発現する胆汁酸トランスポーター(IBAT)阻害作用により、本剤の吸収が阻害されるおそれがある。 |
11. 副作用
11.2 その他の副作用
| 1%以上 | 0.1〜1%未満 | 頻度不明注1) | |
| 胃腸障害 | 下痢 | ||
| 肝胆道系障害 | 胆石症 | ||
| 皮膚および皮下組織障害 | そう痒症 | ||
| 臨床検査 | トランスアミナーゼ上昇 | ||
| 代謝および栄養障害 | 低カルシウム血症 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
日本人先天性胆汁酸代謝異常症患者(3β-ヒドロキシ-Δ5-ステロイドデヒドロゲナーゼ(以下、「3β-HSD」)2例、Δ4-3-オキソステロイド-5β-リダクターゼ(以下、「Δ4-3-oxoR」)2例の計4名)に本剤5〜15mg/kg/日を26週間経口投与したとき、いずれの患者においても、本剤投与前と比較して、血清中コール酸(投与前:0.00〜0.57μmol/L、投与26週時:1.58〜4.68μmol/L)及びデオキシコール酸(投与前:0.00〜0.13μmol/L、投与26週時:0.05〜3.52μmol/L)濃度が増加した6)。
16.2 吸収
16.3 分布
コール酸及びタウロコール酸のヒト血清におけるタンパク結合率は90〜95%(血清中コール酸として0.31μmol/L未満)及び46〜49.5%(血清中タウロコール酸として0.12〜0.72μmol/L)であった9)。
16.4 代謝
コール酸は、肝臓においてbile acid-CoA synthase、bile acid-CoA amino acid N-acetyltransferase等によりアミノ酸(タウリン又はグリシン)抱合される。小腸内へ分泌された後、回腸末端部から再吸収されなかったアミノ酸抱合型コール酸(タウロコール酸、グリココール酸)は、腸内細菌によるアミノ酸の脱抱合、脱水酸化によってデオキシコール酸へと変換される。
16.5 排泄
腸管から吸収されなかった胆汁酸(コール酸及びデオキシコール酸等)は糞中へと排泄される。
16.7 薬物相互作用
16.7.1 フェノバルビタール
16.7.2 シクロスポリン
16.7.3 ウルソデオキシコール酸
回腸瘻を施した外国人被験者8例を対象に、ウルソデオキシコール酸500mgを単回経口投与したとき、投与後8時間までの回腸におけるコール酸量(平均値±標準誤差)は、ウルソデオキシコール酸投与前で327±91μmol、投与後で517±96μmolと増加した13)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
先天性胆汁酸代謝異常症患者4例(Δ4-3-oxoR欠損症及び3β-HSD欠損症各2例)を対象に、本剤5〜15mg/kg/日(1日投与量として50mg〜500mg)を1日1〜2回に分けて食事と共に、74週間経口投与した。
主な有効性の評価項目は表2のとおりであった。なお、4例全例が本剤投与開始前までケノデオキシコール酸による治療を受けていた症例であった。
主な有効性の評価項目は表2のとおりであった。なお、4例全例が本剤投与開始前までケノデオキシコール酸による治療を受けていた症例であった。
| 被験者 | 被験者1 | 被験者2 | 被験者3 | 被験者4 |
| 欠損症 | Δ4-3-oxoR欠損症 | Δ4-3-oxoR欠損症 | 3β-HSD欠損症 | 3β-HSD欠損症 |
| 尿中異常代謝産物(mmol/molCr):主要評価項目 | ||||
| ベースライン | 3.33 | 2.65 | 1.84 | 139.44 |
| 投与26週 | 1.56 | 18.06 | 14.57 | 7.72 |
| 投与74週 | 3.61 | 5.14 | 3.30 | 17.86 |
| 血清中異常代謝産物(μmol/L) | ||||
| ベースライン | 0.50 | 0.18 | 2.34 | 36.99 |
| 投与26週 | 0.20 | 2.12 | 9.08 | 1.69 |
| 投与74週 | 1.12 | 4.03 | 7.20 | 12.71 |
| 血清中AST(U/L) | ||||
| ベースライン | 20 | 26 | 28 | 228 |
| 投与26週 | 23 | 27 | 21 | 56 |
| 投与74週 | 48 | 22 | 20 | 44 |
| 血清中ALT(U/L) | ||||
| ベースライン | 10 | 21 | 34 | 197 |
| 投与26週 | 15 | 14 | 18 | 31 |
| 投与74週 | 26 | 10 | 14 | 14 |
認められた副作用は低カルシウム血症1例であった6)。
18. 薬効薬理
18.1 作用機序
先天性胆汁酸代謝異常症の患者では、コレステロールから胆汁酸に代謝されるまでの生合成経路におけるいずれかの酵素の欠損により、胆汁酸の生成まで反応が進まず、毒性の強い中間代謝産物(異常胆汁酸等)が蓄積されることにより肝機能障害が生じる。また、コール酸の不足により、胆汁酸生合成経路の律速酵素であるcholesterol 7α-hydroxylase(CYP7A1)に対する負のフィードバック制御が機能せず、胆汁酸生合成経路が亢進し、異常な中間代謝産物がさらに増加する。本剤の経口投与は、肝臓においてCYP7A1をダウンレギュレーションさせ、異常な中間代謝産物の産生を抑制する14)。さらに、胆汁流量を増加させ、異常な中間代謝産物やビリルビン等の肝クリアランスを促進する。また、コール酸の不足により吸収が低下する脂溶性ビタミンと脂肪の吸収を促進する。
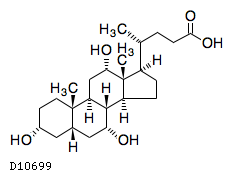
19. 有効成分に関する理化学的知見
19.1. コール酸
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、再審査期間中の全投与症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
60カプセル[10カプセル(PTP)×6]
23. 主要文献
- Duane,W.C.et al., J Lipid Res., 41, 1384-1389, (2000) »PubMed
- Perez,R.,et al., Res Exp Med., 194, 63-67, (1994)
- Campos,G.A.,et al., Acta Obstet Gynecol Scand., 65, 23-26, (1986) »PubMed
- Siviero,I.,et al., Pediatr Surg Int., 24, 325-331, (2008) »PubMed
- Forsyth,J.S.,et al., Eur J Pediatr., 140, 126-127, (1983) »PubMed
- 社内資料:国内第III相試験(承認年月日:2023年3月27日、CTD2.7.4.2.1.1.1)
- Ryu,H.,et al., Pharmaceuticals., 14, 654-670, (2021) »PubMed
- Weiner,I.M.,et al., Am J Physiol., 202, 155-157, (1962) »PubMed
- Burke,C.W.,et al., Clin Chim Acta., 32, 207-214, (1971) »PubMed
- Miller,N.E.&Nestel,P.J., Clin Sci Mol Med., 45, 257-262, (1973) »PubMed
- Azer,S.A.&Stacy,N.H., Toxicol Appl Pharmacol., 124, 302-309, (1994) »PubMed
- Barth,A.,et al., Exp Toxicol Pathol., 58, 31-37, (2006) »PubMed
- Stiehl,A.,et al., Gastroenterol., 98, 424-428, (1990) »PubMed
- Setchell K.D.,et al., Cambridge University Press., 736-766, (2007)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社レクメド
〒194-0022
東京都町田市森野一丁目7番23号
電話:042-732-2209
FAX:042-732-2208
製品情報問い合わせ先
株式会社レクメド
〒194-0022
東京都町田市森野一丁目7番23号
電話:042-732-2209
FAX:042-732-2208
25. 保険給付上の注意
本剤は新医薬品であるため、厚生労働省告示第107号(平成18年3月6日付)に基づき、2024年5月末日までは、投薬は1回14日分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
株式会社レクメド
〒194-0022
東京都町田市森野一丁目7番23号