医薬品情報
| 総称名 | リルゾール |
|---|---|
| 一般名 | リルゾール |
| 欧文一般名 | Riluzole |
| 製剤名 | リルゾール錠 |
| 薬効分類名 | 筋萎縮性側索硬化症用剤 |
| 薬効分類番号 | 1190 |
| ATCコード | N07XX02 |
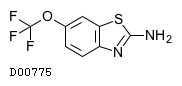
| KEGG DRUG |
D00775
リルゾール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年4月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リルゾール錠50mg「ニプロ」 (後発品) | Riluzole Tablets | ニプロ | 1190011F1056 | 383.5円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
5.1 努力性肺活量が理論正常値の60%未満に低下している患者では効果が期待できないので、投与を行わないこと。
5.2 米国神経学会の勧告では、下記の(1)〜(4)を満たす患者への適用を推奨するとされている。
(1)World Federation of Neurology(WFN;世界神経学会)の基準(他の原因によって進行性筋萎縮となった場合は除く)で“definite”または“probable”であること
(2)罹病期間が5年未満であること
(3)努力性肺活量が理論正常値の60%以上であること
(4)気管切開未実施例であること
6. 用法及び用量
通常、成人には本剤を1回1錠、1日2回(朝及び夕食前)、リルゾールとして1日量100mg(本剤2錠)を経口投与する。
8. 重要な基本的注意
8.1 本剤を投与する場合は本剤の有効性及び安全性にかかる以下の事項について、患者又は患者に十分な同意の能力がない場合は代諾者に説明し、本剤投与にあたっての同意を得ること。
・国内第3相二重盲検試験における安全性は18ヵ月の期間で確認された。[17.1.1参照]
8.2 本剤は肝疾患の既往歴のない患者でも血清トランスアミナーゼ等(AST、ALT、γ-GTP、ビリルビン等)を上昇させることがあるので、本剤の投与に際しては、適応患者の選択を適切に行うこと。なお、本剤投与前及び投与中はALTを含むトランスアミナーゼを定期的に測定することが望ましく、また、ALTの上昇がみられた場合には、より頻回にALTを測定し、必要ならば、投与中止を検討すること。
海外でのALS患者約800例を対象とした試験より、ALTについては約8%に正常値上限の3倍以上、約2%に正常値上限の5倍以上の上昇がみられた。[2.1、9.3.1、9.3.2、11.1.4参照]
海外でのALS患者約800例を対象とした試験より、ALTについては約8%に正常値上限の3倍以上、約2%に正常値上限の5倍以上の上昇がみられた。[2.1、9.3.1、9.3.2、11.1.4参照]
8.3 赤血球数の減少がみられることがあるので、本剤投与前及び投与中は赤血球数を測定することが望ましい。
8.4 増量しても効果の増強は期待できず、また副作用の頻度及び程度が増大するおそれがあるので、定められた用量を守ること。
8.5 本剤の投与中に、めまい又は眠気が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 発熱を有し、感染症が疑われる患者
好中球減少があらわれることがある。[11.1.2参照]
9.2 腎機能障害患者
腎機能が低下している患者を対象とした臨床試験は実施していない。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
9.3.2 肝機能異常の既往歴のある患者又は肝機能障害のある患者(重篤な肝機能障害のある患者を除く)
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。ラット妊娠前及び妊娠初期投与試験において、高用量投与時(15mg/kg/日)に胎児の骨化遅延が、また、ラット及びウサギの器官形成期投与試験において、胎児に軽度の外表及び内臓異常が用量非依存的に認められたとの報告がある。[2.3参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
副作用の発現に注意すること。一般に生理機能(肝機能等)が低下していることが多い。
10. 相互作用
10.2 併用注意
| CYP1A2阻害剤 テオフィリン、カフェイン、クロミプラミン、アミトリプチリン、イミプラミン、ジクロフェナク、ニューキノロン系薬剤のエノキサシン水和物等 | 慎重に投与 | ヒト肝ミクロソームを用いたin vitro試験においてチトクロームP-450の分子種であるCYP1A2はリルゾールの酸化的代謝を伴う主要な酵素であることが示唆されており、これらの薬剤は、本剤の排泄を遅延させる可能性がある1)。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
血管浮腫、呼吸困難、喘鳴、発汗等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.2 好中球減少
重篤な好中球減少(0.1%未満)の報告があるので、発熱が認められた場合には直ちに白血球数を測定し、好中球減少が認められた場合には投与を中止すること。[9.1.1参照]
11.1.3 間質性肺炎(0.1%)
発熱、咳嗽、呼吸苦等の呼吸器症状があらわれた場合には、速やかに胸部X線等の検査を実施し適切な処置を行うこと。
11.1.4 肝機能障害(0.2%)、黄疸(0.1%)
11.2 その他の副作用
| 5%以上注1) | 1〜5%未満 | 0.1〜1%未満 | 0.1%未満 | 頻度不明 | |
| 肝臓 | AST上昇、ALT上昇 | γ-GTP上昇、Al-P上昇、総ビリルビン上昇 | |||
| 消化器 | 悪心・嘔吐、食欲不振、便秘、下痢、腹痛 | 味覚障害、膵炎注2)、アミラーゼ上昇 | |||
| 精神神経系 | めまい | 口内・舌のしびれ感、傾眠、不眠症、うつ、口周囲感覚異常、筋緊張亢進 | 不安 | ||
| 血液 | 赤血球減少、ヘモグロビン減少、ヘマトクリット値減少 | ||||
| 腎臓 | BUN上昇、尿蛋白上昇 | ||||
| 皮膚 | 発疹 | そう痒 | |||
| 循環器 | 頻脈 | ||||
| 筋・骨格系 | 筋痙攣、背部痛 | 関節炎 | |||
| その他 | 無力感 | 頭痛、倦怠感、発熱、浮腫 | 疼痛、頭重 | 体重減少 |
13. 過量投与
過量投与時に、急性中毒性脳症による昏迷、昏睡、その他の神経系及び精神系の症状、メトヘモグロビン血症が発現したとの報告がある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本邦の臨床試験において、術後大腸癌に対しカルモフールを併用していた例で死亡例が1例報告されている。
15.1.2 海外の臨床試験において、ヘモグロビン及びヘマトクリット値の減少はリルゾール投与群で多く見られた。
15.2 非臨床試験に基づく情報
15.2.1 動物実験(イヌ)において溶血性貧血が報告されている。
15.2.2 多くの遺伝毒性試験が行われており、ほとんどの試験で陰性の結果が得られている。ただし、マウスリンパ腫細胞を用いた一部の試験で陽性の結果が得られている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人男子8例にリルゾール50mg注)を空腹時単回経口投与した時の最高血漿中濃度(Cmax)などは下表のとおりであった2)。
| Cmax(ng/mL) | tmax(hr) | t1/2(hr) | AUC(ng・hr/mL) |
| 149.46±63.37 | 0.81±0.26 | 5.64±2.23 | 613.12±263.52 |
16.1.2 生物学的同等性試験
リルゾール錠50mg「ニプロ」とリルテック錠50のそれぞれ1錠(リルゾールとして50mg)を、クロスオーバー法により健康成人男子に絶食単回経口投与して血漿中リルゾール濃度を測定した。得られた薬物動態パラメータ(AUC0→24hr、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→24hr(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| リルゾール錠50mg「ニプロ」 | 1035±461 | 334±204 | 0.8±0.5 | 7.52±1.23 |
| リルテック錠50 | 1098±464 | 342±180 | 0.9±0.6 | 7.81±1.71 |
血漿中リルゾール濃度推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第3相臨床試験
全国48施設で実施された第3相二重盲検試験(総投与例数:リルゾール100mg/日投与群101例、プラセボ投与群99例)において、プライマリ・エンドポイントである「一定の病勢進展」又は「死亡」までの期間について、プラセボに対するリルゾールの有効性は検証されなかった(リルゾールの臨床試験期間(18ヵ月)において、プライマリ・エンドポイントを「死亡」とした場合の生存率は、リルゾール群63.3%)。
安全性について、98例中67例(68.4%)に副作用がみとめられた。主な副作用はALT増加29件(29.6%)、AST増加24件(24.5%)、γ-GTP増加及び赤血球数減少各15件(15.3%)であった6)7)。[8.1参照]
安全性について、98例中67例(68.4%)に副作用がみとめられた。主な副作用はALT増加29件(29.6%)、AST増加24件(24.5%)、γ-GTP増加及び赤血球数減少各15件(15.3%)であった6)7)。[8.1参照]
17.1.2 海外臨床試験
海外では、「死亡」あるいは「レスピレータ装着のための挿管又は気管切開」までの期間(生存期間)をプライマリ・エンドポイントとした、2つのpivotalな試験が実施された。
7施設で実施された二重盲検試験(総症例数:リルゾール100mg/日投与群77例、プラセボ投与群78例)の結果、生存期間の中央値は全症例に対してリルゾール群532日、プラセボ群は449日、球発症型症例に対してそれぞれ476日、239日であり、統計学的な有意差は認められないもののリルゾール投与群の生存期間が長かった8)。
7ヵ国(米国、フランス、カナダ、イギリス、ベルギー、ドイツ、スペイン)で実施された二重盲検試験(総症例数:リルゾール50mg/日投与注1)群237例、100mg/日投与群236例、200mg/日投与注1)群244例、プラセボ投与群242例)の結果、18ヵ月後もしくは試験打ち切り日における生存率はリルゾール50mg群55.3%、100mg群56.8%、200mg群57.8%、プラセボ群50.4%であり、統計学的な有意差は認められないもののリルゾール100mg群はプラセボ群よりも生存率が高かった(層別Log-rank検定、両側p=0.076)。また、リルゾールの全投与量群を合わせた生存率は56.6%であり、プラセボ群との間に有意な差が認められた(層別Log-rank検定、両側p=0.048)9)。
7施設で実施された二重盲検試験(総症例数:リルゾール100mg/日投与群77例、プラセボ投与群78例)の結果、生存期間の中央値は全症例に対してリルゾール群532日、プラセボ群は449日、球発症型症例に対してそれぞれ476日、239日であり、統計学的な有意差は認められないもののリルゾール投与群の生存期間が長かった8)。
7ヵ国(米国、フランス、カナダ、イギリス、ベルギー、ドイツ、スペイン)で実施された二重盲検試験(総症例数:リルゾール50mg/日投与注1)群237例、100mg/日投与群236例、200mg/日投与注1)群244例、プラセボ投与群242例)の結果、18ヵ月後もしくは試験打ち切り日における生存率はリルゾール50mg群55.3%、100mg群56.8%、200mg群57.8%、プラセボ群50.4%であり、統計学的な有意差は認められないもののリルゾール100mg群はプラセボ群よりも生存率が高かった(層別Log-rank検定、両側p=0.076)。また、リルゾールの全投与量群を合わせた生存率は56.6%であり、プラセボ群との間に有意な差が認められた(層別Log-rank検定、両側p=0.048)9)。
17.2 製造販売後調査等
17.2.1 使用成績調査
17.2.2 特別調査
海外第3相二重盲検試験の被験者と同様の患者注2)を対象とした観察期間18ヵ月の特別調査(有効性解析対象症例781例)において、「死亡」又は「気管切開を伴うレスピレータ装着」をイベントと定義した場合のイベント非発生率は64.9%であった。また、「死亡」をイベントと定義した場合のイベント非発生率は73.6%であった。
安全性解析対象症例826例中、232例(28.1%)に副作用(臨床検査値異常を含む)が認められ、主な副作用はALT上昇89件(10.8%)、AST上昇79件(9.6%)、γ-GTP上昇36件(4.4%)、悪心35件(4.2%)等であった。また、18ヵ月を超えて投与した233例において、副作用発現率は、26.6%であった10)。
安全性解析対象症例826例中、232例(28.1%)に副作用(臨床検査値異常を含む)が認められ、主な副作用はALT上昇89件(10.8%)、AST上昇79件(9.6%)、γ-GTP上昇36件(4.4%)、悪心35件(4.2%)等であった。また、18ヵ月を超えて投与した233例において、副作用発現率は、26.6%であった10)。
注1)本剤の筋萎縮性側索硬化症に対し承認されている用法・用量は100mg/日、1日2回である。
注2)下記、[1]〜[5]を満たす患者
[1]18歳以上75歳以下であること
[2]World Federation of Neurologyの基準(他の原因によって進行性萎縮となった場合は除く)で、“definite”又は“probable”であること
[3]罹病期間が5年未満であること
[4]調査開始時点より2ヵ月以内の努力性肺活量が理論正常値の60%以上であること
[5]気管切開未実施例であること
18. 薬効薬理
18.1 作用機序
本剤の作用機序は完全には解明されていないが、各種in vitro、in vivoの試験において、グルタミン酸遊離阻害、興奮性アミノ酸受容体との非競合的な阻害、電位依存性Na+チャネルの阻害等の作用を有しており、これらが単独あるいは複合して神経細胞保護作用を発現するものと考えられる11)。
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. リルゾール
20. 取扱い上の注意
アルミピロー開封後は遮光して保存すること。
22. 包装
56錠[14錠(PTP)×4]
23. 主要文献
- Sanderink,G-J.,et al., J.Pharmacol.Exp.Ther., 282 (3), 1465-1472, (1997) »PubMed
- 丁 宗鉄 他, 臨床医薬, 12 (5), 795-807, (1996)
- 社内資料:生物学的同等性試験
- 丁 宗鉄 他, 臨床医薬, 12 (5), 809-827, (1996)
- Le Liboux,A.,et al., J.Clin.Pharmacol., 37 (9), 820-827, (1997) »PubMed
- 柳澤信夫 他, 医学のあゆみ, 182 (11), 851-866, (1997)
- 使用成績調査の概要(リルテック錠:2012年3月26日承認、再審査報告書)
- Bensimon,G.,et al., N.Engl.J.Med., 330 (9), 585-591, (1994) »PubMed
- Lacomblez,L.,et al., Lancet, 347 (9013), 1425-1431, (1996) »PubMed
- 特定使用成績調査の概要(リルテック錠:2012年3月26日承認、再審査報告書)
- Doble,A., Rev.Contemp.Pharmacother., 8 (4), 213-225, (1997)
- Couratier,P.,et al., Neuro Report, 5 (8), 1012-1014, (1994) »PubMed
- Gurney,M.E.,et al., Ann.Neurol., 39 (2), 147-157, (1996) »PubMed
- Rothstein,J.D.,et al., J.Neurochem., 65 (2), 643-651, (1995) »PubMed
- Estevez,A.G.,et al., Eur.J.Pharmacol., 280 (1), 47-53, (1995) »PubMed
- Malgouris,C.,et al., Neurosci.Lett., 177 (1-2), 95-99, (1994) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ニプロ株式会社
医薬品情報室
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:0120-226-898
FAX:050-3535-8939
製品情報問い合わせ先
ニプロ株式会社
医薬品情報室
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:0120-226-898
FAX:050-3535-8939
26. 製造販売業者等
26.1 製造販売元
ニプロ株式会社
大阪府摂津市千里丘新町3番26号