医薬品情報
| 総称名 | リットフーロ |
|---|---|
| 一般名 | リトレシチニブトシル酸塩 |
| 欧文一般名 | Ritlecitinib Tosilate |
| 製剤名 | リトレシチニブトシル酸塩カプセル |
| 薬効分類名 | JAK3/TECファミリーキナーゼ阻害剤 |
| 薬効分類番号 | 3999 |
| ATCコード | L04AF08 |
| KEGG DRUG |
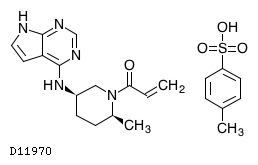
D11970
リトレシチニブトシル酸塩
|
| KEGG DGROUP |
DG02020
JAK阻害薬
DG01985
疾患修飾性抗リウマチ薬 (DMARD)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リットフーロカプセル50mg | Litfulo capsules | ファイザー | 3999060M1022 | 5584.3円/カプセル | 劇薬, 処方箋医薬品注) |
1. 警告
1.1 本剤投与により、肺炎、敗血症、ウイルス感染等による重篤な感染症の新たな発現もしくは悪化等が報告されており、本剤との関連性は明らかではないが、悪性腫瘍の発現も報告されている。本剤が疾病を完治させる薬剤でないことも含め、これらの情報を患者に十分説明し、患者が理解したことを確認した上で、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
また、本剤投与により重篤な副作用が発現し、致命的な経過をたどることがあるので、緊急時の対応が十分可能な医療施設及び医師が使用し、本剤投与後に副作用が発現した場合には、主治医に連絡するよう患者に注意を与えること。[2.2、2.3、8.1-8.3、8.9、9.1.1、9.1.2、9.1.5、11.1.1、15.1.1、15.1.2参照]
また、本剤投与により重篤な副作用が発現し、致命的な経過をたどることがあるので、緊急時の対応が十分可能な医療施設及び医師が使用し、本剤投与後に副作用が発現した場合には、主治医に連絡するよう患者に注意を与えること。[2.2、2.3、8.1-8.3、8.9、9.1.1、9.1.2、9.1.5、11.1.1、15.1.1、15.1.2参照]
1.2 感染症
1.2.1 重篤な感染症
1.2.2 結核
ヤヌスキナーゼ(JAK)阻害剤において、播種性結核(粟粒結核)及び肺外結核(脊椎、リンパ節等)を含む結核が報告されている。結核の既感染者では症状の顕在化及び悪化のおそれがあるため、本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加え、インターフェロン-γ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。結核の既往歴を有する患者及び結核の感染が疑われる患者には、結核等の感染症について診療経験を有する医師と連携の下、原則として本剤の投与開始前に適切な抗結核薬を投与すること。
JAK阻害剤において、ツベルクリン反応等の検査が陰性の患者に投与後活動性結核が認められた例も報告されている。[2.3、8.2、9.1.2、11.1.1参照]
JAK阻害剤において、ツベルクリン反応等の検査が陰性の患者に投与後活動性結核が認められた例も報告されている。[2.3、8.2、9.1.2、11.1.1参照]
1.3 本剤についての十分な知識と適応疾患の治療の知識・経験をもつ医師が使用すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.9 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
円形脱毛症(ただし、脱毛部位が広範囲に及ぶ難治の場合に限る)
5. 効能または効果に関連する注意
5.1 本剤投与開始時に、頭部全体の概ね50%以上に脱毛が認められ、過去6ヵ月程度毛髪に自然再生が認められない患者に投与すること。
5.2 円形脱毛症以外の脱毛症に対する適応はない。
6. 用法及び用量
通常、成人及び12歳以上の小児には、リトレシチニブとして50mgを1日1回経口投与する。
7. 用法及び用量に関連する注意
7.1 免疫抑制作用が増強されると感染症のリスクが増加することが予想されるので、本剤と免疫調整生物製剤、他の経口JAK阻害剤、シクロスポリン等の強力な免疫抑制剤との併用はしないこと。本剤とこれらの薬剤との併用経験はない。
7.2 本剤による治療反応は、通常投与開始から48週までには得られる。48週までに治療反応が得られない場合は、投与中止を考慮すること。
8. 重要な基本的注意
8.1 本剤は、免疫反応に関与するJAK3及びtyrosine kinase expressed in hepatocellular carcinoma(TEC)ファミリーキナーゼを阻害するので、感染症に対する宿主免疫能に影響を及ぼす可能性がある。本剤の投与に際しては十分な観察を行い、感染症の発現や増悪に注意すること。また、患者に対し、発熱、倦怠感等があらわれた場合には、速やかに主治医に相談するよう指導すること。[1.1、1.2.1、2.2、9.1.1、9.1.5、11.1.1参照]
8.2 本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加え、インターフェロン-γ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。本剤投与中は胸部X線検査等の適切な検査を定期的に行うなど結核の発現には十分に注意し、患者に対し、結核を疑う症状が発現した場合(持続する咳、発熱等)には速やかに主治医に連絡するよう説明すること。[1.1、1.2.2、2.3、9.1.2、11.1.1参照]
8.3 ヘルペスウイルスを含むウイルスの再活性化(帯状疱疹、口腔ヘルペス等)が報告されていることから、ヘルペスウイルス等の再活性化の徴候や症状の発現に注意すること。徴候や症状の発現が認められた場合には、患者に受診するよう説明し、本剤の投与を中断し速やかに適切な処置を行うこと。また、ヘルペスウイルス以外のウイルスの再活性化にも注意すること。[1.1、1.2.1、11.1.1参照]
8.4 JAK阻害剤によるB型肝炎ウイルスの再活性化が報告されているので、本剤投与に先立って、B型肝炎ウイルス感染の有無を確認すること。[9.1.3参照]
8.5 感染症発現のリスクを否定できないので、本剤開始直前及び投与中の生ワクチンの接種は行わないこと。
8.6 好中球減少、リンパ球減少、ヘモグロビン減少及び血小板減少があらわれることがあるので、本剤投与開始前及び投与開始後は定期的に好中球数、リンパ球数、ヘモグロビン値及び血小板数を確認すること。[2.5-2.8、9.1.6-9.1.9、11.1.2参照]
8.7 総コレステロール、LDLコレステロール及びトリグリセリドの上昇等の脂質検査値異常があらわれることがある。本剤投与開始後は定期的に脂質検査値を確認すること。臨床上必要と認められた場合には、脂質異常症治療薬の投与等の適切な処置を行うこと。
8.8 肝機能障害があらわれることがあるので、トランスアミナーゼ値上昇に注意するなど観察を十分に行うこと。[11.1.4参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.2 結核の既感染者(特に結核の既往歴のある患者及び胸部レントゲン上結核治癒所見のある患者)又は結核感染が疑われる患者
(1)結核の既感染者では、結核を活動化させるおそれがある。
9.1.3 B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)
肝機能検査値やHBV DNAのモニタリングを行うなど、B型肝炎ウイルスの再活性化の徴候や症状の発現に注意すること。JAK阻害剤を投与されたB型肝炎ウイルスキャリアの患者又は既往感染者において、B型肝炎ウイルスの再活性化が報告されている。なお、HBs抗原陽性、又はHBs抗原陰性かつHBc抗体陽性かつHBs抗体陰性、又はHBV DNA陽性の患者は臨床試験では除外されている。[8.4参照]
9.1.4 C型肝炎患者
HCV抗体陽性及びHCV RNA陽性の患者は臨床試験では除外されている。
9.1.5 易感染性の状態にある患者
9.1.6 好中球減少(好中球数1,000/mm3未満を除く)のある患者
9.1.7 リンパ球減少(リンパ球数500/mm3未満を除く)のある患者
9.1.8 ヘモグロビン値減少(ヘモグロビン値8.0g/dL未満を除く)のある患者
9.1.9 血小板減少(血小板数100,000/mm3未満を除く)のある患者
9.1.10 静脈血栓塞栓症のリスクを有する患者[11.1.3参照]
9.3 肝機能障害患者
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び最終投与後1ヵ月間において避妊する必要性及び適切な避妊法について説明すること。
9.5 妊婦
9.6 授乳婦
本剤投与中は授乳しないことが望ましい。ラットで乳汁中へ移行することが報告されている2)。
9.7 小児等
12歳未満の小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤はCYP3Aに対する中程度の阻害作用及びCYP1A2に対する阻害作用を有する。[16.7.2参照]
薬物代謝酵素用語
CYP3A
薬物代謝酵素用語
CYP1A2
10.2 併用注意
| CYP3Aの基質となる薬剤 ミダゾラム等 [16.7.2参照] | CYP3A基質であり、安全域が狭く、血中濃度の上昇により重篤な副作用が発現する可能性のある薬剤と併用する場合には慎重に投与し、必要に応じて減量を考慮すること。 | 本剤がCYP3Aを阻害することにより、これらの薬剤の血中濃度が上昇する可能性がある。 |
| CYP1A2の基質となる薬剤 テオフィリン等 | CYP1A2基質であり、安全域が狭く、血中濃度の上昇により重篤な副作用が発現する可能性のある薬剤と併用する場合には慎重に投与し、必要に応じて減量を考慮すること。 | 本剤がCYP1A2を阻害することにより、これらの薬剤の血中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 感染症
11.1.2 リンパ球減少(1.6%)、血小板減少(0.3%)、ヘモグロビン減少(0.2%)、好中球減少(0.2%)
リンパ球数
本剤投与開始後、500/mm3未満となった場合には、500/mm3以上に回復するまで休薬すること。
血小板数
本剤投与開始後、100,000/mm3未満となった場合には、100,000/mm3以上に回復するまで休薬すること。
ヘモグロビン値
本剤投与開始後、8.0g/dL未満となった場合には、8.0g/dL以上に回復するまで休薬すること。
好中球数
本剤投与開始後、1,000/mm3未満となった場合には、1,000/mm3以上に回復するまで休薬すること。
11.1.3 静脈血栓塞栓症(頻度不明)[9.1.10参照]
11.1.4 肝機能障害
ALT(0.9%)、AST(0.5%)の上昇等を伴う肝機能障害(頻度不明)があらわれることがある。[8.8参照]
11.1.5 出血
鼻出血(0.5%)、尿中血陽性(0.1%)、挫傷(0.1%)等の出血(頻度不明)があらわれることがある。
注)発現頻度は円形脱毛症患者を対象とした臨床試験及び尋常性白斑患者を対象とした臨床試験のデータを併合し集計した。
11.2 その他の副作用
| 1%以上 | 1%未満 | |
| 胃腸障害 | 悪心、下痢、腹痛 | 口内乾燥、消化不良、嘔吐、腹部膨満、便秘、慢性胃炎 |
| 一般・全身障害及び投与部位の状態 | 疲労 | 発熱 |
| 感染症及び寄生虫症 | 気道感染、咽頭炎、毛包炎、尿路感染 | 胃腸炎、副鼻腔炎、膀胱炎、皮膚感染、鼻炎、扁桃炎 |
| 筋骨格系及び結合組織障害 | 筋肉痛、筋痙縮、顎痛 | |
| 血液及びリンパ系障害 | 貧血、白血球減少症 | |
| 呼吸器、胸郭及び縦隔障害 | 咳嗽、口腔咽頭痛、鼻漏 | |
| 耳及び迷路障害 | 難聴、耳鳴、耳痛 | |
| 神経系障害 | 頭痛 | 浮動性めまい、錯感覚、感覚鈍麻 |
| 生殖系及び乳房障害 | 不規則月経 | |
| 精神障害 | 不眠症、睡眠障害 | |
| 代謝及び栄養障害 | 高コレステロール血症 | |
| 皮膚及び皮下組織障害 | ざ瘡、蕁麻疹 | そう痒症、発疹、脱毛症、アレルギー性皮膚炎 |
| 臨床検査 | CK増加、SARS-CoV-2検査陽性、体重増加、血中コレステロール増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 円形脱毛症患者を対象とした臨床試験4試験の併合解析において、本剤50mg併合群[50mg投与例、200/50mg投与例(200mgを4週間投与後50mg投与)(プラセボ→50mg投与例、プラセボ→200/50mg投与例の本剤が投与された後のデータを含む)並びに第II/III相プラセボ対照無作為化二重盲検並行群間比較用量設定試験の10mg、30mg及び200/30mg投与例(200mgを4週間投与後30mg投与)の被験者で非盲検非対照長期投与試験に移行し、本剤50mgが投与された後のデータを併合]の重篤な感染症の発現頻度(因果関係を問わない)は1.0%(12/1228例)であり、100人年あたりの発現率(crude incidence rate)は0.59であった。また、悪性腫瘍(非黒色腫皮膚癌を除く)及び非黒色腫皮膚癌の発現頻度(因果関係を問わない)はそれぞれ0.6%(7/1228例)及び0.2%(3/1228例)であり、100人年あたりの発現率はそれぞれ0.34及び0.15であった。[1.1、1.2.1、2.2、8.9、11.1.1参照]
15.2 非臨床試験に基づく情報
ラットのがん原性試験(24ヵ月投与)において、100mg/kg/日の雌で良性胸腺腫、100mg/kg/日の雄で良性甲状腺濾胞細胞腺腫の発現頻度の上昇が認められ、このときの血漿中薬物濃度は円形脱毛症患者に本剤50mgを1日1回投与したときの血漿中濃度と比較したとき29倍であった3)。イヌの9ヵ月間反復投与毒性試験において、軸索ジストロフィーが20mg/kg/日以上で認められ、このときの血漿中薬物濃度は円形脱毛症患者に本剤50mgを1日1回投与したときの血漿中濃度と比較したとき14倍であった4)。また、本剤はJAK阻害作用を有することから免疫系及び造血系へ影響を及ぼす可能性があり、非臨床試験ではリンパ球数及び赤血球数の減少等に加えて、免疫抑制に起因する二次的な作用(日和見感染症など)がみられた4)。ラットの受胎能試験において、本剤を投与した雄と交配した無処置の雌において着床前胚損失率の上昇が認められ、このときの血漿中薬物濃度は円形脱毛症患者に本剤50mgを1日1回投与したときの血漿中濃度と比較したとき55倍であった。精子形成(精子数、精子形成率、運動性及び形態)に対する影響はみられなかった1)。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人に本剤50mgを単回経口投与したときのリトレシチニブの薬物動態パラメータは以下のとおりである5)(外国人データ)。
| 例数 | Cmax(ng/mL) | Tmax(hr) | AUCinf(ng・hr/mL) | t1/2(hr) |
| 6 | 253(45) | 0.5(0.5-1.0) | 384(47) | 1.13±0.17 |
16.1.2 反復投与
16.2 吸収
16.2.1 バイオアベイラビリティ
健康成人に14C標識又は非標識リトレシチニブ200mgを単回経口投与及び14C標識リトレシチニブ60μgを単回静脈内投与した結果注)、リトレシチニブの吸収率は約89%、バイオアベイラビリティは約64%であった7)(外国人データ)。
16.2.2 食事の影響
健康成人に高脂肪食摂取後に本剤100mgカプセルを単回経口投与したとき注)、空腹時投与と比較してCmaxは32%低下し、AUCは11%増加した8)(外国人データ)。
16.3 分布
16.4 代謝
リトレシチニブは複数のグルタチオン-S-トランスフェラーゼ(GST)分子種(GSTA1、GSTA3、GSTM1、GSTM3、GSTM5、GSTP1、GSTS1、GSTT2、GSTZ1、MGST1、MGST2及びMGST3)及びシトクロムP450(CYP)分子種(CYP3A、CYP2C8、CYP1A2及びCYP2C9)を介して代謝され(in vitro)、消失全体の25%以上に寄与する消失経路は存在しない10)。健康成人に14C標識リトレシチニブ60μgを単回静脈内投与したとき注)、血漿中に最も多く認められたのはリトレシチニブの未変化体であり(30%)、主代謝物として薬理学的に不活性であるシステイン抱合体M2が同定された(17%)7)(外国人データ)。[16.7.1参照]
16.5 排泄
リトレシチニブは主に代謝により消失し、投与量の約4%が未変化体として尿中に排泄される。健康成人に14C標識リトレシチニブ200mgを単回経口投与したとき注)、尿及び糞中にそれぞれ投与した放射能の66%及び20%が排泄された7)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
重度の腎機能障害患者(eGFR 30mL/min未満)に本剤50mgを1日1回反復経口投与したときのリトレシチニブのCmax及びAUCtauは、腎機能が正常な健康被験者(肝機能障害試験の肝機能が正常な健康被験者)と比較した場合には、それぞれ44%及び55%増加し、母集団薬物動態モデルによりシミュレーションした、腎機能が正常な(eGFR 90mL/min以上)健康被験者の推定Cmax及びAUCtauと比較した場合には、それぞれ42%及び71%増加した11)(外国人データ)。末期腎不全の患者及び腎移植を受けた患者を対象とした臨床試験は実施していない。
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 併用薬がリトレシチニブの薬物動態に及ぼす影響
16.7.2 リトレシチニブが併用薬の薬物動態に及ぼす影響
In vitro試験の結果、リトレシチニブはCYP3A及びCYP1A2に対して時間依存的阻害を示し、CYP3A4、CYP1A2、CYP2B6、CYP2C8、CYP2C9及びCYP2C19に対する誘導作用を示す可能性が示唆されたが、CYP2D6、UGT(UGT1A1、UGT1A4、UGT1A6、UGT1A9及びUGT2B7)、GST又はSULTの分子種を阻害しなかった。また、リトレシチニブはBCRP、MATE1、MATE2K、OAT3及びOCT1を阻害する可能性が示されたが、P-gp及びBSEPを阻害しなかった。M2はBCRP、OATP1B1、OATP1B3及びOCT1を阻害する可能性が示された15)。
臨床薬物相互作用試験の結果、リトレシチニブはCYP3A、CYP1A2及びOCT1を阻害することが示された。
臨床薬物相互作用試験の結果は下表のとおりであった16)17)18)19)20)21)22)(外国人データ)。[10.、10.2参照]
臨床薬物相互作用試験の結果は下表のとおりであった16)17)18)19)20)21)22)(外国人データ)。[10.、10.2参照]
| 併用薬 | 投与量 | 例数 | 薬物動態パラメータの比(%) (併用投与/単剤投与)(90%信頼区間) | ||
| 併用薬 | リトレシチニブ注) | Cmax | AUCa) | ||
| ミダゾラム | 2mg 単回投与b) | 200mg 1日1回 11日間 | 12 | 181 (148,221) | 269 (216,336) |
| エファビレンツ | 50mg 単回投与b) | 200mg 1日1回 11日間 | 12 | 88 (77,101) | 100 (95,104) |
| カフェイン | 100mg 単回投与c) | 200mg 1日1回 9日間 | 12 | 110 (104,116) | 265 (234,300) |
| トルブタミド | 500mg 単回投与b) | 200mg 1日1回 10日間 | 12 | 103 (97,110) | 99 (92,107) |
| エチニルエストラジオール | 30μg 単回投与b) | 200mg 1日1回 11日間 | 12 | 88 (78,100) | 82 (76,89) |
| レボノルゲストレル | 150μg 単回投与b) | 12 | 103 (97,109) | 113 (104,122) | |
| エチニルエストラジオール | 30μg 単回投与b) | 50mg 1日1回 11日間 | 28 | 92 (84,101) | 98 (91,106) |
| レボノルゲストレル | 150μg 単回投与b) | 28 | 80 (73,88) | 88 (83,93) | |
| ロスバスタチン | 10mg 単回投与c) | 200mg 1日1回 10日間 | 12 | 73 (63,83) | 87 (75,101) |
| スマトリプタン | 25mg 単回投与 | 400mg 単回投与 | 10 | 87 (73,103) | 130 (117,144) |
| 25mg 単回投与d) | 400mg 単回投与 | 10 | 150 (126,178) | 150 (135,166) | |
注)本剤の承認された用法及び用量は、50mgを1日1回経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同後期第II相/第III相無作為化比較試験:ALLEGRO-2b/3(B7981015試験)
AAに起因する頭部の脱毛面積が50%以上の成人及び12歳以上の青少年AA患者注1)718例(日本人患者47例を含む)を対象としたプラセボ対照二重盲検比較試験を実施した注2)。本剤50mgを48週間(50mg群)、30mgを48週間、10mgを48週間、200mgを4週間投与(導入投与)後50mgを44週間、導入投与後30mgを44週間、プラセボ24週間投与(プラセボ群)後に本剤を24週間(50mgを24週間又は導入投与後50mgを20週間)1日1回投与した。投与後24週時点のSALT≦20達成注3)(主要評価項目)は、本剤50mg群において、プラセボ群と比較して統計的に有意な改善を示した。
注1)Severity of Alopecia Tool(SALT)によって測定した頭部の脱毛面積が50%以上(汎発型及び全頭型AAを含む)で、過去6ヵ月以内に硬毛の毛髪再生の徴候がなく現在の脱毛症状が発症してから10年以内である
注2)治験期間中は経口ステロイド等の全身療法及び光線療法、外用剤を含むすべてのAAに影響を及ぼす可能性のある薬剤の併用を禁止した
注3)SALTスコアが20以下を達成した治験参加者の割合(SALTスコア=0は「脱毛がみられない」、SALTスコア=100は「全頭脱毛」を示す)
| 本剤50mg群 | プラセボ群 | ||
| SALT≦20達成 | 24週時点のSALT≦20達成割合a) | 23.39(29/124) | 1.54(2/130) |
| プラセボ群との差[99.875%信頼区間]b) p値c) | 21.85[10.07,36.16] <0.000001 | − | |
| EBA達成d) | 24週時点のEBA達成割合 | 29.00(29/100) | 4.67(5/107) |
| プラセボ群との差[95%信頼区間]b) | 24.33[14.82,34.48] | − | |
| ELA達成e) | 24週時点のELA達成割合 | 28.89(26/90) | 5.15(5/97) |
| プラセボ群との差[95%信頼区間]b) | 23.73[13.61,34.50] | − |
副作用発現頻度(48週間)は本剤50mg群で46.2%(60/130例)であった。主な副作用はざ瘡6.2%(8/130例)、頭痛5.4%(7/130例)、下痢4.6%(6/130例)及び毛包炎4.6%(6/130例)であった23)。
18. 薬効薬理
18.1 作用機序
リトレシチニブはATPとの結合を阻害することによりJAK3及び5種類のTECファミリーキナーゼ(BMX、BTK、ITK、TEC及びTXK)を不可逆的に阻害する。
18.2 JAK阻害活性
18.3 TEC阻害活性
リトレシチニブはTECファミリーキナーゼに依存するCD8陽性T細胞及びNK細胞の細胞溶解能を阻害した24)(in vitro)。
18.4 炎症性疾患モデルにおける作用
リトレシチニブは炎症性疾患モデルであるラットのアジュバント誘発関節炎モデル、マウスの化学物質誘発性及びT細胞移入大腸炎モデル並びに実験的自己免疫性脳脊髄炎モデルにおいて、炎症を抑制して疾患を改善した25)(in vivo)。
19. 有効成分に関する理化学的知見
19.1. リトレシチニブトシル酸塩
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
14カプセル[7カプセル(PTP)×2]
23. 主要文献
- 生殖発生毒性試験(2023年6月26日承認、CTD2.4.4.8、2.6.6.6)
- 乳汁排泄試験(2023年6月26日承認、CTD2.6.4.6.3)
- ラットがん原性試験(2023年6月26日承認、CTD2.4.4.8、2.6.6.5.2)
- 反復投与毒性試験(2023年6月26日承認、CTD2.6.6.3、2.6.6.9)
- 単回および反復漸増投与試験(B7981001試験)(2023年6月26日承認、CTD2.7.6.15)
- 内因性要因の影響(2023年6月26日承認、CTD2.7.2.3.2.1)
- マスバランス試験(2023年6月26日承認、CTD2.7.2.2.2.1.3)
- 食事の影響(2023年6月26日承認、CTD2.7.1.3.1)
- 分布(2023年6月26日承認、CTD2.7.2.3.1.2)
- 吸収・分布・代謝・排泄(in vitro試験)(2023年6月26日承認、CTD2.7.2.2.1)
- 腎機能障害患者試験(2023年6月26日承認、CTD2.7.2.2.2.2.2)
- 肝機能障害患者試験(2023年6月26日承認、CTD2.7.2.2.2.2.1)
- イトラコナゾールとの薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.1.1)
- リファンピシンとの薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.1.2)
- 薬物相互作用(in vitro試験)(2023年6月26日承認、CTD2.6.4.7)
- ミダゾラムおよびエファビレンツとの薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.2.1)
- カフェインとの薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.2.2)
- トルブタミドとの薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.2.3)
- 経口避妊薬との薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.2.4)
- 経口避妊薬との薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.2.5)
- ロスバスタチンとの薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.2.6)
- スマトリプタンとの薬物相互作用試験(2023年6月26日承認、CTD2.7.2.2.2.3.2.7)
- 国際共同後期第II相/第III相無作為化比較試験:ALLEGRO-2b/3(B7981015試験)(2023年6月26日承認、CTD2.7.6.23)
- 効力を裏付ける試験(in vitro)(2023年6月26日承認、CTD2.6.2.2.1)
- 効力を裏付ける試験(in vivo)(2023年6月26日承認、CTD2.6.2.2.2.1、2.6.2.2.2.2、2.6.2.2.2.3)
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7