医薬品情報
| 総称名 | ナボール |
|---|---|
| 一般名 | ジクロフェナクナトリウム |
| 欧文一般名 | Diclofenac Sodium |
| 製剤名 | ジクロフェナクナトリウムテープ |
| 薬効分類名 | 経皮鎮痛消炎剤 |
| 薬効分類番号 | 2649 |
| ATCコード | D11AX18 |
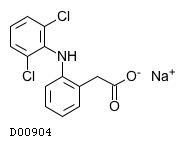
| KEGG DRUG |
D00904
ジクロフェナクナトリウム
|
| KEGG DGROUP |
DG01504
非ステロイド性抗炎症薬 (NSAID)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年10月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ナボールテープ15mg | NABOAL Tapes 15mg | 久光製薬 | 2649734S1066 | 12.7円/枚 | |
| ナボールテープL30mg | NABOAL Tapes L 30mg | 久光製薬 | 2649734S2062 | 17.6円/枚 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 アスピリン喘息(非ステロイド性消炎鎮痛剤等により誘発される喘息発作)又はその既往歴のある患者[重症喘息発作を誘発するおそれがある。][9.1.1参照]
4. 効能または効果
下記疾患並びに症状の鎮痛・消炎
変形性関節症、肩関節周囲炎、腱・腱鞘炎、腱周囲炎、上腕骨上顆炎(テニス肘等)、筋肉痛(筋・筋膜性腰痛症等)、外傷後の腫脹・疼痛
6. 用法及び用量
1日1回患部に貼付する。
8. 重要な基本的注意
8.1 消炎鎮痛剤による治療は原因療法ではなく対症療法であることに留意すること。
8.2 慢性疾患(変形性関節症等)に対し本剤を用いる場合には、薬物療法以外の療法も考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 気管支喘息のある患者(アスピリン喘息又はその既往歴のある患者を除く)
アスピリン喘息ではないことを十分に確認すること。気管支喘息の患者の中にはアスピリン喘息患者も含まれている可能性があり、それらの患者では重症喘息発作を誘発するおそれがある。[2.2参照]
9.1.2 皮膚感染症のある患者
感染を伴う炎症に対して用いる場合には適切な抗菌剤又は抗真菌剤を併用し、観察を十分行い慎重に使用すること。皮膚の感染症を不顕性化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性に対しては治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
シクロオキシゲナーゼ阻害剤を妊娠中期以降の妊婦に使用し、胎児動脈管収縮が起きたとの報告がある。また、シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。
シクロオキシゲナーゼ阻害剤を妊娠中期以降の妊婦に使用し、胎児動脈管収縮が起きたとの報告がある。また、シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| ニューキノロン系抗菌剤 レボフロキサシン等 | 痙攣を起こすおそれがある。痙攣が発現した場合には、気道を確保し、ジアゼパムの静注等を行う。 | ニューキノロン系抗菌剤が脳内の抑制性神経伝達物質であるGABAの受容体結合を濃度依存的に阻害し、ある種の非ステロイド性抗炎症剤との共存下ではその阻害作用が増強されることが動物で報告されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(蕁麻疹、血管浮腫、呼吸困難等)があらわれることがある。
11.1.2 接触皮膚炎(頻度不明)
使用部位に発赤、紅斑、発疹、そう痒感、疼痛の皮膚症状があらわれ、腫脹、浮腫、水疱・びらん等に悪化し、さらに全身に拡大し重篤化することがある。
注)1%ジクロフェナクナトリウム軟膏における発現頻度
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 皮膚 | 皮膚炎、そう痒感、発赤、皮膚のあれ、刺激感 | 水疱、色素沈着 | 光線過敏症、浮腫、腫脹、皮膚剥脱 |
14. 適用上の注意
14.1 薬剤使用時の注意
14.1.1 損傷皮膚及び粘膜に使用しないこと。
14.1.2 湿疹又は発疹の部位に使用しないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
健康成人男子の背部に、本剤及び1%ジクロフェナクナトリウム軟膏を貼付又は塗擦した時の角質中ジクロフェナク濃度は同等であった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
17.3 その他
17.3.1 国内臨床試験(皮膚安全性試験)
健康成人男子の背部に、脊椎を境に左右対称となるように本剤及びプラセボを貼付し、パッチテスト並びに光パッチテストを行ったところ、本剤及びプラセボ貼付部位のいずれにおいても光じん麻疹性、光毒性は認められなかった18)。
18. 薬効薬理
18.1 作用機序
酸性非ステロイド性消炎鎮痛剤の作用機序は、主としてアラキドン酸代謝におけるシクロオキシゲナーゼの活性を阻害することにより、炎症、疼痛等に関与するプロスタグランジンの合成を阻害することとされている。
18.2 抗炎症作用
18.2.1 急性炎症
18.2.2 亜急性・慢性炎症
18.3 鎮痛作用
19. 有効成分に関する理化学的知見
19.1. ジクロフェナクナトリウム
22. 包装
<ナボールテープ15mg>
70枚[7枚/1袋×10袋]
350枚[7枚/1袋×50袋]
700枚[7枚/1袋×100袋]
<ナボールテープL30mg>
70枚[7枚/1袋×10袋]
280枚[7枚/1袋×40袋]
560枚[7枚/1袋×80袋]
23. 主要文献
- 久光製薬社内資料.皮膚薬物動態学的試験
- 久光製薬社内資料.1%ジクロフェナクナトリウム軟膏の臨床試験に関する資料
- 宗広忠平 ほか, 臨床医薬, 16 (4), 407-17, (2000)
- 真鍋 等 ほか, 臨床医薬, 16 (4), 419-26, (2000)
- 青木虎吉 ほか, 臨床医薬, 16 (4), 427-43, (2000)
- 青木虎吉 ほか, 臨床医薬, 16 (4), 445-67, (2000)
- 青木虎吉 ほか, 臨床医薬, 16 (4), 469-88, (2000)
- 青木虎吉 ほか, 臨床医薬, 16 (4), 489-503, (2000)
- 長屋郁郎 ほか, 臨床医薬, 16 (4), 505-19, (2000)
- 竹光義治 ほか, 臨床医薬, 16 (4), 521-7, (2000)
- 渡辺好博 ほか, 臨床医薬, 16 (4), 529-38, (2000)
- 小野啓郎 ほか, 臨床医薬, 16 (4), 539-55, (2000)
- 岩崎勝郎 ほか, 臨床医薬, 16 (4), 557-66, (2000)
- 高橋栄明 ほか, 臨床医薬, 16 (4), 567-76, (2000)
- 山野慶樹 ほか, 臨床医薬, 16 (4), 577-85, (2000)
- 井形高明 ほか, 臨床医薬, 16 (4), 587-94, (2000)
- 杉岡洋一 ほか, 臨床医薬, 16 (4), 595-609, (2000)
- 久光製薬社内資料.健康成人を対象とした皮膚安全性試験
- 久光製薬社内資料.1%ジクロフェナクナトリウム軟膏の薬理作用に関する資料
- 久光製薬社内資料.ラット・カラゲニン誘発足蹠浮腫モデル
- 久光製薬社内資料.治療効果に関する資料
- 久光製薬社内資料.ラット・ビール酵母の誘発炎症性疼痛モデル
24. 文献請求先及び問い合わせ先
文献請求先
久光製薬株式会社
お客様相談室 受付時間/9:00-17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
製品情報問い合わせ先
久光製薬株式会社
お客様相談室 受付時間/9:00-17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
26. 製造販売業者等
26.1 製造販売元
久光製薬株式会社
〒841-0017
鳥栖市田代大官町408番地