医薬品情報
| 総称名 | フィコンパ |
|---|---|
| 一般名 | ペランパネル水和物 |
| 欧文一般名 | Perampanel Hydrate |
| 製剤名 | ペランパネル水和物製剤 |
| 薬効分類名 | 抗てんかん剤 |
| 薬効分類番号 | 1139 |
| ATCコード | N03AX22 |
| KEGG DRUG |
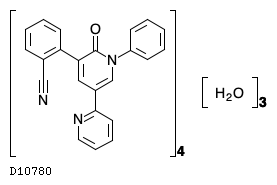
D10780
ペランパネル水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| フィコンパ点滴静注用2mg | Fycompa for intravenous infusion | エーザイ | 1139405D1025 | 1962円/瓶 | 習慣性医薬品注1), 処方箋医薬品注2) |
2. 禁忌
4. 効能または効果
一時的に経口投与ができない患者における、下記の治療に対するペランパネル経口製剤の代替療法
○てんかん患者の部分発作(二次性全般化発作を含む)
○他の抗てんかん薬で十分な効果が認められないてんかん患者の強直間代発作に対する抗てんかん薬との併用療法
6. 用法及び用量
ペランパネルの経口投与から本剤に切り替える場合
<部分発作(二次性全般化発作を含む)に用いる場合>
[単剤療法][併用療法]
通常、成人及び4歳以上の小児にはペランパネル経口投与と同じ1日用量を、1日1回30分以上かけて点滴静脈内投与する。
ただし、4歳以上12歳未満の小児への投与時間は90分とする。
ただし、4歳以上12歳未満の小児への投与時間は90分とする。
<強直間代発作に用いる場合>
[併用療法]
通常、成人及び12歳以上の小児にはペランパネル経口投与と同じ1日用量を、1日1回30分以上かけて点滴静脈内投与する。
ペランパネルの経口投与に先立ち本剤を投与する場合
<部分発作(二次性全般化発作を含む)に用いる場合>
[単剤療法]
通常、成人及び4歳以上の小児にはペランパネルとして1日1回2mgの投与より開始し、その後2週間以上の間隔をあけて2mgずつ漸増し、維持用量は1日1回4〜8mgとし、30分以上かけて点滴静脈内投与する。
ただし、4歳以上12歳未満の小児への投与時間は90分とする。
ただし、4歳以上12歳未満の小児への投与時間は90分とする。
[併用療法]
通常、成人及び12歳以上の小児にはペランパネルとして1日1回2mgの投与より開始し、その後1週間以上の間隔をあけて2mgずつ漸増し、本剤の代謝を促進する抗てんかん薬を併用しない場合の維持用量は1日1回4〜8mg、併用する場合の維持用量は1日1回8〜12mgとし、30分以上かけて点滴静脈内投与する。
通常、4歳以上12歳未満の小児にはペランパネルとして1日1回2mgの投与より開始し、その後2週間以上の間隔をあけて2mgずつ漸増し、本剤の代謝を促進する抗てんかん薬を併用しない場合の維持用量は1日1回4〜8mg、併用する場合の維持用量は1日1回8〜12mgとし、90分かけて点滴静脈内投与する。
<強直間代発作に用いる場合>
[併用療法]
通常、成人及び12歳以上の小児にはペランパネルとして1日1回2mgの投与より開始し、その後1週間以上の間隔をあけて2mgずつ漸増し、本剤の代謝を促進する抗てんかん薬を併用しない場合の維持用量は1日1回8mg、併用する場合の維持用量は1日1回8〜12mgとし、30分以上かけて点滴静脈内投与する。
ペランパネルの経口投与から本剤に切り替える場合、及びペランパネルの経口投与に先立ち本剤を投与する場合のいずれにおいても、症状により適宜増減できるが、1日最高投与量及び増減方法は以下のとおりとすること。
<部分発作(二次性全般化発作を含む)に用いる場合>
[単剤療法]
成人及び4歳以上の小児には、2週間以上の間隔をあけて2mg以下ずつ適宜増減し、1日最高8mgまでとする。
[併用療法]
成人及び12歳以上の小児には、1週間以上の間隔をあけて2mg以下ずつ適宜増減し、1日最高12mgまでとする。
4歳以上12歳未満の小児には、2週間以上の間隔をあけて2mg以下ずつ適宜増減し、1日最高12mgまでとする。
<強直間代発作に用いる場合>
[併用療法]
成人及び12歳以上の小児には、1週間以上の間隔をあけて2mg以下ずつ適宜増減し、1日最高12mgまでとする。
<参考:成人及び12歳以上の小児における部分発作(二次性全般化発作を含む)に用いる場合>
| 単剤療法 | 併用療法 | ||
| 本剤の代謝を促進する抗てんかん薬注1)の併用 | − | なし | あり |
| 投与方法 | 1日1回 30分以上かけて点滴静脈内投与 | 1日1回 30分以上かけて点滴静脈内投与 | |
| 開始用量注2) | 2mg/日 | 2mg/日 | |
| 漸増間隔 | 2週間以上 | 1週間以上 | |
| 漸増用量 | 2mg/日 | 2mg/日 | |
| 維持用量 | 4〜8mg/日 | 4〜8mg/日 | 8〜12mg/日 |
| 最高投与量 | 8mg/日 | 12mg/日 | |
<参考:4歳以上12歳未満の小児における部分発作(二次性全般化発作を含む)に用いる場合>
| 単剤療法 | 併用療法 | ||
| 本剤の代謝を促進する抗てんかん薬注1)の併用 | − | なし | あり |
| 投与方法 | 1日1回 90分かけて点滴静脈内投与 | 1日1回 90分かけて点滴静脈内投与 | |
| 開始用量注2) | 2mg/日 | 2mg/日 | |
| 漸増間隔 | 2週間以上 | 2週間以上 | |
| 漸増用量 | 2mg/日 | 2mg/日 | |
| 維持用量 | 4〜8mg/日 | 4〜8mg/日 | 8〜12mg/日 |
| 最高投与量 | 8mg/日 | 12mg/日 | |
<参考:成人及び12歳以上の小児における強直間代発作に用いる場合>
| 併用療法 | ||
| 本剤の代謝を促進する抗てんかん薬注1)の併用 | なし | あり |
| 投与方法 | 1日1回 30分以上かけて点滴静脈内投与 | |
| 開始用量注2) | 2mg/日 | |
| 漸増間隔 | 1週間以上 | |
| 漸増用量 | 2mg/日 | |
| 維持用量 | 8mg/日 | 8〜12mg/日 |
| 最高投与量 | 12mg/日 | |
7. 用法及び用量に関連する注意
<全効能共通>
7.1 本剤の代謝を促進する抗てんかん薬(カルバマゼピン、フェニトイン、ホスフェニトイン)との併用により本剤の血中濃度が低下することがあるので、本剤の投与開始時、投与中又は本剤からペランパネル経口製剤に切り替える時にカルバマゼピン、フェニトイン又はホスフェニトインを投与開始又は投与中止する際には、慎重に症状を観察し、必要に応じて1日最高投与量である12mgを超えない範囲で適切に用量の変更を行うこと。[8.4、10.2、16.7.1参照]
7.2 軽度及び中等度の肝機能障害のある患者に本剤を投与する場合は、ペランパネルとして1日1回2mgより開始し、その後2週間以上の間隔をあけて2mgずつ漸増すること。また、症状により2週間以上の間隔をあけて2mg以下ずつ適宜増減するが、軽度の肝機能障害のある患者については1日最高8mg、中等度の肝機能障害のある患者については1日最高4mgまでとする。[9.3.2、16.6.2参照]
7.3 経口投与が可能になった場合は速やかにペランパネル経口製剤に切り替えること。
7.4 点滴静脈内投与から経口投与に切り替える際の経口投与の1日用量は、点滴静脈内投与と同じ1日用量とすること。
<強直間代発作に対する併用療法>
7.5 本剤を強直間代発作に対して使用する場合には、他の抗てんかん薬と併用して使用すること。臨床試験において、強直間代発作に対する本剤単独投与での使用経験はない。
8. 重要な基本的注意
8.1 易刺激性、攻撃性・敵意、不安、自殺企図等の精神症状があらわれ、自殺に至った例も報告されているので、本剤投与中及び投与終了後一定期間は患者の状態及び病態の変化を注意深く観察すること。[8.2、11.1.1、15.1.1参照]
8.2 患者及びその家族等に易刺激性、攻撃性・敵意、不安、幻覚(幻視、幻聴等)、妄想、せん妄、自殺企図等の精神症状発現の可能性について十分説明を行い、医師と緊密に連絡を取り合うように指導すること。[8.1、11.1.1、15.1.1参照]
8.3 運動失調(ふらつき)、めまい等が高頻度で認められ、ペランパネル経口製剤から本剤に切り替えたときにめまい等の発現割合の増加が認められていることから、転倒等に注意すること。[17.1.1参照]
8.4 本剤を増量した場合に易刺激性、攻撃性・敵意、不安等の精神症状、運動失調(ふらつき)等が多く認められ、特にペランパネルの代謝を促進する抗てんかん薬(カルバマゼピン、フェニトイン、ホスフェニトイン)を併用しない患者では多く認められるため、患者の状態を慎重に観察すること。[7.1、10.2、16.7.1参照]
8.5 めまい、眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転など危険を伴う操作に従事させないよう注意すること。
8.6 連用中における投与量の急激な減量ないし投与中止により、発作頻度が増加する可能性があるので、投与を中止する場合には徐々に減量することも考慮し、患者の状態を慎重に観察すること。
8.7 添加剤であるスルホブチルエーテルβ-シクロデキストリンナトリウム(SBECD)の血漿中濃度の急激な上昇に伴い、ショック、アナフィラキシーを起こすおそれがあるので、点滴投与時の投与速度に注意すること。[9.7.2参照]
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 腎機能障害のある患者又は透析中の末期腎障害患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
9.3.2 軽度及び中等度の肝機能障害のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ラットの妊娠及び授乳期間中に投与したとき、一般状態の悪化の認められる用量(3mg/kg/日以上)で分娩及び哺育状態の異常、死亡産児数の増加、出生率及び生存率の減少、10mg/kg/日で出生児に体重抑制と形態分化の遅延がみられ、妊娠ウサギに投与したとき、体重及び摂餌量の減少が認められる用量(10mg/kg)で、早産がみられた。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。授乳ラットに投与したとき、ペランパネル又はその代謝物が乳汁中へ移行することが報告されている。
9.7 小児等
9.7.1 18歳未満の患者に本剤を投与した臨床試験は実施していない。
9.7.3 経口製剤の臨床試験において、小児における易刺激性、攻撃性・敵意等の精神症状の発現割合が成人に比べて高くなることが示唆されているので、観察を十分に行うこと。
9.8 高齢者
9.8.1 一般に高齢者では生理機能が低下している。[16.6.3参照]
9.8.2 観察を十分に行うなど慎重に投与すること。経口製剤の臨床試験において、高齢者は非高齢者と比較して転倒のリスクが高いという結果が得られている。
10. 相互作用
相互作用序文
ペランパネルは主として薬物代謝酵素CYP3Aで代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A
10.2 併用注意
| カルバマゼピン フェニトイン ホスフェニトインナトリウム水和物 [7.1、8.4、16.7.1参照] | ペランパネルの血中濃度が低下するので、必要に応じて本剤の用量を調節すること。 | 相手薬剤により薬物代謝酵素CYP3Aが誘導され、本剤の代謝が促進される。 |
| CYP3A誘導作用を有する薬剤等 リファンピシン フェノバルビタール セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品等 | ペランパネルの血中濃度が低下する可能性がある。 | 相手薬剤により薬物代謝酵素CYP3Aが誘導され、本剤の代謝が促進される可能性がある。 |
| CYP3A阻害作用を有する薬剤 イトラコナゾール等 [16.7.2参照] | ペランパネルの血中濃度が上昇する可能性がある。 | 相手薬剤により薬物代謝酵素CYP3Aが阻害され、本剤のクリアランスが低下する。 |
| 経口避妊薬(レボノルゲストレル) [16.7.4参照] | 相手薬剤の血中濃度が低下し、効果が減弱する可能性がある。 | 機序は不明である。 |
| アルコール(飲酒) [16.7.5参照] | 精神運動機能の低下が増強することがある。 | ペランパネル及びアルコールは中枢神経抑制作用を有するため、相互に作用を増強する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 攻撃性等の精神症状
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | そう痒症 | ||
| 精神神経系 | 浮動性めまい(35.4%)、傾眠(19.8%) | 頭痛、運動失調、平衡障害、構語障害、痙攣 | 振戦、気分動揺、感覚鈍麻、嗜眠、過眠症、感情不安定、気分変化、神経過敏、健忘、記憶障害、異常行動、錯乱状態、睡眠障害、錯感覚、自殺企図、注意力障害、精神運動亢進、協調運動異常、てんかん増悪、自殺念慮、多幸気分 | |
| 消化器 | 悪心、嘔吐 | 腹部不快感、腹痛、下痢、口内炎、便秘、流涎過多 | ||
| 肝臓 | 肝機能異常、γ-GTP増加、AST増加、ALT増加 | |||
| 血液 | 貧血、低ナトリウム血症、好中球減少症 | |||
| 眼 | 複視 | 眼振、霧視 | ||
| 筋骨格 | 筋力低下、筋肉痛 | 関節痛 | ||
| その他 | 疲労、体重増加、回転性めまい、歩行障害、食欲減退、食欲亢進、注射部位疼痛注)、注射部位発疹注)、注射部位小水疱注) | 心電図QT延長、異常感、倦怠感、尿中蛋白陽性、体重減少、不規則月経、鼻出血、転倒、酩酊感、挫傷、無力症、発熱、血中クレアチンホスホキナーゼ増加、尿失禁 | 上気道感染 |
13. 過量投与
13.1 徴候・症状
過量投与後にみられた主な症状として、精神状態変化、激越、攻撃的行動及び意識障害が報告されている。
13.2 処置
過量投与の際の特異的な薬物療法はない。なお、腎透析によるクリアランスの促進は期待できない。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤を注射用水、5%ブドウ糖注射液又は生理食塩液6mLで溶解し、完全に溶解したことを確認すること。
14.1.2 5%ブドウ糖注射液又は生理食塩液で希釈して、点滴静脈内投与する(希釈後の点滴静脈内注射溶液濃度0.02〜0.12mg/mL)こと。
14.1.3 用時調製し、調製後は速やかに使用すること。また、残液は廃棄すること。
14.2 薬剤投与時の注意
14.2.1 ポリエチレン製の点滴バッグを使用すること。
14.2.2 ポリプロピレン製の点滴バッグの使用は避けること。不純物があらわれることがある。
14.2.3 ポリ塩化ビニル製の点滴チューブ及び点滴バッグの使用は避けること。ペランパネルと接触した場合、吸着が起こることがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外で実施された複数の抗てんかん薬における、てんかん、精神疾患等を対象とした199のプラセボ対照比較試験の検討結果において、自殺念慮及び自殺企図の発現リスクが、抗てんかん薬の服用群でプラセボ群と比較して約2倍高く(抗てんかん薬服用群:0.43%、プラセボ群:0.24%)、抗てんかん薬の服用群では、プラセボ群と比べ1000人あたり1.9人多いと計算された(95%信頼区間:0.6-3.9)。また、てんかん患者のサブグループでは、プラセボ群と比べ1000人あたり2.4人多いと計算されている。[8.1、8.2参照]
15.1.2 薬物の乱用経験のある外国人健康成人にペランパネル8〜36mgを単回経口投与したとき、薬剤嗜好性、薬剤購入希望、多幸気分及び鎮静スコアの評価指標において、プラセボを投与したときと比較して大きな作用が認められた。ペランパネル24〜36mgを投与したときに認められた作用は陽性対照(アルプラゾラム1.5〜3mg、ケタミン100mg)と同程度であった。
15.2 非臨床試験に基づく情報
15.2.1 ラットを用いた身体依存性試験において、ペランパネル13.3〜43.5mg/kg(摂餌量から換算)を混餌投与した際に、退薬症候が認められた。また、サルを用いた静脈内自己投与試験において、ペランパネル0.016〜0.004mg/kgを漸減投与した際に、自己投与回数の増加(強化効果)が認められた。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人を含む健康成人にペランパネル12mgを30分間又は60分間若しくは90分間点滴静脈内投与又は絶食下経口投与したときの血漿中濃度推移を図に示し、薬物動態パラメータを表に示した。なお、ペランパネルは単回経口投与後速やかかつほぼ完全に吸収され、初回通過効果はほとんど受けない1)5)。
図 点滴静脈内投与又は経口投与したときの血漿中濃度推移
(Mean+S.D.)
| 投与群 | 投与経路 | 例数 | Cmax(ng/mL) | tmaxa)(hr) | AUC(0-t)(ng・hr/mL) | t1/2(hr) |
| 30分間点滴投与群 | 点滴静脈内投与 | 19 | 477±158 | 0.53 0.53、0.75 | 25100±9550 | 133±56.0b) |
| 経口投与 | 20 | 296±99.9 | 1.00 0.53、4.00 | 26600±11000 | 129±52.4b) | |
| 60分間点滴投与群 | 点滴静脈内投与 | 19 | 368±57.6 | 1.03 0.75、1.03 | 22600±7550 | 116±46.6c) |
| 経口投与 | 19 | 281±70.3 | 1.25 0.50、3.00 | 24300±9380 | 124±46.3d) | |
| 90分間点滴投与群 | 点滴静脈内投与 | 6 | 354±71.7 | 1.53 1.25、1.53 | 22900±10000 | 97.8±68.6e) |
| 経口投与 | 8 | 330±84.7 | 0.88 0.50、2.02 | 26000±14600 | 111±65.2f) |
| 比較 | 薬物動態パラメータ | 幾何平均値の比(%) | |
| 点推定値 | 90%信頼区間 | ||
| 30分間点滴静脈内投与/経口投与 | Cmax | 161.25 | 136.54-190.42 |
| AUC(0-t) | 91.79 | 85.80-98.20 | |
| 60分間点滴静脈内投与/経口投与 | Cmax | 135.15 | 122.82-148.72 |
| AUC(0-t) | 102.93 | 97.33-108.84 | |
| 90分間点滴静脈内投与/経口投与 | Cmax | 106.43 | 88.12-128.55 |
| AUC(0-t) | 101.10 | 86.10-118.72 | |
16.1.2 経口製剤から注射剤への切り替え試験
12歳以上の部分発作(二次性全般化発作を含む)又は強直間代発作を有する日本人てんかん患者21例を対象に注1)、ペランパネル8〜12mg/日を経口投与から30分間の点滴静脈内投与(4日間、1日1回)に切り替えたときのCmaxを表に示した16)。
| 投与量(mg) | 例数 | Cmax(ng/mL) | ||||
| 経口投与 | 30分間点滴静脈内投与 | |||||
| Day -1 | Day 1 | Day 2 | Day 3 | Day 4 | ||
| 8 | 11 | 574±375 | 609±303 | 614±315 | 557±301 | 554±300 |
| 10 | 5a) | 528±228 | 591±172 | 520±184 | 547±169 | 541±209 |
| 12 | 5 | 678±293 | 837±282 | 760±261 | 815±276 | 841±312 |
注1)本剤を投与した被験者の年齢は18〜62歳であった。
16.3 分布
16.3.1 日本人を含む健康成人にペランパネル12mgを30分間で点滴静脈内投与したとき、最終消失相の分布容積の平均値(15名)は95.2Lであった1)。
16.3.2 血漿蛋白結合率(in vitro、ヒト血漿、濃度20〜2000ng/mL)は95〜96%であった2)。
16.3.3 ラットにペランパネル(14C標識体)1mg/kgを単回経口投与したとき、組織中放射能濃度はほとんどの組織で投与1時間後に最高値を示し、投与1週間後までにほとんどの組織で定量下限未満となったが、大動脈では投与3週間後においても投与6時間後と同程度の放射能が検出された3)。
16.4 代謝
16.5 排泄
16.5.1 日本人を含む健康成人にペランパネル12mgを30分間で点滴静脈内投与したとき、全身クリアランスの平均値(15名)は0.605L/hであった1)。
16.5.2 健康成人男性8名(24〜49歳)に14C-ペランパネル約4mgを単回経口投与したとき、投与後768時間までに投与放射能の28%が尿中から、69%が糞中から回収された5)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者(経口製剤における試験成績)
プラセボ対照試験でペランパネル12mg/日までの用量を投与された日本人を含む患者(部分発作又は強直間代発作)を対象とした母集団薬物動態解析において、ペランパネルのみかけのクリアランスにクレアチニンクリアランス(範囲:38.6〜160mL/min)の有意な影響は認められなかった6)。
16.6.2 肝機能障害患者(経口製剤における試験成績)
軽度(Child-Pugh A群)及び中等度(Child-Pugh B群)の成人の肝機能障害患者それぞれ6例にペランパネル1mgを摂食下単回経口投与したとき、それぞれの被験者背景に対応する健康成人と比較して非結合型ペランパネルのAUC(0-inf)はそれぞれ81%及び228%増加、みかけのクリアランスは45%及び70%低下した。t1/2は軽度及び中等度の肝機能障害患者でそれぞれ306時間及び295時間、対照となる健康成人ではそれぞれ125時間及び139時間であり、肝機能障害患者で延長が見られた。重度(Child-Pugh C群)の肝機能障害患者を対象とした臨床試験は実施していない7)(外国人データ)。[2.2、7.2、9.3.1、9.3.2参照]
| 例数 | 総ペランパネルのCmax(ng/mL) | 非結合型ペランパネルのAUC(0-inf)a)(ng・hr/mL) | 非結合型ペランパネルのCL/Fa)(mL/min) | t1/2(hr) | |
| 健康成人b) | 6 | 20.1±5.37 | 54.4±22.8 49.2 | 388±249 339 | 125±56.2 |
| 軽度肝機能障害患者 | 6 | 15.3±8.64 | 111±95.8 88.8 | 220±117 188 | 306±275 |
| 健康成人c) | 6 | 21.0±5.92 | 52.8±36.7 42.5 | 487±338 392 | 139±145 |
| 中等度肝機能障害患者 | 6 | 16.3±3.40 | 141±20.6 139 | 121±18.0 120 | 295±116 |
16.6.3 高齢者(経口製剤における試験成績)
16.7 薬物相互作用
16.7.1 抗てんかん薬(経口製剤における試験成績)
(1)健康成人14名において、カルバマゼピン300mgを1日2回反復経口投与時にペランパネル2mgを単回経口投与したとき、単独投与時と比較してペランパネルのCmax、AUC(0-inf)及びt1/2はそれぞれ26%低下、67%減少及び56%短縮し、みかけのクリアランスは203%増加した9)(外国人データ)。[7.1、8.4、10.2参照]
(2)母集団薬物動態解析において、ペランパネルの定常状態の血漿中濃度に及ぼす他の抗てんかん薬の影響6)、及び他の抗てんかん薬の血漿中濃度に及ぼすペランパネルの影響10)について検討した。
結果は下記のとおりである。
結果は下記のとおりである。
| 抗てんかん薬 | ペランパネルの血漿中濃度に及ぼす抗てんかん薬の影響 | 抗てんかん薬の血漿中濃度に及ぼすペランパネルの影響 |
| カルバマゼピン | 66%低下 | <10%低下 |
| クロバザム | 影響なし | <10%低下 |
| クロナゼパム | 影響なし | 影響なし |
| ラモトリギン | 影響なし | <10%低下 |
| レベチラセタム | 影響なし | 影響なし |
| フェノバルビタール | 18%低下 | 影響なし |
| フェニトイン | 49%低下 | 影響なし |
| トピラマート | 18%低下 | 影響なし |
| バルプロ酸 | 影響なし | <10%低下 |
| ゾニサミド | 影響なし | 影響なし |
16.7.2 ケトコナゾール(経口製剤における試験成績)
16.7.3 ミダゾラム(経口製剤における試験成績)
健康成人35名において、ペランパネル6mg/日を反復経口投与時にミダゾラム4mgを単回経口投与したとき、単独投与時と比較してミダゾラムのCmaxは15%低下し、AUC(0-inf)は13%減少した12)(外国人データ)。
16.7.4 経口避妊薬(エチニルエストラジオール30μg及びレボノルゲストレル150μg合剤)(経口製剤における試験成績)
健康成人女性28名において、ペランパネル8mg/日を反復経口投与時に経口避妊薬を単回投与したとき、単独投与時と比較してエチニルエストラジオール及びレボノルゲストレルのCmax及びAUC(0-24hr)に影響は認められなかった。ペランパネル12mg/日を反復経口投与時に経口避妊薬を単回投与したとき、単独投与時と比較してレボノルゲストレルのCmax及びAUC(0-24hr)がそれぞれ43%低下及び41%減少した。エチニルエストラジオールのCmaxの低下幅は20%未満であり、AUC(0-24hr)は影響を受けなかった。健康成人女性24名において、経口避妊薬を反復投与時にペランパネル6mgを単回経口投与したとき、単独投与時と比較してペランパネルのCmax及びAUC(0-72hr)に影響は認められなかった13)(外国人データ)。[10.2参照]
16.7.5 アルコール(経口製剤における試験成績)
16.7.6 CYPの誘導及び阻害
ヒト肝ミクロソームにおいて、ペランパネルは30μmol/Lの濃度でCYP2C8及びUGT1A9に弱い阻害活性を示した。ヒト初代培養肝細胞系において、CYP2B6に対してペランパネルは30μmol/Lの濃度で、CYP3Aに対して3〜30μmol/Lの濃度範囲で弱い誘導能を示した15)(in vitro)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<部分発作(二次性全般化発作を含む)、強直間代発作>
17.1.1 国内第II相試験(経口製剤から注射剤への切り替え試験)
12歳以上の部分発作(二次性全般化発作を含む)又は強直間代発作を有する日本人てんかん患者21例を対象に注1)、ペランパネル8〜12mg/日を経口投与から30分間の点滴静脈内投与(4日間、1日1回)に切り替えたとき注2)、経口投与時と比べて1日あたりの発作回数に違いはなかった。本剤が投与された安全性解析対象症例21例において、副作用は61.9%(13/21例)に認められた。主な副作用は、浮動性めまいが28.6%(6/21例)、傾眠が14.3%(3/21例)であった16)。[8.3参照]
注1)本剤を投与した被験者の年齢は18〜62歳であった。
注2)本剤の投与速度は3.3mL/分(ペランパネルとして最大で0.4mg/分)であった。
18. 薬効薬理
18.1 作用機序
ペランパネルは、シナプス後膜に主として存在するAMPA(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid)型グルタミン酸受容体に選択的な非競合的拮抗剤として抗てんかん作用を発揮すると推定されている17)。
18.2 抗痙攣作用
19. 有効成分に関する理化学的知見
19.1. ペランパネル水和物
20. 取扱い上の注意
外箱開封後は光を遮り保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
2mg×6バイアル
23. 主要文献
- 社内資料:錠剤に対する注射剤のバイオアベイラビリティ試験(2024年1月18日承認、CTD 2.7.6.1)
- 社内資料:ペランパネルのin vitroヒト血漿蛋白結合率(2016年3月28日承認、CTD 2.6.4.4.3)
- 社内資料:ラットにペランパネルを単回投与したときの組織分布(2016年3月28日承認、CTD 2.6.4.4.1)
- 社内資料:ペランパネルのin vitro代謝(2016年3月28日承認、CTD 2.6.4.5.2)
- 社内資料:マスバランス試験(2016年3月28日承認、CTD 2.7.6.40)
- 社内資料:プラセボ対照試験で日本人を含む部分発作又は強直間代発作を有するてんかん患者を対象とした母集団薬物動態解析(2016年3月28日承認、CTD 2.7.2.2.2.6.4)
- 社内資料:肝機能障害患者における薬物動態試験(2016年3月28日承認、CTD 2.7.6.15)
- 社内資料:高齢者における単回投与試験(2016年3月28日承認、CTD 2.7.6.14)
- 社内資料:薬物相互作用試験(カルバマゼピン)(2016年3月28日承認、CTD 2.7.6.17)
- 社内資料:プラセボ対照試験で部分発作を有するてんかん患者を対象とした母集団薬物動態解析(2016年3月28日承認、CTD 2.7.2.2.2.6.3)
- 社内資料:薬物相互作用試験(ケトコナゾール)(2016年3月28日承認、CTD 2.7.6.16)
- 社内資料:薬物相互作用試験(ミダゾラム)(2016年3月28日承認、CTD 2.7.6.18)
- 社内資料:薬物相互作用試験(経口避妊薬)(2016年3月28日承認、CTD 2.7.6.20)
- 社内資料:薬物相互作用試験(アルコール)(2016年3月28日承認、CTD 2.7.6.26)
- 社内資料:ペランパネルのin vitro相互作用(2016年3月28日承認、CTD 2.6.4.5.3)
- 社内資料:てんかん患者を対象とした経口製剤から注射剤への切り替え第II相試験(2024年1月18日承認、CTD 2.7.6.2)
- 社内資料:AMPA受容体の非競合的拮抗作用(2016年3月28日承認、CTD 2.6.2.2.1)
- 社内資料:音誘発痙攣に対する作用(2016年3月28日承認、CTD 2.6.2.2.4.2)
- 社内資料:最大電撃痙攣に対する作用(2016年3月28日承認、CTD 2.6.2.2.4.3)
- 社内資料:ペンチレンテトラゾール誘発痙攣に対する作用(2016年3月28日承認、CTD 2.6.2.2.4.4)
- 社内資料:GAERSにおける作用(2016年3月28日承認、CTD 2.6.2.2.4.7)
- 社内資料:角膜キンドリングに対する作用(2016年3月28日承認、CTD 2.6.2.2.4.5)
- 社内資料:扁桃核キンドリングに対する作用(2016年3月28日承認、CTD 2.6.2.2.4.6)
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売元
エーザイ株式会社
東京都文京区小石川4-6-10