医薬品情報
| 総称名 | シルニジピン |
|---|---|
| 一般名 | シルニジピン |
| 欧文一般名 | Cilnidipine |
| 薬効分類名 | 持続性Ca拮抗降圧剤 |
| 薬効分類番号 | 2149 |
| ATCコード | C08CA14 |
| KEGG DRUG |
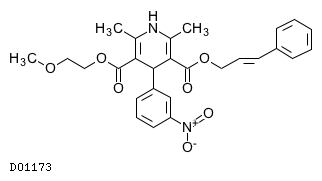
D01173
シルニジピン
|
| KEGG DGROUP |
DG01928
ジヒドロピリジン系カルシウム拮抗薬
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| シルニジピン錠5mg「NIG」 (後発品) | 日医工岐阜工場 | 2149037F1113 | 10.4円/錠 | 処方箋医薬品注) | |
| シルニジピン錠10mg「NIG」 (後発品) | 日医工岐阜工場 | 2149037F2110 | 13.8円/錠 | 処方箋医薬品注) | |
| シルニジピン錠20mg「NIG」 (後発品) | 日医工岐阜工場 | 2149037F3086 | 21.5円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
6. 用法及び用量
通常、成人にはシルニジピンとして1日1回5〜10mgを朝食後経口投与する。なお、年齢、症状により適宜増減する。効果不十分の場合には、1日1回20mgまで増量することができる。ただし、重症高血圧症には1日1回10〜20mgを朝食後経口投与する。
8. 重要な基本的注意
8.1 カルシウム拮抗剤の投与を急に中止したとき、症状が悪化した症例が報告されているので、本剤の休薬を要する場合は徐々に減量すること。なお、5mg投与より休薬を要する場合には他剤に変更する等の処置をとること。また、患者に医師の指示なしに服薬を中止しないように注意すること。
8.2 降圧作用に基づくめまい等があらわれることがあるので高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 カルシウム拮抗剤による重篤な副作用発現の既往のある患者
臨床試験では除外されている。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
血中濃度が上昇する可能性がある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で、母乳中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量(例えば5mg)から投与を開始し、慎重に投与すること。一般に過度の降圧は好ましくないとされている。
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| 降圧作用を有する薬剤 | 血圧が過度に低下するおそれがある。 | 相加的あるいは相乗的に作用を増強することが考えられている。 |
| ジゴキシン | 他のカルシウム拮抗剤(ニフェジピン等)でジゴキシンの血中濃度を上昇させることが報告されている。ジゴキシン中毒症状(悪心・嘔吐、頭痛、視覚異常、不整脈等)が認められた場合、症状に応じジゴキシンの用量を調節又は本剤の投与を中止するなど適切な処置を行うこと。 | 機序は完全には解明されていないが、ジゴキシンの腎及び腎外クリアランスが減少するためと考えられている。 |
| シメチジン | 他のカルシウム拮抗剤(ニフェジピン等)の作用が増強されることが報告されている。 | シメチジンが肝血流量を低下させ、カルシウム拮抗剤の肝ミクロソームでの酵素代謝を抑制する一方で、胃酸を低下させ、カルシウム拮抗剤の吸収を増加させるためと考えられている。 |
| リファンピシン | 他のカルシウム拮抗剤(ニフェジピン等)の作用が減弱されることが報告されている。 | リファンピシンにより誘導された肝薬物代謝酵素(チトクロームP-450)がカルシウム拮抗剤の代謝を促進し、クリアランスを上昇させるためと考えられている。 |
| アゾール系抗真菌剤 イトラコナゾール ミコナゾール 等 | 本剤の血中濃度が上昇するおそれがある。 | アゾール系抗真菌剤が本剤の薬物代謝酵素のCYP3A4を阻害するためと考えられる。 |
| グレープフルーツジュース | 本剤の血中濃度が上昇することが確認されている。 | 発現機序の詳細は不明であるが、グレープフルーツジュースに含まれる成分が本剤の薬物代謝酵素のCYP3A4を抑制するためと考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害、黄疸(頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害があらわれることがある。
11.1.2 血小板減少(0.1%未満)
注)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 肝臓 | AST、ALT、LDH等の上昇 | Al-Pの上昇 | |
| 腎臓 | クレアチニン上昇、尿素窒素上昇、尿蛋白陽性 | 尿沈渣陽性 | |
| 精神神経系 | 頭痛、頭重感、めまい、立ちくらみ、肩こり | 眠気、不眠、手指振戦、もの忘れ | しびれ |
| 循環器 | 顔面潮紅、動悸、熱感、心電図異常(ST低下、T波逆転)、血圧低下 | 胸痛、心胸郭比の上昇、頻脈、房室ブロック、冷感 | 期外収縮、徐脈 |
| 消化器 | 嘔気・嘔吐、腹痛 | 便秘、腹部膨満感、口渇、歯肉肥厚、胸やけ、下痢 | |
| 過敏症 | 発疹 | 発赤、そう痒感 | 光線過敏症 |
| 血液 | 白血球数の変動、好中球の変動、ヘモグロビンの変動 | 赤血球数の変動、ヘマトクリットの変動、好酸球の変動、リンパ球の変動 | |
| その他 | 浮腫(顔、下肢等)、全身倦怠感、頻尿、血清コレステロールの上昇、CKの変動、尿酸の変動、血清Kの変動、血清Pの変動 | 脱力感、腓腸筋痙直、眼周囲の乾燥、目の充血刺激感、味覚異常、尿糖陽性、空腹時血糖の変動、総蛋白の変動、血清Caの変動、CRPの変動、咳嗽 | 耳鳴 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子6名にシルニジピン5mg、10mg、20mgを単回経口投与した時のCmaxはそれぞれ4.7ng/mL、5.4ng/mL、15.7ng/mL、AUC0〜24はそれぞれ23.7ng・hr/mL、27.5ng・hr/mL、60.1ng・hr/mLであり、用量依存的に増加した5)。
16.1.2 反復投与
健康成人男子6名にシルニジピン10mgを1日1回反復経口投与した時の薬物動態学的パラメータは以下のとおりであり、投与第4日目以降は定常状態に達し、蓄積性は認められなかった6)。
| Cmax(ng/mL) | Tmax(hr) | t1/2(α)(hr) | t1/2(β)(hr) | AUC0〜∞(ng・hr/mL) | |
| 投与第1日目 | 9.5±1.6 | 2.8±1.0 | 1.0±0.2 | 5.2±2.0 | 51.4±12.7 |
| 投与第4日目 | 13.5±5.0 | 3.7±0.8 | − | − | 101.8±29.0 |
| 投与第7日目 | 16.5±7.9 | 3.0±1.3 | 1.1±0.6 | 8.1±2.7 | 95.5±34.5 |
16.1.3 生物学的同等性試験
<シルニジピン錠5mg「NIG」>
(1)シルニジピン錠5mg「NIG」とアテレック錠5を、クロスオーバー法によりそれぞれ1錠(シルニジピンとして5mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された7)。
| 投与量(mg) | AUC0-24(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| シルニジピン錠5mg「NIG」 | 5 | 11.56±6.29 | 2.38±1.36 | 2.8±1.1 | 2.79±1.08 |
| アテレック錠5 | 5 | 10.71±5.96 | 2.09±0.93 | 2.6±1.4 | 3.16±1.61 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<シルニジピン錠10mg「NIG」>
(2)シルニジピン錠10mg「NIG」とアテレック錠10を、クロスオーバー法によりそれぞれ1錠(シルニジピンとして10mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された7)。
| 投与量(mg) | AUC0-24(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| シルニジピン錠10mg「NIG」 | 10 | 46.09±23.12 | 8.57±4.35 | 3.0±0.9 | 4.88±2.43 |
| アテレック錠10 | 10 | 40.35±19.49 | 7.87±4.28 | 2.2±0.9 | 5.58±2.64 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
In vitroでのヒト血清蛋白結合率は99.3%であった8)。
16.4 代謝
16.5 排泄
健康成人男子にシルニジピン10mgを1日2回注)7日間反復経口投与した時、尿中に未変化体は検出されず、代謝物として総投与量の5.2%が排泄された9)。
注)本剤の承認された用法は、1日1回朝食後経口投与である。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
高血圧患者にシルニジピン10mgを単回経口投与した時の血漿中濃度推移は、腎機能の正常な患者と腎機能が低下した患者(血清クレアチニン値:1.5〜3.1mg/dL)との間に差を認めなかった。
腎機能が低下した患者にシルニジピン錠10mgを1日1回7日間反復経口投与した時にも、血漿中濃度推移には反復投与による影響は認められなかった11)。
腎機能が低下した患者にシルニジピン錠10mgを1日1回7日間反復経口投与した時にも、血漿中濃度推移には反復投与による影響は認められなかった11)。
16.8 その他
<シルニジピン錠20mg「NIG」>
シルニジピン錠20mg「NIG」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成24年2月29日 薬食審査発0229第10号)」に基づき、シルニジピン錠5mg「NIG」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた12)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
本態性高血圧症(軽症〜中等症)、腎障害を伴う高血圧症、重症高血圧症の患者を対象とした二重盲検比較試験を含む臨床試験における降圧率は表のとおりである13)14)15)16)17)18)19)20)21)22)。
| 高血圧症の分類 | 例数 | 下降例数(降圧率) |
| 本態性高血圧症(軽症〜中等症) | 591 | 524(88.7%) |
| 腎障害を伴う高血圧症 | 47 | 41(87.2%) |
| 重症高血圧症 | 51 | 47(92.2%) |
| 計 | 689 | 612(88.8%) |
本態性高血圧症(軽症〜中等症)患者を対象とした後期第II相及び二重盲検比較試験において、血圧が150/90mmHg未満にコントロールされた血圧正常化例は332例中218例であり、血圧正常化率は65.7%であった13)15)。
本態性高血圧症(軽症〜中等症)患者を対象としたβ遮断薬あるいは利尿薬との併用における降圧率は、それぞれ93.2%(41/44例)、92.0%(46/50例)であった15)。
本態性高血圧症(軽症〜中等症)患者を対象に48週間経口投与した長期投与試験における血圧コントロール状況は、「ほぼ良好」以上が94.6%(123/130例)であった16)。
本態性高血圧症(軽症〜中等症)患者を対象とした二重盲検比較試験の結果、シルニジピンの有用性が認められた13)。
18. 薬効薬理
18.1 作用機序
18.2 降圧作用
18.2.1 シルニジピンは、高血圧自然発症ラット、腎性高血圧ラット・イヌ、DOCA食塩高血圧ラット及び脳卒中易発症高血圧自然発症ラットの各種高血圧病態モデルにおける単回経口投与で、1mg/kgより用量依存的に緩徐で持続的な降圧作用を示した。一方、正常血圧ラットに対する降圧作用は弱かった。また、用量増加による作用時間の延長はみられなかった。シルニジピンは、腎性高血圧イヌにおいて、β遮断薬あるいはアンジオテンシン変換酵素阻害薬との併用で相加的な作用を示した31)32)33)。
18.2.2 シルニジピンは、脳卒中易発症高血圧自然発症ラット及び腎性高血圧イヌにおいて、反復経口投与で安定した降圧効果を示し、投与反復による作用の減弱及び休薬に伴う血圧のリバウンド現象を示さなかった34)35)。
18.2.3 シルニジピンは、無麻酔・無拘束の高血圧自然発症ラットにおける単回投与試験において、降圧時に心拍数の増加を示さなかった。また、降圧時に血漿中ノルアドレナリンの増加はみられず、交感神経遮断薬(グアネチジン硫酸塩)が示した血漿中ノルアドレナリンの減少も示さなかった。なお、ウサギにおいて自律神経節遮断薬(ペントリニウム)にみられたチルティング(傾斜位)による血圧の低下は示さなかった26)。
18.3 ストレス性昇圧抑制作用
18.3.1 シルニジピンは、無麻酔・無拘束の高血圧自然発症ラットにおいて、寒冷ストレス負荷時の昇圧及び血漿中ノルアドレナリンの増加を抑制し、また、エア・ジェットストレス(精神ストレス)負荷時の昇圧を抑制した28)29)。
18.3.2 寒冷ストレス負荷により、昇圧度が20%以上を示す健康成人男子において、寒冷ストレス負荷時の昇圧を抑制した30)。
18.4 交感神経電気刺激による昇圧の抑制作用
18.4.1 シルニジピンは、脊髄破壊した高血圧自然発症ラットの交感神経刺激による昇圧を抑制した36)。
18.4.2 高血圧自然発症ラットより摘出した腸間膜動脈血管灌流標本において、交感神経刺激時のノルアドレナリン放出を抑制した36)。
18.5 脳循環に対する影響
18.5.1 シルニジピンは、高血圧自然発症ラットにおいて、30〜40%の降圧を示す用量でも脳血流量を減少させず、降圧時にも脳血流自動調節機能をよく保持した37)。
18.5.2 脳血管障害を合併している高血圧症患者において、降圧時にも脳血流を維持した38)。
18.6 心機能に対する影響
18.6.1 シルニジピンは、イヌにおいて、拍動数の減少と心筋収縮力の低下を起こしたが、その用量は動脈血流量の増大を起こすよりも高用量であった31)。
18.6.2 シルニジピンは、麻酔開胸イヌにおいて、降圧用量で心筋酸素消費量を低下させた。この際、心拍数の増加あるいは心収縮力の抑制は示さなかった39)。
18.6.3 本態性高血圧症患者において降圧時に脈拍数に影響を与えなかった16)。
18.7 腎臓に対する影響
18.7.1 本態性高血圧症患者において、降圧時に腎機能に影響を及ぼさなかった40)。
19. 有効成分に関する理化学的知見
19.1. シルニジピン
20. 取扱い上の注意
開封後は遮光して保存すること。
22. 包装
<シルニジピン錠5mg「NIG」>
100錠[10錠(PTP)×10]
<シルニジピン錠10mg「NIG」>
100錠[10錠(PTP)×10]、500錠[10錠(PTP)×50]
<シルニジピン錠20mg「NIG」>
100錠[10錠(PTP)×10]
23. 主要文献
- 荻原定彦 他, 薬理と治療, 20 (Suppl.7), S1905-S1924, (1992)
- 舘田智昭 他, 薬理と治療, 20 (Suppl.7), S1925-S1943, (1992)
- 和田重次 他, 薬理と治療, 20 (Suppl.7), S1975-S1988, (1992)
- 松本 一 他, 薬理と治療, 28 (4), 253-258, (2000)
- 石井當男 他, 薬理と治療, 21 (Suppl.1), S7-S22, (1993)
- 石井當男 他, 薬理と治療, 21 (Suppl.1), S43-S52, (1993)
- 矢ヶ崎喜三郎 他, 医学と薬学, 62 (2), 307-315, (2009)
- 第十八改正日本薬局方 医薬品情報 JPDI2021, 338-339, (2021), (じほう)
- 石井當男 他, 薬理と治療, 21 (Suppl.1), S23-S41, (1993)
- 第十八改正日本薬局方解説書, C-2460-C-2465, (2021), (廣川書店)
- 久慈直光 他, 薬理と治療, 21 (Suppl.1), S193-S205, (1993)
- 社内資料:生物学的同等性試験
- 石井當男 他, 薬理と治療, 21 (1), 59-97, (1993)
- 冨永光裕 他, 臨牀と研究, 69 (10), 3321-3326, (1992)
- 石井當男 他, 薬理と治療, 21 (Suppl.1), S91-S121, (1993)
- 石井當男 他, 薬理と治療, 21 (Suppl.1), S123-S153, (1993)
- 猿田享男 他, 薬理と治療, 21 (Suppl.1), S171-S191, (1993)
- 飯村 攻 他, 薬理と治療, 21 (Suppl.1), S155-S170, (1993)
- 石井當男 他, 薬理と治療, 21 (Suppl.1), S65-S77, (1993)
- 石井當男 他, 薬理と治療, 21 (Suppl.1), S53-S64, (1993)
- 石井當男 他, 薬理と治療, 21 (Suppl.1), S79-S90, (1993)
- 堀内 至 他, 薬理と治療, 21 (Suppl.1), S233-S245, (1993)
- Oike,M.et al., Circ.Res., 67 (4), 993-1006, (1990) »PubMed
- Hosono,M.et al., J.Pharmacobio-Dyn., 15, 547-553, (1992) »PubMed
- Fujii,S.et al., J.Pharmacol.Exp.Ther., 280 (3), 1184-1191, (1997) »PubMed
- 細野昌宏 他, 薬理と治療, 23 (11), 3029-3040, (1995)
- 南 順一 他, Therapeutic Research., 19 (1), 45-49, (1998)
- Hosono,M.et al., Jpn.J.Pharmacol., 69 (2), 119-125, (1995) »PubMed
- 細野昌宏 他, 薬理と治療, 23 (12), 3187-3191, (1995)
- 栽原伸一郎 他, 薬理と治療, 21 (Suppl.1), S271-S276, (1993)
- Ikeda,K.et al., Pharmacometrics., 44 (4), 433-442, (1992)
- Yoshimoto,R.et al., Pharmacometrics., 44 (1), 45-51, (1992)
- 渡辺 潔 他, 薬理と治療, 23 (11), 3001-3011, (1995)
- 渡辺 潔 他, 薬理と治療, 23 (11), 3013-3019, (1995)
- 高原 章 他, 日薬理誌, 106 (4), 279-287, (1995) »PubMed
- Hosono,M.et al., Jpn.J.Pharmacol., 69 (2), 127-134, (1995) »PubMed
- 渡辺 潔 他, 日薬理誌, 106 (6), 393-399, (1995) »PubMed
- 成冨博章 他, 薬理と治療, 21 (Suppl.1), S259-S269, (1993)
- Chibana,T.et al., Jpn.Heart J., 33 (2), 239-252, (1992) »PubMed
- 常田康夫 他, 薬理と治療, 21 (Suppl.1), S207-S216, (1993)
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工岐阜工場株式会社
富山市総曲輪1丁目6番21
26.2 発売元
日医工株式会社
富山市総曲輪1丁目6番21
26.3 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号