医薬品情報
| 総称名 | メトジェクト |
|---|---|
| 一般名 | メトトレキサート |
| 欧文一般名 | Methotrexate |
| 製剤名 | メトトレキサート皮下注 |
| 薬効分類名 | 抗リウマチ剤 |
| 薬効分類番号 | 3999 |
| ATCコード | L04AX03 |
| KEGG DRUG |
D00142
メトトレキサート
|
| KEGG DGROUP |
DG02018
代謝拮抗薬
DG01985
疾患修飾性抗リウマチ薬 (DMARD)
|
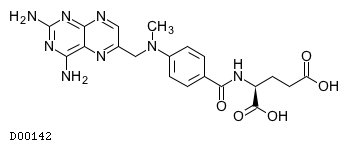
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第7版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メトジェクト皮下注7.5mgシリンジ0.15mL | Metoject Subcutaneous Injection Syringe | 日本メダック | 3999468G1028 | 1752円/筒 | 劇薬, 処方箋医薬品注) |
| メトジェクト皮下注10mgシリンジ0.20mL | Metoject Subcutaneous Injection Syringe | 日本メダック | 3999468G2024 | 2124円/筒 | 劇薬, 処方箋医薬品注) |
| メトジェクト皮下注12.5mgシリンジ0.25mL | Metoject Subcutaneous Injection Syringe | 日本メダック | 3999468G3020 | 2491円/筒 | 劇薬, 処方箋医薬品注) |
| メトジェクト皮下注15mgシリンジ0.30mL | Metoject Subcutaneous Injection Syringe | 日本メダック | 3999468G4027 | 2830円/筒 | 劇薬, 処方箋医薬品注) |
| メトジェクト皮下注7.5mgペン0.15mL | Metoject Subcutaneous Injection Pen | 日本メダック | 3999468G5023 | 1938円/キット | 劇薬, 処方箋医薬品注) |
| メトジェクト皮下注10mgペン0.20mL | Metoject Subcutaneous Injection Pen | 日本メダック | 3999468G6020 | 2310円/キット | 劇薬, 処方箋医薬品注) |
| メトジェクト皮下注12.5mgペン0.25mL | Metoject Subcutaneous Injection Pen | 日本メダック | 3999468G7026 | 2652円/キット | 劇薬, 処方箋医薬品注) |
| メトジェクト皮下注15mgペン0.30mL | Metoject Subcutaneous Injection Pen | 日本メダック | 3999468G8022 | 2972円/キット | 劇薬, 処方箋医薬品注) |
1. 警告
1.1 本剤の投与において、感染症、肺障害、血液障害等の重篤な副作用により、致命的な経過をたどることがあるので、緊急時に十分に措置できる医療施設及び本剤についての十分な知識と適応疾患の治療経験をもつ医師が使用すること。
1.2 間質性肺炎、肺線維症等の肺障害が発現し、致命的な経過をたどることがあるので、原則として、呼吸器に精通した医師と連携して使用すること。
1.3 本剤の投与に際しては、患者に対して本剤の危険性や本剤の投与が長期間にわたることを十分説明した後、患者が理解したことを確認したうえで投与を開始すること。
1.4 本剤の投与に際しては、副作用の発現の可能性について患者に十分理解させ、下記の症状が認められた場合には直ちに連絡するよう注意を与えること。
1.5 使用が長期間にわたると副作用が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。
1.6 腎機能が低下している場合には副作用が強くあらわれることがあるため、本剤投与開始前及び投与中は腎機能検査を行うなど、患者の状態を十分観察すること。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
6. 用法及び用量
通常、成人にはメトトレキサートとして7.5mgを週に1回皮下注射する。なお、患者の状態、忍容性等に応じて適宜増量できるが、15mgを超えないこと。
7. 用法及び用量に関連する注意
7.1 4週を目安に患者の状態を十分に確認し、増量の可否を慎重に判断すること。増量は2.5mgずつとすること。
7.2 メトトレキサート経口製剤から本剤へ切り替える場合には患者の状態、忍容性等を考慮し、下表を参考に、初回用量を決定すること。なお、切替え時には副作用の発現に十分注意すること。
| 1週間あたりのメトトレキサート経口製剤の投与量 | 本剤の初回用量 |
| 6mg | 7.5mg |
| 8又は10mg | 7.5又は10mg |
| 12〜16mg | 10又は12.5mg |
8. 重要な基本的注意
8.1 本剤は1週間のうちの特定の日に投与するので、患者に対して誤用、過量投与を防止するための十分な投与指導を行うこと。
8.2 尿量、排尿回数をチェックし、排尿が少ないと判断したときは、点滴又は経口により水分を補給し排尿を促すこと。
8.3 骨髄抑制、肝・腎機能障害等の重篤な副作用が起こることがあるので、本剤投与開始前及び投与中、4週間ごとに臨床検査(血液検査、肝機能・腎機能検査、尿検査等)を行うなど、患者の状態を十分観察すること。[11.1.2、11.1.5、11.1.6参照]
8.5
本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加え、インターフェロン-γ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。結核の既往歴を有する場合及び結核感染が疑われる場合には、結核の診療経験がある医師に相談すること。以下のいずれかの患者には、原則として本剤の開始前に適切な抗結核薬を投与すること。
・胸部画像検査で陳旧性結核に合致するか推定される陰影を有する患者
・結核の治療歴(肺外結核を含む)を有する患者
・インターフェロン-γ遊離試験やツベルクリン反応検査等の検査により、既感染が強く疑われる患者
・結核患者との濃厚接触歴を有する患者
また、本剤投与中も、胸部X線検査等の適切な検査を定期的に行うなど結核の発現には十分に注意し、患者に対し、結核を疑う症状が発現した場合(持続する咳、発熱等)には速やかに主治医に連絡するよう説明すること。なお、結核の活動性が確認された場合は本剤を投与しないこと。[9.1.2参照]
8.6 出血性腸炎、消化管潰瘍・出血等の消化管障害があらわれることがあるので、口内炎、激しい腹痛、嘔吐、下痢等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。また、患者に対し、口内炎があらわれた場合には、直ちに連絡するよう注意を与えること。[1.4、11.1.9参照]
8.8 インフリキシマブとの併用療法を行う際には、両剤の電子添文を熟読し、リスク・ベネフィットを判断した上で投与すること。
8.9 投与が長期間にわたると肝組織の線維化・硬変があらわれるおそれがある。
8.10 悪性リンパ腫、リンパ増殖性疾患、急性白血病、骨髄異形成症候群(MDS)等があらわれることがあるので、患者の状態を十分に観察し、異常が認められた場合には投与を中止し、適切な処置を行うこと。[15.1.1参照]
8.11 免疫機能が抑制された患者への生ワクチン接種により、ワクチン由来の感染を増強又は持続させるおそれがあるので、本剤投与中に生ワクチンを接種しないこと。
8.13 副作用の予防対策については、最新の学会ガイドラインも参考にすること。
8.14 本剤の投与開始にあたっては、医療施設において、必ず医師によるか、医師の直接の監督のもとで投与を行うこと。自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施したのち、本剤投与による危険性と対処法について患者が理解し、患者自ら確実に投与できることを確認した上で、医師の管理指導のもとで実施すること。また、適用後、感染症等本剤による副作用が疑われる場合や、自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止させ、医師の管理下で慎重に観察するなど適切な処置を行うこと。シリンジ又はペンの安全な廃棄方法に関する指導を行うと同時に、使用済みのシリンジ又はペンを廃棄する容器を提供すること。
8.15 投与量を増量すると骨髄抑制、感染症、肝機能障害等の副作用の発現の可能性が増加するので、定期的に臨床検査値を確認する等を含め患者の状態を十分に観察すること。消化器症状、肝機能障害等の副作用の予防には、葉酸の投与が有効であるとの報告がある。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 感染症の患者又は感染症が疑われる患者[11.1.3参照]
9.1.2 結核の既感染者(特に結核の既往歴のある患者及び胸部レントゲン上結核治癒所見のある患者)又は結核感染が疑われる患者
定期的に胸部X線検査等を行い、結核症状の発現に十分に注意すること。本剤は結核を活動化させるおそれがある。[8.5参照]
9.1.3 B型又はC型肝炎ウイルスキャリアの患者
9.1.4 間質性肺炎、肺線維症等の肺障害又はその既往歴のある患者
9.1.5 水痘患者
致命的な全身障害があらわれることがある。
9.1.6 アルコール常飲者
肝障害を増悪させるおそれがある。
9.2 腎機能障害患者
投与しないこと。副作用が強くあらわれるおそれがある。[2.5参照]
9.3 肝機能障害患者
9.3.1 慢性肝疾患のある患者
投与しないこと。副作用が強くあらわれるおそれがある。[2.4参照]
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性に投与する場合は、投与中及び投与終了後少なくとも1月経周期は妊娠を避けるよう注意を与えること。男性に投与する場合は、投与中及び投与終了後少なくとも3カ月間はパートナーの妊娠を避けるよう注意を与えること。
9.4.2 生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。催奇形性を疑う症例報告があり、また、動物実験(マウス、ラット及びウサギ)で胎児死亡及び催奇形作用が報告されている。[2.1参照]
9.6 授乳婦
授乳を避けさせること。母乳中への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
腎機能検査値に十分注意し、患者の状態を観察しながら用量に留意して慎重に投与すること。腎機能等生理機能が低下していることが多く、メトトレキサートの排泄遅延により副作用があらわれやすい。また、免疫機能低下の影響を受けやすいため、重篤な感染症があらわれやすい。
10. 相互作用
10.2 併用注意
| サリチル酸等の非ステロイド性抗炎症剤 | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 主として、非ステロイド性抗炎症剤の腎におけるプロスタグランジン合成阻害作用による腎血流量の低下及びナトリウム、水分貯留傾向のためメトトレキサートの排泄が遅延するためと考えられている。 |
| スルホンアミド系薬剤 テトラサイクリン クロラムフェニコール フェニトイン バルビツール酸誘導体 | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 併用薬剤が血漿蛋白と結合しているメトトレキサートを競合的に置換遊離し、メトトレキサートの濃度を上昇させ、その毒性を増強させる。 |
| スルファメトキサゾール・トリメトプリム | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 両薬剤の葉酸代謝阻害作用が協力的に作用するためと考えられている。 |
| ペニシリン(ピペラシリンナトリウム等) プロベネシド | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 併用薬剤がメトトレキサートの腎排泄を競合的に阻害するためと考えられている。 |
| シプロフロキサシン | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 発現機序の詳細は不明であるが、メトトレキサートの腎尿細管からの排泄が阻害されるためと考えられている。 |
| レフルノミド | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 併用により骨髄抑制等の副作用を増強するためと考えられている。 |
| プロトンポンプ阻害剤(オメプラゾール、ラベプラゾール、ランソプラゾール等) | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 機序は不明であるが、メトトレキサートの血中濃度が上昇することがある。 |
| ポルフィマーナトリウム | 光線過敏症を起こすことがある。 | ポルフィマーナトリウムは光感受性を高める作用があるため、光線過敏症を起こしやすい薬剤の作用を増強する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。骨髄抑制、肝機能障害、粘膜・消化管障害等の細胞毒性に起因する副作用が発現した場合には、適切な処置を行いながら、本剤の拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(冷感、呼吸困難、血圧低下等)があらわれることがある。
11.1.2 骨髄抑制(5%以上)
汎血球減少、無顆粒球症(前駆症状として発熱、咽頭痛、インフルエンザ様症状等があらわれる場合がある)、白血球減少、血小板減少、貧血等の骨髄抑制、再生不良性貧血があらわれることがある。[8.3参照]
11.1.3 感染症(0.1〜5%未満)
11.1.4 結核(頻度不明)
11.1.5 劇症肝炎、肝不全(いずれも頻度不明)
11.1.6 急性腎障害、尿細管壊死、重症ネフロパチー(いずれも頻度不明)
急性腎障害、尿細管壊死、重症ネフロパチー等の重篤な腎障害があらわれることがある。[8.3参照]
11.1.7 間質性肺炎、肺線維症、胸水(いずれも頻度不明)
間質性肺炎、肺線維症、胸水等があらわれ、呼吸不全にいたることがあるので、投与開始後は観察を十分に行い、発熱、咳嗽、呼吸困難等の呼吸器症状があらわれた場合には、速やかに胸部X線検査、胸部CT検査、血液ガス検査、血中KL-6測定等を行い、本剤の投与を中止するとともに、ニューモシスティス肺炎との鑑別診断(β-Dグルカンの測定等)を考慮に入れ副腎皮質ホルモン剤の投与等の適切な処置を行うこと。[9.1.4参照]
11.1.8 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
中毒性表皮壊死融解症、皮膚粘膜眼症候群等の重篤な皮膚障害があらわれることがある。発熱、紅斑、そう痒感、眼充血、口内炎等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.9 出血性腸炎、壊死性腸炎(いずれも頻度不明)
出血性腸炎、壊死性腸炎等の重篤な腸炎があらわれることがある。激しい腹痛、下痢等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。[8.6参照]
11.1.10 膵炎(頻度不明)
11.1.11 骨粗鬆症(頻度不明)
骨塩量減少等の異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
11.1.12 脳症(白質脳症を含む)(頻度不明)
11.1.13 進行性多巣性白質脳症(PML)(頻度不明)
本剤投与中及び投与終了後は患者の状態を十分に観察すること。意識障害、認知機能障害、麻痺症状(片麻痺、四肢麻痺)、構音障害、失語等の症状があらわれた場合は、MRIによる画像診断及び脳脊髄液検査を行うとともに、投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒、発熱、蕁麻疹 | ||
| 血液 | 白血球数減少 | 好中球数減少、貧血、骨髄抑制 | 好酸球増多、出血、低ガンマグロブリン血症、リンパ節腫脹 |
| 肝臓 | 肝機能障害(ALT、AST、AL-Pの上昇等) | LDHの上昇、黄疸、脂肪肝 | |
| 腎臓 | クレアチニンの上昇 | BUN上昇、血尿、蛋白尿 | |
| 消化器 | 悪心、口内炎 | 嘔吐、舌炎、腹部不快感、口角口唇炎、舌痛、口唇びらん、口腔粘膜びらん、口腔咽頭痛、咽頭炎、上咽頭炎、歯肉炎、食道カンジダ症、歯膿瘍、歯肉痛、口腔ヘルペス | 腹痛、下痢、食欲不振、口唇腫脹、消化管潰瘍・出血、メレナ、イレウス |
| 皮膚 | 紅斑、爪線状隆起、蜂巣炎、単純ヘルペス | 脱毛、皮下斑状出血、皮膚潰瘍、光線過敏症、色素沈着、色素脱出、ざ瘡、結節、乾癬病変局面の有痛性びらん | |
| 投与部位 | 注射部位反応(そう痒感、紅斑、疼痛、出血、変色、内出血、腫脹、硬結等) | ||
| 精神神経系 | めまい | 頭痛、意識障害、眠気、目のかすみ、しびれ感、味覚異常、項部緊張、背部痛、錯感覚 | |
| 呼吸器 | 気管支炎、副鼻腔炎 | 咳嗽、呼吸困難 | |
| 生殖器 | 無精子症、卵巣機能不全、月経不全、流産 | ||
| その他 | 倦怠感、胸痛、疲労、関節炎、足部白癬 | 動悸、胸部圧迫感、低蛋白血症、血清アルブミン減少、浮腫、膀胱炎、結膜炎、関節痛、耳下腺炎、悪寒 |
12. 臨床検査結果に及ぼす影響
トリメトプリム(スルファメトキサゾール・トリメトプリム配合剤)を併用した場合、2水素葉酸還元酵素(dihydrofolate reductase:DHFR)を用いたメトトレキサート濃度の測定で見かけ上高値を呈することがあるので注意すること。
13. 過量投与
13.1 症状
外国で週間総用量が20mgを超えると重篤な副作用、特に骨髄抑制の発生率等が有意に上昇するという報告がある。過量投与時に報告された主な症状は血液障害及び消化管障害であった。また、重篤な副作用を発現し、致命的な経過をたどった症例が報告されている。
13.2 処置
過量投与したときは、すみやかに本剤の拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与するとともに、本剤の排泄を促進するために水分補給と尿のアルカリ化を行うこと。本剤とホリナートカルシウムの投与間隔が長いほど、ホリナートカルシウムの効果が低下することがある。
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 注射部位は大腿部、腹部又は上腕部を選び、順番に場所を変更し、短期間に同一部位へ繰り返し注射は行わないこと。注射部位は毎回異なる部位(対側など)に行うこと。
14.1.2 本剤は1回使用の製剤であり、再使用しないこと。
14.1.3 皮膚が敏感な部位、皮膚に異常のある部位(傷、発赤、硬結等)には注射しないこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤の投与中に発現したリンパ増殖性疾患の中には、本剤投与中止により消退したとの報告もある。[8.10参照]
15.1.2 免疫機能が抑制された患者にワクチンを接種した場合、抗体反応の欠如が報告されている。
16. 薬物動態
16.1 血中濃度
16.1.1 日本人関節リウマチ患者6例に本剤10mgを皮下投与した時の血漿中濃度推移及び薬物動態パラメータを以下に示す1)。
本剤10mgを皮下投与したときの血漿中メトトレキサート濃度推移(平均値±標準偏差、6例)
| AUC0-inf(ng・h/mL) | Cmax(ng/mL) | CL(L/h) | Vd(L) | T1/2(h) | Tmax(h) |
| 1640±456 | 479±107 | 6.46±1.56 | 26.0±4.78 | 2.96±1.14 | 0.50(0.25,0.75) |
16.1.2 外国人健康成人に本剤又は経口メトトレキサート(7.5又は15mg)を単回投与したときの薬物動態パラメータを以下に示す2)。
| 用量(mg) | 例数 | AUC0-inf(ng・h/mL) | Cmax(ng/mL) | T1/2(h) | Tmax(h) | |
| 本剤 | 7.5 | 14 | 820±80 | 188±31 | 2.91±0.44 | 0.63(0.50,2.00) |
| 15 | 14 | 1642±187 | 405±108 | 2.79±0.41 | 0.75(0.50,1.50) | |
| 経口メトトレキサート | 7.5 | 14 | 626±115 | 190±41 | 3.02±0.65 | 1.00(0.50,1.50) |
| 15 | 14 | 1163±298 | 316±94 | 3.38±1.34 | 1.00(0.75,2.50) |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
(1)二重盲検期(12週間)
メトトレキサート未治療の関節リウマチ患者(本剤群:52例、メトトレキサート経口製剤群:49例)を対象にメトトレキサート経口製剤対照無作為化二重盲検並行群間比較試験を実施した。本剤7.5mgを週1回皮下投与又はメトトレキサート8mg(1週間あたり)を経口投与したときの、投与12週時におけるACR20%、50%及び70%達成率は、本剤群で59.6%(31/52例)、26.9%(14/52例)及び9.6%(5/52例)、メトトレキサート経口製剤群で51.0%(25/49例)、24.5%(12/49例)及び16.3%(8/49例)であった。
副作用は本剤群25.0%(13/52例)に認められ、主な副作用は口内炎5.8%(3/52例)であった3)。
副作用は本剤群25.0%(13/52例)に認められ、主な副作用は口内炎5.8%(3/52例)であった3)。
(2)継続投与期(52週間)
すべての患者で本剤を週1回皮下投与した。用量は、4週ごとの有効性及び安全性評価基準に合致した場合は2.5mgずつ増量し、最大15mgとした。二重盲検期に本剤群であった患者における投与64週時のACR20%、50%及び70%達成率は、59.6%(31/52例)、51.9%(27/52例)及び42.3%(22/52例)であった。
副作用は、継続投与期からの参加例11例を含む本剤投与例の54.1%(59/109例)に認められ、主な副作用は悪心13.8%(15/109例)、口内炎11.9%(13/109例)、ALT増加9.2%(10/109例)、白血球数減少8.3%(9/109例)及び肝機能異常8.3%(9/109例)であった3)。
副作用は、継続投与期からの参加例11例を含む本剤投与例の54.1%(59/109例)に認められ、主な副作用は悪心13.8%(15/109例)、口内炎11.9%(13/109例)、ALT増加9.2%(10/109例)、白血球数減少8.3%(9/109例)及び肝機能異常8.3%(9/109例)であった3)。
18. 薬効薬理
18.1 作用機序
メトトレキサートは5-アミノイミダゾール-4-カルボキサミドリボヌクレオチドトランスホルミラーゼ(ATIC)阻害を介したアデノシン情報伝達促進により、各種免疫細胞に対して抗炎症作用を示す。また、メトトレキサートのジヒドロ葉酸還元酵素(DHFR)阻害を介したテトラヒドロビオプテリン(BH4)枯渇により一酸化窒素合成酵素(NOS)脱共役が生じ、T細胞のアポトーシスに対する感受性が増加して免疫反応が抑制される。さらに、メトトレキサートはアデノシン情報伝達促進作用及びBH4枯渇によるNOS脱共役を介してT細胞や滑膜線維芽細胞(FLS)での核内因子κB(NF-κB)活性化を抑制する。以上のように、メトトレキサートはRAの病態形成に関与する種々の細胞に対して、アデノシン情報伝達を始めとする複数の分子作用機序を介して免疫及び炎症性反応を抑制し、抗RA作用を示すと考えられる4)5)6)7)8)9)10)11)。
18.2 ラット慢性関節炎モデルに対する作用
ラットのコラーゲン誘導関節炎(CIA)モデルにおいて、低用量メトトレキサートの皮下投与は後肢腫脹の抑制などの病態進展を抑制する12)。
19. 有効成分に関する理化学的知見
19.1. メトトレキサート
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
メトジェクト皮下注7.5mgシリンジ0.15mL
1シリンジ
メトジェクト皮下注10mgシリンジ0.20mL
1シリンジ
メトジェクト皮下注12.5mgシリンジ0.25mL
1シリンジ
メトジェクト皮下注15mgシリンジ0.30mL
1シリンジ
メトジェクト皮下注7.5mgペン0.15mL
1本
メトジェクト皮下注10mgペン0.20mL
1本
メトジェクト皮下注12.5mgペン0.25mL
1本
メトジェクト皮下注15mgペン0.30mL
1本
23. 主要文献
- 社内資料:国内第III相試験(2022年9月26日承認、CTD272)
- 社内資料:海外第I相試験(2022年9月26日承認、CTD271)
- 社内資料:国内第III相試験(2022年9月26日承認、CTD273,274)
- Chan ES,et al., Nat Rev Rheumatol., 6 (3), 175-8, (2010) »PubMed
- Bedoui Y,et al., Int J Mol Sci., 20 (20), 5023, (2019) »PubMed
- Friedman B,et al., Joint Bone Spine., 86 (3), 301-7, (2019) »PubMed
- Cronstein BN,et al., Nat Rev Rheumatol., 13 (1), 41-51, (2017) »PubMed
- Cronstein BN,et al., Nat Rev Rheumatol., 16 (3), 145-54, (2020) »PubMed
- Spurlock CF.3rd,et al., Rheumatology(Oxford)., 54 (1), 178-87, (2015) »PubMed
- Spurlock CF.3rd,et al., Arthritis Rheum., 63 (9), 2606-16, (2011) »PubMed
- Spurlock CF.3rd,et al., Arthritis Rheum., 64 (6), 1780-9, (2012) »PubMed
- Liu DY,et al., Biopharm.Drug Dispos., 34, 203-14, (2013) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売元
日本メダック株式会社
東京都中央区日本橋本町3丁目11番5号
26.2 販売元
エーザイ株式会社
東京都文京区小石川4-6-10