医薬品情報
| 総称名 | アセノベル |
|---|---|
| 一般名 | アセノイラミン酸 |
| 欧文一般名 | Aceneuramic Acid |
| 製剤名 | アセノイラミン酸製剤 |
| 薬効分類名 | 縁取り空胞を伴う遠位型ミオパチー治療剤 |
| 薬効分類番号 | 1900 |
| ATCコード | M09AX05 |
| KEGG DRUG |
D11016
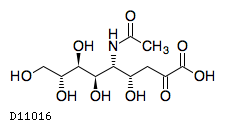
アセノイラミン酸
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第4版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アセノベル徐放錠500mg | Acenobel Extended Release Tablets 500mg | ノーベルファーマ | 1900001G1020 | 2886.2円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
「15.1 臨床使用に基づく情報」及び「17.臨床成績」項の内容を熟知し、臨床試験で対象とされた患者背景、本剤の有効性及び安全性を十分に理解した上で、本剤の投与が適切と判断される患者に使用すること。
6. 用法及び用量
通常、成人にはアセノイラミン酸として1回2gを1日3回食後に経口投与する。なお、投与間隔は約8時間とすることが望ましい。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁移行が認められている。
9.7 小児等
小児を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 精神・神経 | 頭痛 | ||
| 消化器 | 便秘、軟便 | 口角口唇炎 | |
| 肝臓 | ALT上昇、AST上昇、γ-GTP上昇等の肝機能障害 | ||
| 皮膚・皮下組織 | 発疹 | ||
| 筋骨格 | 四肢痛 | ||
| 臨床検査 | 尿中蛋白陽性、尿中ケトン体陽性 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 本剤は吸湿性があるため、患者にはボトル包装品のまま交付すること。
14.1.2 ボトル開封後は、使用の都度、蓋をしっかりと締め、高温多湿を避けて保存するように指示すること。
14.1.3 本剤は徐放性の製剤であるため、噛まずに服用するように指示すること。
14.2 薬剤投与時の注意
本剤を飲みにくい場合には多めの水で1錠ずつ、服用させること。
15. その他の注意
15.1 臨床使用に基づく情報
海外において、6分間歩行試験で200m以上歩行できるGNE遺伝子変異を有する縁取り空胞を伴う遠位型ミオパチー患者を対象としたプラセボ対照二重盲検比較試験における、主要評価項目である上肢筋力合計点数のベースラインから最終評価時点(治験薬投与48週)までの変化量は表1のとおりであり、プラセボ群と本剤の間に統計学的な有意差は認められなかった1)2)。
| 投与群 | 評価例数 | ベースライン (平均値±標準偏差) | 変化量 (最小二乗平均値±標準誤差) | 変化量の群間差[95%信頼区間] | P値 |
| プラセボ群 | 43 | 56.31±29.29 | −2.99±0.87 | / | / |
| 本剤群 | 45 | 55.99±26.95 | −2.25±0.77 | 0.74 [−1.61,3.09] | 0.5387 |
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
縁取り空胞を伴う遠位型ミオパチー患者3例に本剤2gを単回経口投与したときの血清中遊離アセノイラミン酸濃度の推移と薬物動態パラメータは以下のとおりであった3)。
図1 本剤2g単回経口投与前後の血清中遊離アセノイラミン酸濃度の推移
| 薬物動態パラメータ | 中央値(最小値、最大値) |
| Cmax(μg/mL) | 0.319(0.106、0.624) |
| tmax | 2(1、4) |
| AUC(μg・h/mL) | 2.074(1.271、2.328) |
16.1.2 反復投与
縁取り空胞を伴う遠位型ミオパチー患者15例に本剤1回2gを1日3回食後に48週間経口投与したときの血清中遊離アセノイラミン酸濃度(トラフ値)は以下のとおりであった4)。
| 投与開始前 | 8週 | 16週 | 24週 | 32週 | 40週 | 48週 |
| 0.150±0.058 | 0.423±0.154 | 0.529±0.194 | 0.397±0.163 | 0.450±0.199 | 0.465±0.144 | 0.543±0.425 |
16.2 吸収
外国人縁取り空胞を伴う遠位型ミオパチー患者6例に本剤6gを空腹時又は食後に単回投与したときの血清中遊離アセノイラミン酸濃度の推移と薬物動態パラメータは以下のとおりであった5)。
図2 本剤6gを単回経口投与したときの血清中遊離アセノイラミン酸濃度への食事の影響
| 薬物動態パラメータ | 空腹時 (平均値±標準偏差) | 食後 (平均値±標準偏差) |
| Cmax(μg/mL) | 0.351±0.14 | 0.324±0.12 |
| AUCt(μg・hr/mL) | 2.592±1.41 | 3.934±0.83 |
| t1/2(hr) | 2.455±1.06 | 3.714±1.07 |
16.3 分布
ヒトにおけるアセノイラミン酸のタンパク結合率(平均値±標準偏差)は、3.1±3.1%であった6)(in vitro)。
16.4 代謝
16.5 排泄
縁取り空胞を伴う遠位型ミオパチー患者3例に本剤1回2gを1日3回食後に7日間経口投与したとき、投与24時間までの尿中遊離アセノイラミン酸の排泄量注1)(平均値±標準偏差)は、投与1日目では25.6±8.4mg、投与7日目では29.3±16.0mgであった。
注1)本剤を投与していない状態で測定した24時間までの内因性の尿中遊離アセノイラミン酸の排泄量をベースラインとし、ベースラインで補正した排泄量から算出した6)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験[1](シアル酸-3試験)
GNE遺伝子変異を有する縁取り空胞を伴う遠位型ミオパチー患者20例(うち6分間歩行試験の歩行距離200m以上が18例)を対象としたプラセボ対照二重盲検比較試験が実施された。その結果、主要評価項目である上肢筋力合計点数のベースラインから最終評価時点(治験薬投与48週)までの変化量は表5のとおりであった。
副作用は25.0%(4/16例)に認められ、口角口唇炎、頭痛、便秘、発疹、四肢痛が各1例であった4)。
副作用は25.0%(4/16例)に認められ、口角口唇炎、頭痛、便秘、発疹、四肢痛が各1例であった4)。
| 投与群 | 評価例数 | ベースライン (平均値±標準偏差) | 変化量 (最小二乗平均値±標準誤差) | 変化量の群間差[95%信頼区間] |
| プラセボ群 | 4 | 46.04±22.75 | −6.18±2.92 | / |
| 本剤群 | 15 | 31.50±14.56 | −1.40±2.11 | 4.78[−0.31,9.87] |
17.1.2 国内第III相試験[2](NPC-09-1試験)
GNEミオパチー機能活動尺度(GNEM-FAS)の上肢部分の点数が24点以上かつ罹病期間が5年以上15年以下のGNE遺伝子変異を有する縁取り空胞を伴う遠位型ミオパチー患者14例を対象としたプラセボ対照二重盲検比較試験が実施された。その結果、主要評価項目である上肢筋力合計点数のベースラインから最終評価時点(治験薬投与48週)までの変化量は表6のとおりであった。
副作用は認められなかった9)。
副作用は認められなかった9)。
| 投与群 | 評価例数 | ベースライン (平均値±標準偏差) | 変化量 (最小二乗平均値±標準誤差) | 変化量の群間差[95%信頼区間] |
| プラセボ群 | 4 | 26.55±8.74 | −2.63±1.73 | / |
| 本剤群 | 10 | 32.77±12.37 | −0.12±1.09 | 2.51[−1.72,6.74] |
18. 薬効薬理
18.1 作用機序
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. アセノイラミン酸
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
168錠[瓶(ボトル)、バラ、乾燥剤入り]
23. 主要文献
- Lochmuller H.et al., Neurology., 92 (18), e2109-e2117, (2019), (2019 Apr 30)
- 社内資料:外国第III相試験(2024年3月26日承認、申請資料概要2.7.6.7)
- Suzuki N.et al., Translational Medicine Communications., 3 (7), (2018)
- 社内資料:国内第II/III相試験(2024年3月26日承認、申請資料概要2.7.6.1)
- 社内資料:外国第I相試験(2024年3月26日承認、申請資料概要2.7.2.2.3)
- 佐藤雅樹ほか, 薬物動態, 6, 75-83, (1991)
- Cheng C.et al., Carbohydr Res, 516, 108561, (2022)
- 社内資料:ラットにおける単回静脈内投与後の血中濃度推移、組織分布、代謝及び排泄試験(2024年3月26日承認、申請資料概要2.6.4.3、2.6.4.4、2.6.4.5、2.6.4.6)
- 社内資料:国内有効性確認試験(2024年3月26日承認、申請資料概要2.7.6.3)
- Noguchi S.et al., J Biol Chem., 279 (12), 11402-7, (2004), (2004 Mar 19)
- Malicdan MC.et.al., Nat Med., 15 (6), 690-5, (2009), (2009 Jun)
- 野口悟ほか, Brain and Nerve, 62 (6), 601-7, (2010) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ノーベルファーマ株式会社
カスタマーセンター
〒104-0033
東京都中央区新川1-17-24
電話:フリーダイヤル:0120-003-140
製品情報問い合わせ先
ノーベルファーマ株式会社
カスタマーセンター
〒104-0033
東京都中央区新川1-17-24
電話:フリーダイヤル:0120-003-140
26. 製造販売業者等
26.1 製造販売元
ノーベルファーマ株式会社
東京都中央区新川1-17-24