医薬品情報
| 総称名 | ジオトリフ |
|---|---|
| 一般名 | アファチニブマレイン酸塩 |
| 欧文一般名 | Afatinib Maleate |
| 製剤名 | アファチニブマレイン酸塩製剤 |
| 薬効分類名 | 抗悪性腫瘍剤 チロシンキナーゼ阻害剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01EB03 |
| KEGG DRUG |
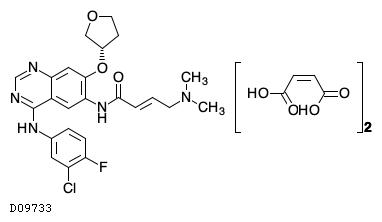
D09733
アファチニブマレイン酸塩
|
| KEGG DGROUP |
DG03162
EGFR阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジオトリフ錠20mg | Giotrif Tablets 20mg | 日本ベーリンガーインゲルハイム | 4291030F1020 | 4346.7円/錠 | 劇薬, 処方箋医薬品注) |
| ジオトリフ錠30mg | Giotrif Tablets 30mg | 日本ベーリンガーインゲルハイム | 4291030F2027 | 6352.3円/錠 | 劇薬, 処方箋医薬品注) |
| ジオトリフ錠40mg | Giotrif Tablets 40mg | 日本ベーリンガーインゲルハイム | 4291030F3023 | 8367.6円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
1.1 本剤は、緊急時に十分に対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、電子添文を参照して、適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に本剤の有効性及び危険性(特に、間質性肺疾患の初期症状、服用中の注意事項、死亡に至った症例があること等に関する情報)を十分に説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者[11.1.9参照]
4. 効能または効果
EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌
5. 効能または効果に関連する注意
5.1 EGFR遺伝子変異検査を実施すること。EGFR遺伝子変異不明例の扱い等を含めて、本剤を投与する際は、日本肺癌学会の「肺癌診療ガイドライン」等の最新の情報を参考に行うこと。
5.2 本剤の術後補助化学療法における有効性及び安全性は確立していない。
5.3 がん化学療法歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと。
6. 用法及び用量
通常、成人にはアファチニブとして1日1回40mgを空腹時に経口投与する。なお、患者の状態により適宜増減するが、1日1回50mgまで増量できる。
7. 用法及び用量に関連する注意
7.1 副作用が発現した場合は、症状、重症度等に応じて、以下の基準を考慮し、休薬、減量又は中止すること。[11.1.1-11.1.8参照]
| 副作用のグレード注1) | 休薬及び減量基準 |
| グレード1又は2 | 同一投与量を継続 |
| グレード2(症状が持続的注2)又は忍容できない場合)若しくはグレード3以上 | 症状がグレード1以下に回復するまで休薬する。回復後は休薬前の投与量から10mg減量して再開する注3)、4)。 |
7.2 1日1回40mgで3週間以上投与し、下痢、皮膚障害、口内炎及びその他のグレード2以上の副作用が認められない場合は1日1回50mgに増量してもよい。
7.3 食後に本剤を投与した場合、Cmax及びAUCが低下するとの報告がある。食事の影響を避けるため食事の1時間前から食後3時間までの間の服用は避けること。[16.2.1参照]
7.4 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 間質性肺疾患のある患者又はその既往歴のある患者
9.1.2 心不全症状のある患者又はその既往歴のある患者
9.1.3 左室駆出率が低下している患者
9.2 腎機能障害患者
9.2.1 重度の腎機能障害のある患者
本剤の血中濃度が上昇するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び最終投与後2週間において避妊する必要性及び適切な避妊法について説明すること。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験で黄体数、着床数及び生存胎児数の減少並びに着床後胚損失の増加(ラット)、胎児体重の減少、矮小児、四肢の弯曲、大動脈弓及び右又は左頚動脈における過剰血管並びに矮小精巣等の変異(ウサギ)が認められている。[9.4参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験で乳汁中へ移行することが認められている(ラット)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
相互作用序文
薬物代謝酵素用語
P-糖蛋白(P-gp)
薬物代謝酵素用語
乳癌耐性蛋白(BCRP)
薬物代謝酵素用語
CYP
10.2 併用注意
| P-gp阻害剤 リトナビル、イトラコナゾール、ベラパミル等 [16.7.1参照] | 本剤の血中濃度が上昇し、副作用の発現頻度及び重症度が高まるおそれがあることから、P-gp阻害剤と併用する場合は、本剤投与と同時又は本剤投与後に投与すること。 | 本剤はP-gpの基質であり、本剤服用前にP-gp阻害剤を投与すると、併用により本剤の血中濃度が上昇することがある。 |
| P-gp誘導剤 リファンピシン、カルバマゼピン、セイヨウオトギリソウ(St.John's Wort)等 [16.7.2参照] | 本剤の血中濃度が低下し、本剤の有効性が減弱するおそれがある。 | 本剤はP-gpの基質であり、併用により本剤の血中濃度が低下することがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 間質性肺疾患(1.3%)
11.1.2 重度の下痢(14.4%)
重度の下痢に伴って脱水症状をきたし、急性腎不全に至った症例も報告されている。止瀉薬(ロペラミド等)の投与、補液等の適切な処置を行うこと。[7.1参照]
11.1.3 重度の皮膚障害(16.6%)
重度の発疹、ざ瘡等があらわれることがある。必要に応じて皮膚科を受診するよう患者に指導すること。[7.1参照]
11.1.4 肝不全(頻度不明)、肝機能障害(2.2%)
11.1.5 心障害(0.4%)
11.1.6 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、多形紅斑(頻度不明)
中毒性表皮壊死融解症、皮膚粘膜眼症候群、多形紅斑等の重篤な水疱性・剥脱性の皮膚障害があらわれることがある。[7.1参照]
11.1.7 消化管潰瘍(0.4%)、消化管出血(頻度不明)
異常が認められた場合には、内視鏡、腹部X線、CT等の必要な検査を行うこと。[7.1参照]
11.1.8 急性膵炎(頻度不明)
腹痛、血清アミラーゼ値の上昇等の異常が認められた場合には投与を中止すること。[7.1参照]
11.1.9 アナフィラキシー(頻度不明)[2.1参照]
11.2 その他の副作用
| 10%以上 | 1%以上10%未満 | 1%未満 | 頻度不明 | |
| 皮膚及び皮下組織障害注1) | 全身性発疹・斑状丘疹性及び紅斑性皮疹(55.5%)、爪囲炎(56.8%)、皮膚乾燥(29.3%)、ざ瘡(20.5%)、そう痒症(19.2%)、ざ瘡様皮膚炎(13.1%)、脱毛症(10.0%) | 爪の障害、手掌・足底発赤知覚不全症候群、皮膚剥脱、皮膚亀裂、皮膚色素過剰、皮膚潰瘍、多毛症、紅斑 | 過角化、ひび・あかぎれ、膿痂疹、嵌入爪、色素沈着障害 | 脂漏性皮膚炎、後天性魚鱗癬 |
| 筋骨格系及び結合組織障害 | 筋痙縮、背部痛、筋肉痛 | 筋力低下、シェーグレン症候群、開口障害 | 肋骨痛、肩痛 | |
| 神経系障害 | 味覚異常、頭痛、感覚鈍麻 | 末梢性感覚ニューロパチー、振戦 | ||
| 眼障害注2) | 結膜炎、眼乾燥、角膜炎、眼瞼炎、霧視、眼脂、白内障 | 眼瞼障害、睫毛乱生、硝子体剥離、結膜出血、角膜びらん、後天性涙腺炎、虹彩毛様体炎、網膜変性 | 眼痛 | |
| 耳及び迷路障害 | 耳鳴 | |||
| 精神障害 | 不眠症 | 激越 | 不安 | |
| 胃腸障害 | 下痢(80.8%)、口内炎(38.4%)、悪心(17.9%)、嘔吐(17.0%)、口唇炎(12.2%) | 口内乾燥、消化不良、腹痛、便秘、胃炎、腹部膨満、上腹部痛、肛門周囲痛、腹部不快感 | 歯肉炎、口唇乾燥、肛門の炎症、痔核、心窩部不快感、舌炎、口唇症 | 口唇腫脹、食道炎、腸炎、小腸炎、大腸炎、肛門周囲炎 |
| 生殖系及び乳房障害 | 萎縮性外陰腟炎 | |||
| 代謝及び栄養障害 | 食欲減退(20.5%) | 低カリウム血症、脱水 | 低ナトリウム血症、高尿酸血症 | |
| 心臓障害 | 上室性期外収縮 | |||
| 血管障害 | 高血圧 | ほてり | 低血圧、血栓症 | |
| 呼吸器、胸郭及び縦隔障害 | 鼻出血(13.1%) | 鼻の炎症、鼻漏、鼻乾燥、口腔咽頭痛 | 発声障害、鼻閉、湿性咳嗽、しゃっくり | 口腔咽頭不快感 |
| 腎及び尿路障害 | 蛋白尿 | 血尿、尿中血陽性 | 腎機能障害、排尿困難 | |
| 感染症及び寄生虫症 | 感染症(皮膚、尿路、鼻、咽頭、気管支、耳、爪)、毛包炎、膀胱炎、蜂巣炎、真菌感染症(皮膚、足部)、帯状疱疹 | ウイルス感染、鼓膜炎、敗血症 | ||
| 血液及びリンパ系障害 | 貧血、白血球減少症、好中球減少症 | リンパ球減少症、鉄欠乏性貧血 | 好酸球増加症 | |
| 一般・全身障害及び投与部位の状態 | 粘膜の炎症(28.8%)、疲労(13.5%) | 発熱、末梢性浮腫、浮腫 | 炎症、顔面浮腫、胸部不快感、倦怠感、粘膜乾燥、粘膜障害 | 悪寒 |
| 臨床検査 | 肝機能検査値異常(AST、ALT上昇等)(14.0%)、体重減少(10.5%) | 血中アルカリホスファターゼ増加 | 血中クレアチニン増加、アミラーゼ増加、CK上昇、血中ビリルビン増加、トロポニンT増加、総蛋白減少、血中アルブミン減少、心電図T波逆転 | 尿中白血球陽性、血中尿素増加、血中乳酸脱水素酵素増加、CK-MB上昇 |
| 傷害、中毒及び処置合併 | 挫傷 | 創し開 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 服用直前にPTPシートから取り出すよう指導すること。[20.参照]
15. その他の注意
15.2 非臨床試験に基づく情報
細菌を用いた復帰突然変異試験において、陽性が認められているが、ヒトリンパ球を用いた染色体異常試験、Mutaマウスを用いた遺伝子突然変異試験並びにラットを用いた小核試験及びコメットアッセイでは陰性であった。
16. 薬物動態
16.1 血中濃度
日本人非小細胞肺癌患者12例に本剤20、40、50mgを空腹時(服薬前2時間及び服薬後1時間は絶食)単回経口投与若しくは1日1回28日間反復経口投与したときの血漿中未変化体の薬物動態パラメータ及び血漿中未変化体濃度推移を以下に示す。AUC0-∞及びCmaxは、本剤20〜50mgの範囲で用量比をわずかに上回って増加する。投与開始後8日目には定常状態に到達していると考えられ1)、本剤の累積係数はAUC0-∞では2.8、Cmaxでは2.1であった。
| 単回投与 | 反復投与 | ||||||
| 幾何平均値(% gCV)a) | 20mg N=3 | 40mg N=3 | 50mg N=6 | 幾何平均値(% gCV)a) | 20mg N=3 | 40mg N=3 | 50mg N=5 |
| AUC0-24[ng・h/mL] | 147(84.5) | 299c)(6.01) | 539(59.0) | AUCτ,ssd)[ng・h/mL] | 409(16.5) | 1240(9.73) | 1010(71.5) |
| Cmax[ng/mL] | 12.4(101) | 18.9(45.8) | 44.4(60.6) | Cmax,ss[ng/mL] | 26.9(24.9) | 83.3(30.1) | 66.8(71.6) |
| tmaxb)[h] | 3.87(3.00-4.98) | 4.05(2.00-8.95) | 3.00(2.02-4.95) | tmax,ssb)[h] | 3.97(2.92-4.95) | 2.97(1.98-4.02) | 3.00(0.983-5.03) |
| t1/2[h] | 21.3(63.1) | 37.9c)(24.9) | 14.8(20.0) | t1/2,ss[h] | 38.5(14.4) | 40.4(11.9) | 33.5(22.2) |
図 本剤経口投与後の血漿中アファチニブ濃度推移(算術平均±SD)
16.2 吸収
16.2.1 食事の影響
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害者
中等度並びに重度腎機能障害被験者(各8例)に本剤40mgを単回投与した場合、腎機能正常被験者(各比較対象群に対してそれぞれ8例)に比べて中等度腎機能障害(eGFR:30〜59mL/min/1.73m2)を有する群ではAUC0-lastは22.2%(90% CI:95.7、156.0)、Cmaxは1.2%(90% CI:72.9、140.3)の上昇が認められ、重度腎機能障害(eGFR:15〜29mL/min/1.73m2)を有する群では、AUC0-lastは50.0%(90% CI:105.3、213.7)、Cmaxは21.7%(90% CI:90.8、163.2)の上昇が認められた(外国人データ)。[9.2.1参照]
また、本剤単独投与を受けた癌患者927例(血漿中アファチニブ濃度4460時点)を対象に母集団薬物動態解析を実施し、内因性要因及び外因性要因が本剤の薬物動態に及ぼす影響を評価した10)11)。癌患者927例のうち、軽度の腎機能障害患者(クレアチニンクリアランス50mL/min以上80mL/min以下)は528例(2051時点)、中等度の腎機能障害患者(30mL/min以上50mL/min未満)は161例(554時点)、重度の腎障害患者(30mL/min未満)は10例(21時点)であった。クレアチニンクリアランスが79mL/min(中央値)の患者と比較して、60mL/min及び30mL/minの患者ではAUCτ,ssはそれぞれ13%及び42%の上昇、90mL/min及び120mL/minの患者ではそれぞれ6%及び20%の低下が示された。
また、本剤単独投与を受けた癌患者927例(血漿中アファチニブ濃度4460時点)を対象に母集団薬物動態解析を実施し、内因性要因及び外因性要因が本剤の薬物動態に及ぼす影響を評価した10)11)。癌患者927例のうち、軽度の腎機能障害患者(クレアチニンクリアランス50mL/min以上80mL/min以下)は528例(2051時点)、中等度の腎機能障害患者(30mL/min以上50mL/min未満)は161例(554時点)、重度の腎障害患者(30mL/min未満)は10例(21時点)であった。クレアチニンクリアランスが79mL/min(中央値)の患者と比較して、60mL/min及び30mL/minの患者ではAUCτ,ssはそれぞれ13%及び42%の上昇、90mL/min及び120mL/minの患者ではそれぞれ6%及び20%の低下が示された。
16.6.2 肝機能障害者
16.7 薬物相互作用
16.7.1 リトナビル
16.7.2 リファンピシン
注)承認された用法・用量は、「通常、成人にはアファチニブとして1日1回40mgを空腹時に経口投与する。なお、患者の状態により適宜増減するが、1日1回50mgまで増量できる。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第III相臨床試験成績(LUX-Lung 3)
化学療法未治療のEGFR遺伝子変異(Exon19の欠失変異(Del19)、Exon21のL858R変異等)陽性の非小細胞肺癌(腺癌)患者を対象に、本剤40mgを1日1回空腹時(食事の1時間以上前又は食後3時間以降)投与した際の有効性及び安全性について、ペメトレキセド+シスプラチン(PEM+CDDP)の併用療法を対照として評価した。有効性評価対象例は345例(本剤群230例、PEM+CDDP群115例)であり、このうち83例(本剤群54例、PEM+CDDP群29例)が日本人であった16)。
主要評価項目である独立判定委員会判定による無増悪生存期間(PFS)の中央値は、本剤群で11.1カ月、PEM+CDDP群で6.9カ月であり、本剤群のPFSはPEM+CDDP群と比較して有意に延長した(ハザード比0.58、95%信頼区間:0.43-0.78、p値=0.0004、両側層別ログランク検定)。また、EGFR遺伝子変異の種類(Del19、L858R、その他)別による部分集団解析の結果は、下表のとおりであった。
主要評価項目である独立判定委員会判定による無増悪生存期間(PFS)の中央値は、本剤群で11.1カ月、PEM+CDDP群で6.9カ月であり、本剤群のPFSはPEM+CDDP群と比較して有意に延長した(ハザード比0.58、95%信頼区間:0.43-0.78、p値=0.0004、両側層別ログランク検定)。また、EGFR遺伝子変異の種類(Del19、L858R、その他)別による部分集団解析の結果は、下表のとおりであった。
図 無増悪生存期間のKaplan-Meier曲線
| EGFR遺伝子変異 | 本剤群 | PEM+CDDP群 | ハザード比 | 95%信頼区間 |
| Del19 | 13.7カ月(n=113) | 5.6カ月(n=57) | 0.28 | 0.18-0.44 |
| L858R | 10.8カ月(n=91) | 8.1カ月(n=47) | 0.73 | 0.46-1.17 |
| その他 | 2.8カ月(n=26) | 9.9カ月(n=11) | 1.89 | 0.84-4.28 |
副次評価項目である全生存期間(OS)(2013年11月14日データカットオフ)の中央値は、本剤群で28.2カ月、PEM+CDDP群で28.2カ月であった(ハザード比0.88、95%信頼区間:0.66-1.17)。
安全性評価対象229例(日本人54例を含む)中228例(99.6%)に副作用が認められ、主な副作用は、下痢218例(95.2%)、発疹141例(61.6%)、爪囲炎130例(56.8%)等であった。
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. アファチニブマレイン酸塩
20. 取扱い上の注意
本剤は湿気と光に不安定なため、未使用の場合はアルミピロー包装のまま保存し、開封後は湿気と光を避けて保存すること。[14.1.2参照]
22. 包装
<ジオトリフ錠20mg>
14錠[7錠(PTP)×2(乾燥剤入り)]
<ジオトリフ錠30mg>
14錠[7錠(PTP)×2(乾燥剤入り)]
<ジオトリフ錠40mg>
14錠[7錠(PTP)×2(乾燥剤入り)]
23. 主要文献
- 社内資料:国内第I/II相試験(LUX-Lung 4)薬物動態の検討(第I相)(2014年1月17日承認、CTD2.7.2.2)
- 社内資料:海外第I相試験 食事の影響(2014年1月17日承認、CTD2.7.1.3)
- 社内資料:非臨床薬物動態試験(血漿蛋白結合及び血球移行)(2014年1月17日承認、CTD2.6.4.4)
- 社内資料:非臨床薬物動態試験(血漿蛋白結合)(2014年1月17日承認、CTD2.6.4.4)
- 社内資料:in vitroにおける代謝の検討(2014年1月17日承認、CTD2.6.4.5)
- 社内資料:臨床薬物動態試験(2014年1月17日承認、CTD2.7.2.2)
- 社内資料:非臨床薬物動態試験(トランスポーター)(2014年1月17日承認、CTD2.6.4.5)
- 社内資料:非臨床薬物動態試験(トランスポーター)(2014年1月17日承認、CTD2.6.4.5)
- 社内資料:非臨床薬物動態試験(トランスポーター)(2014年1月17日承認、CTD2.6.4.5)
- 社内資料:母集団薬物動態解析(2014年1月17日承認、CTD2.7.2.2)
- 社内資料:母集団薬物動態解析(2014年1月17日承認、CTD2.7.2.2)
- 社内資料:肝機能障害者における薬物動態の検討(2014年1月17日承認、CTD2.7.2.2)
- 社内資料:リトナビルとの相互作用(2014年1月17日承認、CTD2.7.2.3)
- 社内資料:リトナビルとの相互作用(2014年1月17日承認、CTD2.7.2.3)
- 社内資料:リファンピシンとの相互作用(2014年1月17日承認、CTD2.7.2.3)
- 社内資料:国際共同第III相試験(LUX-Lung 3)(2014年1月17日承認、CTD2.7.3.2、2.7.3.3)
- 社内資料:薬効薬理の検討(受容体結合実験)(2014年1月17日承認、CTD2.6.2.2)
- 社内資料:薬効薬理の検討(EGFR、HER2キナーゼ等に対する作用)(2014年1月17日承認、CTD2.6.2.2)
- 社内資料:薬効薬理の検討(種々の蛋白質キナーゼに関する選択性)(2014年1月17日承認、CTD2.6.2.2)
- 社内資料:薬効薬理の検討(HER4キナーゼアッセイ)(2014年1月17日承認、CTD2.6.2.2)
- 社内資料:薬効薬理の検討(EGFR変異株に対する阻害作用)(2014年1月17日承認、CTD2.6.2.2)
- Li D.et al., Oncogene., 27 (34), 4702-4711, (2008)
24. 文献請求先及び問い合わせ先
文献請求先
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017
東京都品川区大崎2丁目1番1号 ThinkPark Tower
電話:0120-189-779 (受付時間)9:00〜18:00(土・日・祝日・弊社休業日を除く)
製品情報問い合わせ先
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017
東京都品川区大崎2丁目1番1号 ThinkPark Tower
電話:0120-189-779 (受付時間)9:00〜18:00(土・日・祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
日本ベーリンガーインゲルハイム株式会社
東京都品川区大崎2丁目1番1号