医薬品情報
| 総称名 | レルベア |
|---|---|
| 一般名 | ビランテロールトリフェニル酢酸塩 フルチカゾンフランカルボン酸エステル |
| 欧文一般名 | Vilanterol Trifenatate Fluticasone Furoate |
| 製剤名 | ビランテロールトリフェニル酢酸塩・フルチカゾンフランカルボン酸エステルドライパウダーインヘラー |
| 薬効分類名 | 喘息・COPD治療配合剤 喘息治療配合剤 |
| 薬効分類番号 | 2290 |
| ATCコード | R03AK10 |
| KEGG DRUG |
D10501
フルチカゾンフランカルボン酸エステル・ビランテロールトリフェニル酢酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(用法及び用量変更)(第3版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| レルベア100エリプタ14吸入用 | RELVAR ELLIPTA | グラクソ・スミスクライン | 2290803G1028 | 2422.9円/キット | 処方箋医薬品注) |
| レルベア100エリプタ30吸入用 | RELVAR ELLIPTA | グラクソ・スミスクライン | 2290803G3020 | 4829.9円/キット | 処方箋医薬品注) |
| レルベア200エリプタ14吸入用 | RELVAR ELLIPTA | グラクソ・スミスクライン | 2290803G2024 | 2495.5円/キット | 処方箋医薬品注) |
| レルベア200エリプタ30吸入用 | RELVAR ELLIPTA | グラクソ・スミスクライン | 2290803G4027 | 5220.8円/キット | 処方箋医薬品注) |
| 小児用レルベア50エリプタ14吸入用 | RELVAR ELLIPTA for Pediatric | グラクソ・スミスクライン | 2290803G5023 | 2367.4円/キット | 処方箋医薬品注) |
| 小児用レルベア50エリプタ30吸入用 | RELVAR ELLIPTA for Pediatric | グラクソ・スミスクライン | 2290803G6020 | 4846.8円/キット | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 有効な抗菌剤の存在しない感染症、深在性真菌症の患者[ステロイドの作用により症状を増悪するおそれがある。]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
レルベア100エリプタ14吸入用
レルベア100エリプタ
レルベア100エリプタ30吸入用
レルベア100エリプタ
レルベア200エリプタ14吸入用
レルベア200エリプタ
気管支喘息(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
レルベア200エリプタ30吸入用
レルベア200エリプタ
気管支喘息(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
小児用レルベア50エリプタ14吸入用
小児用レルベア50エリプタ
気管支喘息(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
小児用レルベア50エリプタ30吸入用
小児用レルベア50エリプタ
気管支喘息(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
5. 効能または効果に関連する注意
レルベア100エリプタ14吸入用
<気管支喘息>
<慢性閉塞性肺疾患(慢性気管支炎・肺気腫)の諸症状の緩解>
レルベア100エリプタ30吸入用
<気管支喘息>
<慢性閉塞性肺疾患(慢性気管支炎・肺気腫)の諸症状の緩解>
レルベア200エリプタ14吸入用
<気管支喘息>
レルベア200エリプタ30吸入用
<気管支喘息>
小児用レルベア50エリプタ14吸入用
<気管支喘息>
小児用レルベア50エリプタ30吸入用
6. 用法及び用量
レルベア100エリプタ14吸入用
<気管支喘息>
成人
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
小児
通常、12歳以上の小児にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
通常、5歳以上12歳未満の小児には小児用レルベア50エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして50μg)を1日1回吸入投与する。
<慢性閉塞性肺疾患(慢性気管支炎・肺気腫)の諸症状の緩解>
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
レルベア100エリプタ30吸入用
<気管支喘息>
成人
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
小児
通常、12歳以上の小児にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
通常、5歳以上12歳未満の小児には小児用レルベア50エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして50μg)を1日1回吸入投与する。
<慢性閉塞性肺疾患(慢性気管支炎・肺気腫)の諸症状の緩解>
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
レルベア200エリプタ14吸入用
<気管支喘息>
成人
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
小児
通常、12歳以上の小児にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
通常、5歳以上12歳未満の小児には小児用レルベア50エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして50μg)を1日1回吸入投与する。
レルベア200エリプタ30吸入用
<気管支喘息>
成人
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
小児
通常、12歳以上の小児にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
通常、5歳以上12歳未満の小児には小児用レルベア50エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして50μg)を1日1回吸入投与する。
小児用レルベア50エリプタ14吸入用
<気管支喘息>
成人
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
小児
通常、12歳以上の小児にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
通常、5歳以上12歳未満の小児には小児用レルベア50エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして50μg)を1日1回吸入投与する。
小児用レルベア50エリプタ30吸入用
<気管支喘息>
成人
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
小児
通常、12歳以上の小児にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
通常、5歳以上12歳未満の小児には小児用レルベア50エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして50μg)を1日1回吸入投与する。
8. 重要な基本的注意
<効能共通>
8.1 本剤は既に起きている気管支喘息の発作又は慢性閉塞性肺疾患の増悪を速やかに軽減する薬剤ではないので、毎日規則正しく使用するよう患者、保護者又はそれに代わり得る適切な者を指導すること。[5.1、5.2、8.7参照]
8.2 本剤の投与期間中に発現する気管支喘息の急性の発作又は慢性閉塞性肺疾患の急性増悪に対しては、短時間作動型吸入β2刺激剤(例えば吸入用サルブタモール硫酸塩)等の他の適切な薬剤を使用するよう患者、保護者又はそれに代わり得る適切な者に注意を与えること。
また、その薬剤の使用量が増加したり、あるいは効果が十分でなくなってきた場合には、疾患の管理が十分でないことが考えられるので、可及的速やかに医療機関を受診し医師の治療を求めるよう患者、保護者又はそれに代わり得る適切な者に注意を与えること。[5.1、5.2、8.11参照]
また、その薬剤の使用量が増加したり、あるいは効果が十分でなくなってきた場合には、疾患の管理が十分でないことが考えられるので、可及的速やかに医療機関を受診し医師の治療を求めるよう患者、保護者又はそれに代わり得る適切な者に注意を与えること。[5.1、5.2、8.11参照]
8.3 本剤の投与終了後に症状の悪化があらわれることがあるので、患者、保護者又はそれに代わり得る適切な者の判断で本剤の使用を中止することがないよう指導すること。また、投与を中止する場合には観察を十分に行うこと。
8.4 本剤の吸入後に喘鳴の増加を伴う気管支痙攣があらわれることがある。気管支痙攣が認められた場合には、直ちに本剤の投与を中止し、短時間作動型気管支拡張剤による治療を行うこと。また、患者を評価し、必要に応じて他の治療法を考慮すること。
8.5 全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤の投与により全身性の作用(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障、中心性漿液性網脈絡膜症を含む)が発現する可能性がある。特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には患者の症状を観察しながら適切な処置を行うこと。[8.10参照]
8.6 慢性閉塞性肺疾患患者を対象とした国際共同臨床試験及び海外臨床試験において、肺炎の発現が本剤の用量依存的に増加することが報告されている。一般に肺炎の発現リスクが高いと考えられる患者へ本剤を投与する場合には注意すること。[11.1.2参照]
<気管支喘息>
8.8 本剤の投与期間中に喘息に関連した事象及び喘息の悪化があらわれることがある。本剤の投与開始後に喘息症状がコントロール不良であったり、悪化した場合には、患者、保護者又はそれに代わり得る適切な者の判断で本剤の吸入を中止せずに、医師に相談するよう指導すること。
8.9 本剤は患者の喘息症状に応じて最適な用量を選択する必要があるため、本剤の投与期間中は患者を定期的に診察すること。
8.10 吸入ステロイド剤の投与により全身性の作用が発現する可能性があるため、吸入ステロイド剤の投与量は患者毎に喘息をコントロールできる最少用量に調節すること。[8.5参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 結核性疾患又は感染症(有効な抗菌剤の存在しない感染症、深在性真菌症を除く)の患者
ステロイドの作用により症状を増悪するおそれがある。
9.1.2 心疾患を有する患者
上室性頻脈、期外収縮等の不整脈、QT延長があらわれるおそれがある。
9.1.3 糖尿病の患者
血糖が上昇するおそれがある。
9.3 肝機能障害患者
9.3.1 肝障害のある患者
本剤の血中濃度が増加し、全身性の作用が発現する可能性が高くなるおそれがある。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ビランテロールの高用量の吸入又は皮下投与により、ウサギの胎児に眼瞼開存、口蓋裂などの所見及び発育抑制が報告されている。また、フルチカゾンフランカルボン酸エステルの高用量の吸入投与により、母動物毒性に関連した胎児の低体重、胸骨の不完全骨化の発現率増加(ラット)、及び流産(ウサギ)が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。他のβ2刺激剤及び副腎皮質ステロイド剤はヒト乳汁中に移行することが知られている。ラットの授乳期にビランテロール又はフルチカゾンフランカルボン酸エステルを単独で投与したとき、生後10日の出生児血漿中に薬物が検出された(それぞれ1/54又は6/54例)。
9.7 小児等
9.7.1 長期間投与する場合には、身長等の経過の観察を十分行うこと。また使用にあたっては、使用法を正しく指導すること。全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤を特に長期間、大量に投与する場合に成長遅延をきたすおそれがある。なお、小児等に対しては国内での24週間を超える臨床試験は実施していない。
9.7.2 5歳未満の幼児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
フルチカゾンフランカルボン酸エステル及びビランテロールは、主としてCYP3A4で代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| CYP3A4阻害作用を有する薬剤 リトナビル ケトコナゾール(経口剤:国内未発売) エリスロマイシン等 [16.7.1参照] | 副腎皮質ステロイド剤を全身投与した場合と同様の症状があらわれる可能性がある。なお、本剤とケトコナゾール(経口剤)を併用した臨床薬理試験において、血中のビランテロール及びフルチカゾンフランカルボン酸エステルの曝露量の増加が認められたとの報告がある。 | CYP3A4による代謝が阻害されることにより、本剤の血中濃度が上昇する可能性がある。 |
| β遮断薬 | 本剤の作用が減弱するおそれがある。 | β受容体において本剤と競合する。 |
| QT間隔延長を起こすことが知られている薬剤 抗不整脈剤 三環系抗うつ剤等 [17.3.1参照] | QT間隔が延長され心室性不整脈等のリスクが増大するおそれがある。 | いずれもQT間隔を延長させる可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー反応(頻度不明)
アナフィラキシー反応(咽頭浮腫、気管支痙攣等)があらわれることがある。
11.1.2 肺炎(0.5%)[8.6参照]
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹、血管性浮腫 | 蕁麻疹 | |
| 感染症 | 口腔咽頭カンジダ症 | インフルエンザ、気管支炎、上気道感染 | 食道カンジダ症 |
| 精神神経系 | 頭痛、振戦、不安 | ||
| 循環器 | 期外収縮、動悸、頻脈 | ||
| 呼吸器 | 発声障害 | 口腔咽頭痛、鼻咽頭炎、咽頭炎、副鼻腔炎、咳嗽、鼻炎 | 気管支痙攣 |
| 消化器 | 腹痛 | ||
| 筋骨格系 | 関節痛、背部痛、筋痙縮、骨折 | ||
| その他 | 高血糖 | 発熱 |
13. 過量投与
13.1 症状
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
(1)患者、保護者又はそれに代わり得る適切な者に使用説明書を渡し、使用方法を指導すること。
(2)本剤は防湿のためアルミ包装されているので、使用開始直前にアルミ包装を開封するよう指導すること。
14.1.2 吸入時
本剤は口腔内への吸入投与にのみ使用すること(内服しても効果はみられない)。
14.1.3 吸入後
本剤吸入後に、うがいを実施するよう患者、保護者又はそれに代わり得る適切な者を指導すること(口腔咽頭カンジダ症又は嗄声の予防のため)。ただし、うがいが困難な患者には、うがいではなく、口腔内をすすぐよう指導すること。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
(1)ビランテロール単剤投与時の血中濃度
健康成人男性12例にビランテロール(以下、VI)25μgを1日1回7日間吸入投与(1日目及び7日目は空腹時投与)した時の血漿中VIの濃度推移及び薬物動態パラメータは以下のとおりである。血漿中VIのtmaxは5〜10分(中央値)であった。その後、血漿中VI濃度は速やかに消失し、投与後6時間には全被験者で定量下限(30pg/mL)未満となった1)。
健康成人男性にVI単剤の25μgを1日1回7日間吸入投与した時の血漿中VI濃度推移(平均値+標準偏差、12例)
| 投与日 | Cmax(pg/mL) | tmax(h)注1) | AUC0-1(pg・h/mL)注2) |
| 投与初日(1日目) | 253.7(218.6,294.5) | 0.08(0.08-0.17) | 104.3(86.1,126.3)注3) |
| 最終投与日(7日目) | 310.4(276.2,348.9) | 0.13(0.08-0.17) | 123.5(108.7,140.2) |
(2)フルチカゾンフランカルボン酸エステル単剤投与時の血中濃度
健康成人男性12例にフルチカゾンフランカルボン酸エステル(以下、FF)200μg、400μg又は800μgを単回及び1日1回7日間反復吸入投与した時1)、血漿中FF濃度は投与後2時間(中央値)までにCmaxに達し、t1/2は約24〜33時間(幾何平均値)であった。血漿中FFの曝露量(AUC及びCmax)は200〜800μgの投与量増加の割合にほぼ比例して増加した。また、血漿中FF濃度は反復投与5日目(9日目)までに定常状態に達した。FF 200μgを単回及び反復吸入投与(1日目:初回投与、5〜11日目:1日1回7日間投与)した時の血漿中FFの濃度推移及び薬物動態パラメータは以下のとおりである。
健康成人男性にFF単剤の200μgを単回及び1日1回7日間吸入投与した時の血漿中FF濃度推移(平均値+標準偏差)(1及び11日目、12例)
| 投与日 | Cmax(pg/mL) | tmax(h)注1) | AUC(pg・h/mL)注2) |
| 投与初日(1日目) | 36.50(30.72,43.36) | 0.50(0.25-1.00) | 224.6(161.6,312.3) |
| 最終投与日(11日目) | 62.31(54.28,71.52) | 2.00(0.08-3.00) | 743.8(659.5,838.9) |
(3)VI・FF投与時の血中濃度
健康成人男性16例にVI・FF 50・800μg注)を単回吸入投与した時の血漿中VI及びFFの薬物動態パラメータは以下のとおりである。血漿中VI及びFF濃度は、それぞれ投与後5分及び2時間(中央値)までにCmaxに達し、血漿中FFのみかけのt1/2は約27時間であった。
また、健康成人16例にVI・FF 100・800μg注)を単回吸入投与した時の血漿中VIのみかけのt1/2は約2.5時間であった(外国人データ)。
また、健康成人16例にVI・FF 100・800μg注)を単回吸入投与した時の血漿中VIのみかけのt1/2は約2.5時間であった(外国人データ)。
| 測定薬物 | Cmax(pg/mL) | tmax(h)注1) | AUC0-t(pg・h/mL) |
| VI | 424(351,512) | 0.08(0.08-0.08) | 223(177,280) |
| FF | 71.4(58.0,88.0) | 2.00(0.08-4.00) | 1015(627,1643) |
16.1.2 気管支喘息患者
(1)成人
成人気管支喘息患者にVI・FF又はFF単剤を反復吸入投与した時の曝露量の推定値(母集団薬物動態解析)は以下のとおりである。
| 投与量(μg) | VI | FF | ||||
| 例数 | Cmax(pg/mL) | AUC0-24(pg・h/mL) | 例数 | Cmax(pg/mL) | AUC0-24(pg・h/mL) | |
| 日本人 | ||||||
| VI・FF 25・100 | 14 | 113.3(38.7,243.7) | 139.1(117.2,159.0) | 14 | 18.0(11.8,26.1) | 348.6(214.7,510.8) |
| VI・FF 25・200 | 13 | 144.9(63.4,236.1) | 146.1(119.4,168.0) | 13 | 42.4(28.2,59.7) | 605.1(489.2,871.8) |
| 白人 | ||||||
| VI・FF 25・100 | 660 | 42.2(39.7,44.9) | 165.7(160.2,171.4) | 492 | 15.2(14.9,15.6)注1) | 232.2(226.0,238.5)注1) |
| VI・FF 25・200 | 471 | 30.0(29.1,30.8)注1) | 471.6(459.0,484.2)注1) | |||
(2)5歳以上12歳未満の小児
5歳以上12歳未満の小児気管支喘息患者にVI・FF、VI単剤又はFF単剤を反復吸入投与した時の曝露量の推定値(母集団薬物動態解析)は以下のとおりである。
| VI 25μg | FF 50μg | |||||
| 例数 | Cmax(pg/mL) | AUC0-24(pg・h/mL) | 例数 | Cmax(pg/mL) | AUC0-24(pg・h/mL) | |
| 日本人 | 5 | 72.8(47.1,112.5)注1) | 81.9(79.8,84.1)注1) | 4 | 15.8(13.2,18.9)注1) | 134.6(110.3,164.4)注1) |
| 白人 | 95 | 100(84,119.1)注2) | 82(80.2,83.8)注2) | 39 | 11.5(10.2,13)注1) | 95(81.7,110.5)注1) |
16.1.3 慢性閉塞性肺疾患患者
慢性閉塞性肺疾患患者にVI・FFを反復吸入投与した時の曝露量の推定値(母集団薬物動態解析)は以下のとおりである。
| 投与量(μg) | VI | FF | ||||
| 例数 | Cmax(pg/mL) | AUC0-24(pg・h/mL) | 例数 | Cmax(pg/mL) | AUC0-24(pg・h/mL) | |
| 日本人 | ||||||
| VI・FF 25・100 | 11 | 60.7(28.9,97.0) | 262.3(174.1,384.0) | 11 | 17.1(8.3,36.6) | 255.2(151.4,422.5) |
| 白人 | ||||||
| VI・FF 25・100 | 280 | 41.7(17.4,85.5) | 257.0(147.8,500.3) | 298 | 11.6(4.3,30.9) | 179.3(82.3,363.7) |
16.3 分布
16.3.1 分布容積
健康成人16例にVI 55μg及びFF 250μgを静脈内投与した時の定常状態における分布容積の幾何平均値はそれぞれ165及び661Lであった(外国人データ)。
16.3.2 血漿蛋白結合率
In vitroでのVI及びFFのヒト血漿蛋白結合率は、それぞれ93.9及び99%超であった。
16.3.3 血球移行
In vitroでのVI(50〜500ng/mL)及びFF(0.2〜5ng/mL)のヒト血液/血漿比は、それぞれ0.73〜0.81及び0.55〜0.67であった。
16.4 代謝
In vitro試験において、ヒトでVI及びFFは主にCYP3A4で代謝された。VIは主にO-脱アルキル化された代謝物が生成し、FFはS-フルオロメチルカルボチオエート基が加水分解された代謝物が生成する。[10.参照]
16.5 排泄
健康成人5例に14C-FF 2mgを単回経口投与した時に放射能は主に代謝物として糞中に排泄され、放射能の尿中排泄率は1%未満であった(外国人データ)。健康成人6例に14C-VI 200μgを単回経口投与した時に放射能は主に代謝物として尿糞中に排泄され、放射能の尿糞中排泄率はそれぞれ約70及び30%であった(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能低下者
重度の腎機能低下者(CLcr:30mL/分未満)及び健康成人各9例にVI・FF 25・200μgを1日1回7日間吸入投与した時、健康成人に比べて投与7日目の血漿中のVIのCmax及びAUC0-24はそれぞれ8及び56%増加し、FFのCmax及びAUC0-24はそれぞれ4及び9%低下した(外国人データ)。
16.6.2 肝機能低下者
軽度及び中等度の肝機能低下者(Child-Pughスコア:A又はB)及び健康成人各9例にVI・FF 25・200μg、重度の肝機能低下者(Child-Pughスコア:C)8例にVI・FF 12.5・100μg注)を1日1回7日間吸入投与した時のFFのAUC0-24は健康成人に比べて最大約3倍に増加した。投与量で補正したFFの曝露量は中等度及び重度の肝機能低下者(Child-Pughスコア:B又はC)で同程度であった。軽度及び中等度の肝機能低下者(Child-Pughスコア:A又はB)にVI・FF 25・200μg、重度の肝機能低下者(Child-Pughスコア:C)にVI・FF 12.5・100μg注)を7日間投与した時のVIのCmax及びAUCは健康成人と同様であった(外国人データ)。[9.3.1参照]
16.7 薬物相互作用
16.7.1 ケトコナゾール
健康成人18例にVI・FF 25・200μgとCYP3A4阻害薬であるケトコナゾール400mgを反復併用投与した時の薬物相互作用を検討した。その結果、併用投与時のVIのAUC0-t'及びCmaxはそれぞれ65及び22%増加し、FFのAUC0-24及びCmaxはそれぞれ36及び33%増加した(外国人データ)。[10.2参照]
注)成人に対して本剤の承認された通常用量は、VI・FF 25・100μg1日1回吸入投与であり、気管支喘息における最大投与量はVI・FF 25・200μg1日1回吸入投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<気管支喘息(成人)>
17.1.1 国際共同第III相試験
低用量〜中用量ICS又は低用量ICS・LABAで治療中の成人気管支喘息患者609例(日本人患者50例を含む)を対象に実施した12週間の無作為化二重盲検並行群間比較試験において、VI・FF 25・100μgを1日1回吸入投与した時の結果は下表のとおりであった2)。
| VI・FF 25・100μg群 | FF 100μg群 | プラセボ群 | ||
| トラフFEV1(L) | ベースライン | 2.344±0.642(201) | 2.290±0.617(205) | 2.334±0.626(203) |
| 投与12週後 | 2.698±0.804(200) | 2.611±0.762(203) | 2.576±0.844(193) | |
| 変化量 | 0.354±0.484(200) | 0.321±0.452(203) | 0.222±0.468(193) | |
| プラセボ群との差 [95%信頼区間]注) p値注) | 0.172 [0.087,0.258] p<0.001 | 0.136 [0.051,0.222] p=0.002 | / | |
| FF 100μg群との差 [95%信頼区間]注) p値注) | 0.036 [−0.048,0.120] p=0.405 | / | ||
副作用発現頻度は、VI・FF 25・100μg群で7%(14/201例)であった。主な副作用は、口腔カンジダ症2%(4/201例)であった。
17.1.2 国際共同第III相試験
高用量ICS又は中用量ICS・LABAで治療中の成人気管支喘息患者586例(日本人患者36例を含む)を対象に実施した24週間の無作為化二重盲検並行群間比較試験において、VI・FF 25・200μgを1日1回吸入投与した時の結果は下表のとおりであった3)。
| VI・FF 25・200μg群 | FF 200μg群 | フルチカゾンプロピオン酸エステル(FP)500μg1日2回投与群 | ||
| トラフFEV1(L) | ベースライン | 2.129±0.654(191) | 2.190±0.676(193) | 2.138±0.673(194) |
| 投与24週後 | 2.538±0.856(193) | 2.426±0.855(187) | 2.310±0.769(191) | |
| 変化量 | 0.388±0.474(187) | 0.218±0.495(186) | 0.173±0.390(190) | |
| FP 500μg1日2回投与群との差 [95%信頼区間]注) p値注) | 0.210 [0.127,0.294] p<0.001 | 0.018 [−0.066,0.102] | / | |
| FF 200μg群との差 [95%信頼区間]注) p値注) | 0.193 [0.108,0.277] p<0.001 | / | ||
副作用発現頻度は、VI・FF 25・200μg群で9%(17/197例)であった。主な副作用は、発声障害3%(5/197例)であった。
17.1.3 国際共同第III相試験
低用量〜高用量ICS又は低用量〜中用量ICS・LABAで治療中の成人気管支喘息患者2019例(日本人患者62例を含む)を対象に実施した最大76週間の無作為化二重盲検並行群間比較試験において、VI・FF 25・100μgを1日1回吸入投与した時の重度の喘息増悪発現のリスクは、下表のとおりであった4)。
| VI・FF 25・100μg群 | FF 100μg群 | |
| 増悪割合(例数) | 15%(154/1009) | 18%(186/1010) |
| ハザード比 [95%信頼区間]注) p値注) | 0.795 [0.642,0.985] p=0.036 | / |
また、投与36週後におけるトラフFEV1値の測定結果は下表のとおりであった。
| VI・FF 25・100μg群 | FF 100μg群 | |
| ベースライン | 2.216±0.643(1009) | 2.193±0.640(1010) |
| 投与36週後 | 2.566±0.826(926) | 2.452±0.852(902) |
| 変化量 | 0.352±0.488(926) | 0.261±0.499(902) |
| FF 100μg群との差 [95%信頼区間]注) p値注) | 0.083 [0.044,0.123] p<0.001 | / |
副作用発現頻度は、VI・FF 25・100μg群で7%(69/1009例)であった。主な副作用は、発声障害1%(12/1009例)、頭痛1%未満(9/1009例)、口腔咽頭痛1%未満(6/1009例)、上気道感染1%未満(5/1009例)、筋痙縮1%未満(5/1009例)、口腔カンジダ症1%未満(4/1009例)、咳嗽1%未満(3/1009例)、カンジダ症1%未満(3/1009例)であった。
17.1.4 国内第III相試験
成人気管支喘息患者243例を対象に実施した52週間の非盲検長期投与試験において、VI・FF 25・100μg及びVI・FF 25・200μgを1日1回投与したところ、PEFは投与12週目に改善が認められ、治療期間を通じて維持された5)。
副作用発現頻度は、VI・FF 25・100μg群で23%(14/60例)、VI・FF 25・200μg群で28%(26/93例)であった。主な副作用は、VI・FF 25・100μg群で発声障害8%(5/60例)、口腔カンジダ症5%(3/60例)及び口腔咽頭不快感5%(3/60例)であった。VI・FF 25・200μg群では口腔カンジダ症14%(13/93例)、発声障害5%(5/93例)であった。
副作用発現頻度は、VI・FF 25・100μg群で23%(14/60例)、VI・FF 25・200μg群で28%(26/93例)であった。主な副作用は、VI・FF 25・100μg群で発声障害8%(5/60例)、口腔カンジダ症5%(3/60例)及び口腔咽頭不快感5%(3/60例)であった。VI・FF 25・200μg群では口腔カンジダ症14%(13/93例)、発声障害5%(5/93例)であった。
17.1.5 海外第III相試験
成人気管支喘息患者806例を対象に実施した24週間の二重盲検比較試験において、VI・FF 25・100μg1日1回投与とサルメテロール・フルチカゾンプロピオン酸エステル(以下、SALM・FP)50・250μg1日2回投与を比較した結果、肺機能及び症状に関する評価項目に投与群間の有意差はなかった[FEV1加重平均値(0〜24時間)の投与前からの変化量の調整済治療群間差:−0.037L(95%信頼区間−0.088,0.015L、p=0.162)]6)。
副作用発現頻度は、VI・FF 25・100μg群で5%(19/403例)であった。主な副作用は、咳嗽1%未満(3/403例)、発声障害1%未満(3/403例)であった。
副作用発現頻度は、VI・FF 25・100μg群で5%(19/403例)であった。主な副作用は、咳嗽1%未満(3/403例)、発声障害1%未満(3/403例)であった。
<気管支喘息(小児)>
17.1.6 国際共同第III相試験
ICS(FP 250μg以下又は同等量)で治療中の5歳以上18歳未満の気管支喘息患者894例(日本人患者31例を含む)を対象に実施した24週間の無作為化二重盲検並行群間比較試験において、12歳以上18歳未満の患者にVI・FF 25・100μg、また5歳以上12歳未満の患者にVI・FF 25・50μgを1日1回吸入投与した時の投与12週後のFEV1(L)加重平均値(0〜4時間)は下表のとおりであった。
| VI・FF群 | FF群 | |
| ベースラインのFEV1(L) | 1.661±0.606(446) | 1.643±0.580(441) |
| 投与12週後のFEV1(L)加重平均値(0〜4時間) | 2.080±0.760(395) | 1.989±0.693(395) |
| FF群との差 [95%信頼区間]注) p値注) | 0.086 [0.040,0.131] p<0.001 | / |
副作用発現頻度は、VI・FF群で1%(6/451例)であった。すべての副作用の発現頻度は1%未満(それぞれ1/451例)であり、心電図QT延長、血中ブドウ糖増加、発声障害、口腔カンジダ症、腹痛、高血糖、頭痛であった。
<慢性閉塞性肺疾患(慢性気管支炎・肺気腫)>
17.1.7 国際共同第III相試験
慢性閉塞性肺疾患患者1620例(日本人患者370例含む)を対象に実施した12週間の二重盲検比較試験において、VI・FF 25・100μgを1日1回12週間投与した時のトラフFEV1(L)は、下表のとおりであった。
| VI・FF 25・100μg群 | VI 25μg群 | |
| 症例数 | 806例 | 814例 |
| 投与12週後 | 1.410±0.465(760) | 1.391±0.476(750) |
| 変化量 | 0.117±0.215(759) | 0.082±0.212(749) |
| VI 25μg群との差 [95%信頼区間]注) p値注) | 0.034 [0.014,0.055] p=0.001 | / |
副作用発現頻度は、VI・FF 25・100μg群で2%(20/806例)であった。主な副作用は、口腔カンジダ症1%未満(4/806例)、上気道感染1%未満(3/806例)であった。
17.1.8 国内第III相試験
慢性閉塞性肺疾患患者187例を対象に実施した52週間の二重盲検長期投与試験において、VI・FF 25・100μg(60例)を1日1回投与したところ、治験期間を通しFEV1の改善が維持された7)。
副作用発現頻度は、VI・FF 25・100μg群で20%(12/60例)であった。主な副作用は、発声障害10%(6/60例)、尿中遊離コルチゾール減少3%(2/60例)であった。
副作用発現頻度は、VI・FF 25・100μg群で20%(12/60例)であった。主な副作用は、発声障害10%(6/60例)、尿中遊離コルチゾール減少3%(2/60例)であった。
17.1.9 海外第III相試験
慢性閉塞性肺疾患患者1622例を対象に実施した52週間の二重盲検比較試験において、VI・FF 25・100μg1日1回投与群での中等度又は重度の慢性閉塞性肺疾患の増悪発現のリスク(中等度又は重度の増悪年間発現率)は、下表のとおりであった8)。
| VI・FF 25・100μg群 | VI 25μg群 | |
| 症例数 | 403例 | 409例 |
| 年間発現率注1) | 0.70(401) | 1.05(407) |
| 年間発現率比 [95%信頼区間]注2) p値注2) | 0.66 [0.54,0.81] p<0.001 | / |
| 減少率 [95%信頼区間]注2) | 34% [19,46] | / |
副作用発現頻度は、VI・FF 25・100μg群で16%(64/403例)であった。主な副作用は、口腔カンジダ症7%(29/403例)であった。
17.1.10 海外第III相試験
慢性閉塞性肺疾患患者1633例を対象に実施した52週間の二重盲検比較試験において、VI・FF 25・100μg1日1回投与群での中等度又は重度の慢性閉塞性肺疾患の増悪発現のリスク(中等度又は重度の増悪年間発現率)は、下表のとおりであった8)。
| VI・FF 25・100μg群 | VI 25μg群 | |
| 症例数 | 403例 | 409例 |
| 年間発現率注1) | 0.90(401) | 1.14(402) |
| 年間発現率比 [95%信頼区間]注2) p値注2) | 0.79 [0.64,0.97] p=0.024 | / |
| 減少率 [95%信頼区間]注2) | 21% [3,36] | / |
副作用発現頻度は、VI・FF 25・100μg群で17%(70/403例)であった。主な副作用は、口腔カンジダ症8%(32/403例)であった。
17.1.11 海外第III相試験
慢性閉塞性肺疾患患者519例を対象に実施したVI・FF 25・100μg1日1回投与とSALM・FP 50・250μg1日2回投与を比較した二重盲検比較試験の結果、FEV1加重平均値(0〜24時間)の変化量において、投与群間に有意差が認められた[FEV1加重平均値(0〜24時間)の投与前からの変化量の調整済治療群間差:0.080L(95%信頼区間0.037,0.124、p<0.001)]9)。
副作用発現頻度は、VI・FF 25・100μg群で3%(7/260例)であった。すべての副作用の発現頻度は1%未満(それぞれ1/260例)であり、口腔カンジダ症、膿疱性皮疹、咽頭紅斑、肺塞栓症、咽喉絞扼感、扁桃肥大、動悸、高血糖、筋肉痛、振戦、発熱、血圧上昇であった。
副作用発現頻度は、VI・FF 25・100μg群で3%(7/260例)であった。すべての副作用の発現頻度は1%未満(それぞれ1/260例)であり、口腔カンジダ症、膿疱性皮疹、咽頭紅斑、肺塞栓症、咽喉絞扼感、扁桃肥大、動悸、高血糖、筋肉痛、振戦、発熱、血圧上昇であった。
17.1.12 海外第III相試験
慢性閉塞性肺疾患患者511例を対象に実施したVI・FF 25・100μg1日1回投与とSALM・FP 50・250μg1日2回投与を比較した二重盲検比較試験の結果、FEV1加重平均値(0〜24時間)の変化量において、投与群間に有意差は認められなかった[FEV1加重平均値(0〜24時間)の投与前からの変化量の調整済治療群間差:0.029L(95%信頼区間−0.022,0.080、p=0.267)]9)。
副作用発現頻度は、VI・FF 25・100μg群で4%(11/259例)であった。主な副作用は、中咽頭カンジダ症1%(3/259例)であった。
副作用発現頻度は、VI・FF 25・100μg群で4%(11/259例)であった。主な副作用は、中咽頭カンジダ症1%(3/259例)であった。
17.3 その他
17.3.1 心電図に対する影響
18. 薬効薬理
18.1 作用機序
FFは合成コルチコステロイドの一種であり、炎症性サイトカイン産生の抑制、抗炎症蛋白発現の促進、上皮細胞の保護及び好酸球浸潤の抑制等の作用を介して抗炎症作用を示す10)。VIは長時間作動型吸入β2刺激剤であり、アデニル酸シクラーゼを活性化し細胞内の環状アデノシン一リン酸を増加させることで、気管支平滑筋を弛緩させる。
18.2 抗炎症作用
ヒト末梢血単核球を用いたin vitro併用試験において、VIはFFのTNF-α誘発IL-8放出抑制作用を増強した。
FFはラットの卵白アルブミン誘発肺好酸球増加症モデル等の複数のアレルギー疾患モデルにおける症状を抑制した10)。
FFはラットの卵白アルブミン誘発肺好酸球増加症モデル等の複数のアレルギー疾患モデルにおける症状を抑制した10)。
18.3 気管支収縮に対するVIの作用
VIはモルモットへの単回投与によりヒスタミン誘発気管支収縮を持続的に抑制した。
19. 有効成分に関する理化学的知見
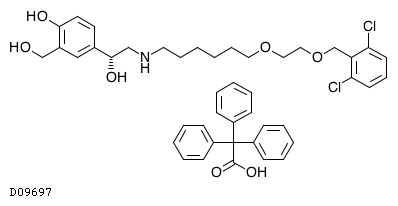
19.1. ビランテロールトリフェニル酢酸塩
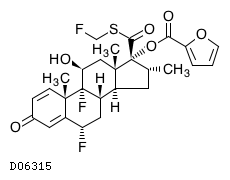
19.2. フルチカゾンフランカルボン酸エステル
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<小児用レルべア50エリプタ14吸入用>
14吸入用[トレイ、乾燥剤入り]×1
<小児用レルべア50エリプタ30吸入用>
30吸入用[トレイ、乾燥剤入り]×1
<レルべア100エリプタ14吸入用>
14吸入用[トレイ、乾燥剤入り]×1
<レルべア100エリプタ30吸入用>
30吸入用[トレイ、乾燥剤入り]×1
<レルべア200エリプタ14吸入用>
14吸入用[トレイ、乾燥剤入り]×1
<レルべア200エリプタ30吸入用>
30吸入用[トレイ、乾燥剤入り]×1
23. 主要文献
- Nakahara N,et al., Int J Clin Pharmacology and Therapeutics., 51 (8), 660-671, (2013)
- Bleecker ER,et al., J Allergy Clin Immunol Pract., 2 (5), 553-561, (2014) »PubMed
- O'Byrne PM,et al., Eur Respir J., 43 (3), 773-782, (2014) »PubMed
- Bateman ED,et al., Thorax., 69 (4), 312-319, (2014) »PubMed
- 村木 正人ほか, アレルギー・免疫, 20 (10), 1496-1511, (2013)
- Woodcock A,et al., Chest., 144 (4), 1222-1229, (2013) »PubMed
- 南方 良章ほか, 呼吸, 32 (10), 956-967, (2013)
- Dransfield MT,et al., Lancet Respir Med., 1 (3), 210-223, (2013) »PubMed
- Dransfield MT,et al., Respir Med., 108 (8), 1171-1179, (2014) »PubMed
- McCormack PL,et al., Drugs., 67, 1905-1915, (2007) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
グラクソ・スミスクライン株式会社
カスタマー・ケア・センター
東京都港区赤坂1-8-1
電話:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
製品情報問い合わせ先
グラクソ・スミスクライン株式会社
カスタマー・ケア・センター
東京都港区赤坂1-8-1
電話:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1