医薬品情報
| 総称名 | ニンラーロ |
|---|---|
| 一般名 | イキサゾミブクエン酸エステル |
| 欧文一般名 | Ixazomib Citrate |
| 製剤名 | イキサゾミブクエン酸エステルカプセル |
| 薬効分類名 | 抗悪性腫瘍剤(プロテアソーム阻害剤) |
| 薬効分類番号 | 4291 |
| ATCコード | L01XG03 |
| KEGG DRUG |
D10131
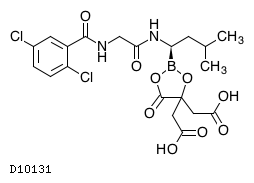
イキサゾミブクエン酸エステル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年11月 改訂(第6版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ニンラーロカプセル0.5mg | NINLARO capsules 0.5mg | 武田薬品工業 | 4291049M4023 | 24023.7円/カプセル | 毒薬, 処方箋医薬品注) |
| ニンラーロカプセル2.3mg | NINLARO capsules 2.3mg | 武田薬品工業 | 4291049M1024 | 98306.4円/カプセル | 毒薬, 処方箋医薬品注) |
| ニンラーロカプセル3mg | NINLARO capsules 3mg | 武田薬品工業 | 4291049M2020 | 125640円/カプセル | 毒薬, 処方箋医薬品注) |
| ニンラーロカプセル4mg | NINLARO capsules 4mg | 武田薬品工業 | 4291049M3027 | 163865.4円/カプセル | 毒薬, 処方箋医薬品注) |
1. 警告
本剤は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識と経験を持つ医師のもとで、本剤が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
5. 効能または効果に関連する注意
ニンラーロカプセル2.3mg
<再発又は難治性の多発性骨髄腫>
5.1 本剤による治療は、少なくとも1つの標準的な治療が無効又は治療後に再発した患者を対象とすること。
5.2 臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分理解した上で、適応患者の選択を行うこと。[17.1.1参照]
ニンラーロカプセル3mg
<再発又は難治性の多発性骨髄腫>
5.1 本剤による治療は、少なくとも1つの標準的な治療が無効又は治療後に再発した患者を対象とすること。
5.2 臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分理解した上で、適応患者の選択を行うこと。[17.1.1参照]
ニンラーロカプセル4mg
<再発又は難治性の多発性骨髄腫>
5.1 本剤による治療は、少なくとも1つの標準的な治療が無効又は治療後に再発した患者を対象とすること。
5.2 臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分理解した上で、適応患者の選択を行うこと。[17.1.1参照]
6. 用法及び用量
ニンラーロカプセル0.5mg
<多発性骨髄腫における維持療法>
通常、成人には1日1回、本剤を空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16〜28日目)する。この4週間を1サイクルとし、投与を繰り返す。本剤の投与量は、4サイクルまではイキサゾミブとして3mg、5サイクル以降はイキサゾミブとして4mgとする。なお、患者の状態により適宜減量する。
ニンラーロカプセル2.3mg
<再発又は難治性の多発性骨髄腫>
レナリドミド及びデキサメタゾンとの併用において、通常、成人にはイキサゾミブとして1日1回4mgを空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16〜28日目)する。この4週間を1サイクルとし、投与を繰り返す。なお、患者の状態により適宜減量する。
<多発性骨髄腫における維持療法>
通常、成人には1日1回、本剤を空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16〜28日目)する。この4週間を1サイクルとし、投与を繰り返す。本剤の投与量は、4サイクルまではイキサゾミブとして3mg、5サイクル以降はイキサゾミブとして4mgとする。なお、患者の状態により適宜減量する。
ニンラーロカプセル3mg
<再発又は難治性の多発性骨髄腫>
レナリドミド及びデキサメタゾンとの併用において、通常、成人にはイキサゾミブとして1日1回4mgを空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16〜28日目)する。この4週間を1サイクルとし、投与を繰り返す。なお、患者の状態により適宜減量する。
<多発性骨髄腫における維持療法>
通常、成人には1日1回、本剤を空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16〜28日目)する。この4週間を1サイクルとし、投与を繰り返す。本剤の投与量は、4サイクルまではイキサゾミブとして3mg、5サイクル以降はイキサゾミブとして4mgとする。なお、患者の状態により適宜減量する。
ニンラーロカプセル4mg
<再発又は難治性の多発性骨髄腫>
レナリドミド及びデキサメタゾンとの併用において、通常、成人にはイキサゾミブとして1日1回4mgを空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16〜28日目)する。この4週間を1サイクルとし、投与を繰り返す。なお、患者の状態により適宜減量する。
<多発性骨髄腫における維持療法>
通常、成人には1日1回、本剤を空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16〜28日目)する。この4週間を1サイクルとし、投与を繰り返す。本剤の投与量は、4サイクルまではイキサゾミブとして3mg、5サイクル以降はイキサゾミブとして4mgとする。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
ニンラーロカプセル0.5mg
<効能共通>
7.1 食後に本剤を投与した場合、本剤のCmax及びAUCが低下するとの報告がある。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けること。[16.2.1参照]
7.2 新たなサイクルの開始にあたっては、以下の基準を参考に投与の可否を判断すること。
| 好中球数 | 1,000/mm3以上 |
| 血小板数 | 75,000/mm3以上 |
| 非血液毒性 | ベースライン又はGrade1以下に回復 |
<多発性骨髄腫における維持療法>
7.7 他の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.8 本剤を24ヵ月を超えて投与した場合の有効性及び安全性は確立していない。
7.9 本剤投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量、中止すること。[8.、11.1.1、11.1.4参照]
| 1〜4サイクル | 5サイクル以降 | |
| 通常用量 | 3mg | 4mg |
| ステップ1(1段階減量) | 2.3mg | 3mg |
| ステップ2(2段階減量) | 1.5mg | 2.3mg |
| ステップ3(3段階減量) | 投与中止 | 1.5mg |
| ステップ4 | − | 投与中止 |
| 副作用 | 程度 | 処置 |
| 血小板減少症 | 血小板数 50,000/mm3未満 | 75,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 好中球減少症 | 好中球数 750/mm3未満 | 1,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 皮膚障害 | Grade2 | 対症療法を行い、投与を継続できる。忍容できない場合は、1段階減量して投与する。 |
| Grade3 | Grade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 末梢神経障害 | 疼痛を伴うGrade1又は疼痛を伴わないGrade2 | ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬する。回復後、同一用量で投与を再開できる。 |
| 疼痛を伴うGrade2又はGrade3 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 上記以外の副作用 | Grade3の非血液毒性 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| Grade4の非血液毒性 | 投与を中止する、又は治療上の有益性を考慮し、1段階減量して投与を再開できる。 |
7.10 0.5mgカプセルと他の含量のカプセルの生物学的同等性は示されていないため、3mg又は4mgを投与する際には0.5mgカプセルを使用しないこと。
ニンラーロカプセル2.3mg
<効能共通>
7.1 食後に本剤を投与した場合、本剤のCmax及びAUCが低下するとの報告がある。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けること。[16.2.1参照]
7.2 新たなサイクルの開始にあたっては、以下の基準を参考に投与の可否を判断すること。
| 好中球数 | 1,000/mm3以上 |
| 血小板数 | 75,000/mm3以上 |
| 非血液毒性 | ベースライン又はGrade1以下に回復 |
<再発又は難治性の多発性骨髄腫>
7.3 本剤を単独投与した場合の有効性及び安全性は確立していない。
7.4 レナリドミド及びデキサメタゾンの投与に際しては、「17.臨床成績」の項の内容を熟知し、投与すること。[17.1.1参照]
7.5 レナリドミド及びデキサメタゾン以外の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.6 本剤投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量、中止すること。[8.、11.1.1、11.1.4参照]
| 開始用量 | 4mg |
| ステップ1(1段階減量) | 3mg |
| ステップ2(2段階減量) | 2.3mg |
| ステップ3 | 投与中止 |
| 副作用 | 程度 | 処置 |
| 血小板減少症 | 血小板数 30,000/mm3未満 | 30,000/mm3以上に回復するまで、休薬する。回復後、同一用量で投与を再開できる。再び30,000/mm3未満に減少した場合は、30,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 好中球減少症 | 好中球数 500/mm3未満 | 500/mm3以上に回復するまで、休薬する。回復後、同一用量で投与を再開できる。再び500/mm3未満に減少した場合は、500/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 皮膚障害 | Grade2 | 対症療法を行い、投与を継続できる。忍容できない場合は、下記「Grade3」参照。 |
| Grade3 | Grade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 末梢神経障害 | 疼痛を伴うGrade1又は疼痛を伴わないGrade2 | ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬する。回復後、同一用量で投与を再開できる。 |
| 疼痛を伴うGrade2又はGrade3 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 上記以外の副作用 | Grade3の非血液毒性 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| Grade4の非血液毒性 | 投与を中止する。 |
<多発性骨髄腫における維持療法>
7.7 他の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.8 本剤を24ヵ月を超えて投与した場合の有効性及び安全性は確立していない。
7.9 本剤投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量、中止すること。[8.、11.1.1、11.1.4参照]
| 1〜4サイクル | 5サイクル以降 | |
| 通常用量 | 3mg | 4mg |
| ステップ1(1段階減量) | 2.3mg | 3mg |
| ステップ2(2段階減量) | 1.5mg | 2.3mg |
| ステップ3(3段階減量) | 投与中止 | 1.5mg |
| ステップ4 | − | 投与中止 |
| 副作用 | 程度 | 処置 |
| 血小板減少症 | 血小板数 50,000/mm3未満 | 75,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 好中球減少症 | 好中球数 750/mm3未満 | 1,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 皮膚障害 | Grade2 | 対症療法を行い、投与を継続できる。忍容できない場合は、1段階減量して投与する。 |
| Grade3 | Grade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 末梢神経障害 | 疼痛を伴うGrade1又は疼痛を伴わないGrade2 | ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬する。回復後、同一用量で投与を再開できる。 |
| 疼痛を伴うGrade2又はGrade3 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 上記以外の副作用 | Grade3の非血液毒性 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| Grade4の非血液毒性 | 投与を中止する、又は治療上の有益性を考慮し、1段階減量して投与を再開できる。 |
7.10 0.5mgカプセルと他の含量のカプセルの生物学的同等性は示されていないため、3mg又は4mgを投与する際には0.5mgカプセルを使用しないこと。
ニンラーロカプセル3mg
<効能共通>
7.1 食後に本剤を投与した場合、本剤のCmax及びAUCが低下するとの報告がある。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けること。[16.2.1参照]
7.2 新たなサイクルの開始にあたっては、以下の基準を参考に投与の可否を判断すること。
| 好中球数 | 1,000/mm3以上 |
| 血小板数 | 75,000/mm3以上 |
| 非血液毒性 | ベースライン又はGrade1以下に回復 |
<再発又は難治性の多発性骨髄腫>
7.3 本剤を単独投与した場合の有効性及び安全性は確立していない。
7.4 レナリドミド及びデキサメタゾンの投与に際しては、「17.臨床成績」の項の内容を熟知し、投与すること。[17.1.1参照]
7.5 レナリドミド及びデキサメタゾン以外の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.6 本剤投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量、中止すること。[8.、11.1.1、11.1.4参照]
| 開始用量 | 4mg |
| ステップ1(1段階減量) | 3mg |
| ステップ2(2段階減量) | 2.3mg |
| ステップ3 | 投与中止 |
| 副作用 | 程度 | 処置 |
| 血小板減少症 | 血小板数 30,000/mm3未満 | 30,000/mm3以上に回復するまで、休薬する。回復後、同一用量で投与を再開できる。再び30,000/mm3未満に減少した場合は、30,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 好中球減少症 | 好中球数 500/mm3未満 | 500/mm3以上に回復するまで、休薬する。回復後、同一用量で投与を再開できる。再び500/mm3未満に減少した場合は、500/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 皮膚障害 | Grade2 | 対症療法を行い、投与を継続できる。忍容できない場合は、下記「Grade3」参照。 |
| Grade3 | Grade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 末梢神経障害 | 疼痛を伴うGrade1又は疼痛を伴わないGrade2 | ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬する。回復後、同一用量で投与を再開できる。 |
| 疼痛を伴うGrade2又はGrade3 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 上記以外の副作用 | Grade3の非血液毒性 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| Grade4の非血液毒性 | 投与を中止する。 |
<多発性骨髄腫における維持療法>
7.7 他の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.8 本剤を24ヵ月を超えて投与した場合の有効性及び安全性は確立していない。
7.9 本剤投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量、中止すること。[8.、11.1.1、11.1.4参照]
| 1〜4サイクル | 5サイクル以降 | |
| 通常用量 | 3mg | 4mg |
| ステップ1(1段階減量) | 2.3mg | 3mg |
| ステップ2(2段階減量) | 1.5mg | 2.3mg |
| ステップ3(3段階減量) | 投与中止 | 1.5mg |
| ステップ4 | − | 投与中止 |
| 副作用 | 程度 | 処置 |
| 血小板減少症 | 血小板数 50,000/mm3未満 | 75,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 好中球減少症 | 好中球数 750/mm3未満 | 1,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 皮膚障害 | Grade2 | 対症療法を行い、投与を継続できる。忍容できない場合は、1段階減量して投与する。 |
| Grade3 | Grade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 末梢神経障害 | 疼痛を伴うGrade1又は疼痛を伴わないGrade2 | ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬する。回復後、同一用量で投与を再開できる。 |
| 疼痛を伴うGrade2又はGrade3 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 上記以外の副作用 | Grade3の非血液毒性 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| Grade4の非血液毒性 | 投与を中止する、又は治療上の有益性を考慮し、1段階減量して投与を再開できる。 |
7.10 0.5mgカプセルと他の含量のカプセルの生物学的同等性は示されていないため、3mg又は4mgを投与する際には0.5mgカプセルを使用しないこと。
ニンラーロカプセル4mg
<効能共通>
7.1 食後に本剤を投与した場合、本剤のCmax及びAUCが低下するとの報告がある。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けること。[16.2.1参照]
7.2 新たなサイクルの開始にあたっては、以下の基準を参考に投与の可否を判断すること。
| 好中球数 | 1,000/mm3以上 |
| 血小板数 | 75,000/mm3以上 |
| 非血液毒性 | ベースライン又はGrade1以下に回復 |
<再発又は難治性の多発性骨髄腫>
7.3 本剤を単独投与した場合の有効性及び安全性は確立していない。
7.4 レナリドミド及びデキサメタゾンの投与に際しては、「17.臨床成績」の項の内容を熟知し、投与すること。[17.1.1参照]
7.5 レナリドミド及びデキサメタゾン以外の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.6 本剤投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量、中止すること。[8.、11.1.1、11.1.4参照]
| 開始用量 | 4mg |
| ステップ1(1段階減量) | 3mg |
| ステップ2(2段階減量) | 2.3mg |
| ステップ3 | 投与中止 |
| 副作用 | 程度 | 処置 |
| 血小板減少症 | 血小板数 30,000/mm3未満 | 30,000/mm3以上に回復するまで、休薬する。回復後、同一用量で投与を再開できる。再び30,000/mm3未満に減少した場合は、30,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 好中球減少症 | 好中球数 500/mm3未満 | 500/mm3以上に回復するまで、休薬する。回復後、同一用量で投与を再開できる。再び500/mm3未満に減少した場合は、500/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 皮膚障害 | Grade2 | 対症療法を行い、投与を継続できる。忍容できない場合は、下記「Grade3」参照。 |
| Grade3 | Grade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 末梢神経障害 | 疼痛を伴うGrade1又は疼痛を伴わないGrade2 | ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬する。回復後、同一用量で投与を再開できる。 |
| 疼痛を伴うGrade2又はGrade3 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 上記以外の副作用 | Grade3の非血液毒性 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| Grade4の非血液毒性 | 投与を中止する。 |
<多発性骨髄腫における維持療法>
7.7 他の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.8 本剤を24ヵ月を超えて投与した場合の有効性及び安全性は確立していない。
7.9 本剤投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量、中止すること。[8.、11.1.1、11.1.4参照]
| 1〜4サイクル | 5サイクル以降 | |
| 通常用量 | 3mg | 4mg |
| ステップ1(1段階減量) | 2.3mg | 3mg |
| ステップ2(2段階減量) | 1.5mg | 2.3mg |
| ステップ3(3段階減量) | 投与中止 | 1.5mg |
| ステップ4 | − | 投与中止 |
| 副作用 | 程度 | 処置 |
| 血小板減少症 | 血小板数 50,000/mm3未満 | 75,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 好中球減少症 | 好中球数 750/mm3未満 | 1,000/mm3以上に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| 皮膚障害 | Grade2 | 対症療法を行い、投与を継続できる。忍容できない場合は、1段階減量して投与する。 |
| Grade3 | Grade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 末梢神経障害 | 疼痛を伴うGrade1又は疼痛を伴わないGrade2 | ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬する。回復後、同一用量で投与を再開できる。 |
| 疼痛を伴うGrade2又はGrade3 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 | |
| Grade4 | 投与を中止する。 | |
| 上記以外の副作用 | Grade3の非血液毒性 | ベースライン又はGrade1以下に回復するまで、休薬する。回復後、1段階減量して投与を再開できる。 |
| Grade4の非血液毒性 | 投与を中止する、又は治療上の有益性を考慮し、1段階減量して投与を再開できる。 |
7.10 0.5mgカプセルと他の含量のカプセルの生物学的同等性は示されていないため、3mg又は4mgを投与する際には0.5mgカプセルを使用しないこと。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 重度の腎機能障害のある患者(クレアチニンクリアランスが30mL/min未満)
減量を考慮するとともに、患者の状態をより慎重に観察し、有害事象の発現に十分注意すること。本剤の血中濃度が上昇することがあり、副作用が強くあらわれるおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 中等度以上の肝機能障害のある患者(総ビリルビン値が基準値上限の1.5倍超)
減量を考慮するとともに、患者の状態をより慎重に観察し、有害事象の発現に十分注意すること。本剤の血中濃度が上昇することがあり、副作用が強くあらわれるおそれがある。[16.6.2参照]
9.4 生殖能を有する者
9.4.1 妊娠可能な女性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。ラットにおいてAUC比較で臨床曝露量を下回る用量で精巣毒性が認められた。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト乳汁中への移行は不明である。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| CYP3A誘導剤 リファンピシン カルバマゼピン フェニトイン等 セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品等 [16.7.1参照] | 本剤の血中濃度が低下し、効果が減弱するおそれがあるので、CYP3A誘導作用のない薬剤への代替を考慮すること。 | リファンピシンの薬物代謝酵素(CYP3A等)に対する誘導作用により、本剤の代謝が促進される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.2 重度の下痢(2.7%)
11.1.3 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.1.4 末梢神経障害
11.1.5 可逆性後白質脳症症候群(頻度不明)
可逆性後白質脳症症候群(症状:痙攣発作、血圧上昇、頭痛、意識変容、視覚障害等)があらわれることがある。
11.1.6 感染症(21.2%)
帯状疱疹(4.1%)、肺炎(3.0%)等があらわれることがある。
11.2 その他の副作用
| 10%以上 | 5〜10%未満 | 5%未満 | |
| 血液/リンパ系 | 好中球減少症 | 貧血 | 白血球減少症、リンパ球減少症、汎血球減少症 |
| 過敏症 | 血管性浮腫 | ||
| 神経系 | 浮動性めまい、錯感覚、味覚異常、頭痛、振戦、感覚鈍麻、傾眠、注意力障害、嗜眠、味覚減退、神経痛 | ||
| 眼 | 白内障、霧視、眼乾燥、結膜炎、眼刺激 | ||
| 血管 | 高血圧、深部静脈血栓症、潮紅、低血圧 | ||
| 呼吸器 | 咳嗽、呼吸困難、しゃっくり、肺塞栓症、鼻出血、口腔咽頭痛 | ||
| 消化器 | 悪心(24.1%)、下痢(23.0%)、嘔吐 | 便秘 | 上腹部痛、腹痛、消化不良、口内炎、腹部膨満、胃食道逆流性疾患、口内乾燥、胃炎、腹部不快感、放屁、口腔内潰瘍形成 |
| 肝臓 | ALT増加、AL-P増加、γ-GTP増加 | ||
| 皮膚 | 発疹 | そう痒症、紅斑、ざ瘡様皮膚炎、薬疹、そう痒性皮疹、多汗症、紅斑性皮疹、剥脱性皮膚炎、全身性そう痒症、急性熱性好中球性皮膚症(Sweet症候群)、脱毛症 | |
| その他 | 疲労 | 不眠症、無力症、末梢性浮腫、発熱 | 食欲減退、筋痙縮、関節痛、筋力低下、倦怠感、筋肉痛、体重増加、高血糖、体重減少、四肢痛、激越、気分変化、低カリウム血症、末梢腫脹、顔面浮腫、背部痛、易刺激性、インフルエンザ様疾患、挫傷、錯乱状態、クッシング様症状、うつ病、不安、血中クレアチニン増加、低カルシウム血症、気分動揺、動悸、腎不全、耳鳴、回転性めまい、疼痛、関節腫脹 |
13. 過量投与
13.1 処置
本剤は血液透析により除去されない。
14. 適用上の注意
14.1 薬剤調製時の注意
調剤時に脱カプセルをしないこと。
14.2 薬剤交付時の注意
14.2.1 吸湿を防ぐためPTP包装のまま保存し、服用時にPTPシートから取り出すように指導すること。
14.2.2 カプセルはつぶしたり、噛んだり、開けたりせず、そのまま水とともに服用するように指導すること。
16. 薬物動態
16.1 血中濃度
16.1.1 単独投与
再発又は難治性の多発性骨髄腫患者にイキサゾミブとして1日1回4mgを週1回、3週間経口投与時注1)の本剤の血漿中濃度を測定した。1日目及び15日目共に、本剤の血漿中濃度は投与後約2時間までに最高値に達し、その後多相性の指数関数的な消失プロファイルを示した。投与15日目における本剤の終末相半減期は約6日であり、また、平均蓄積比は約2であった1)。
本剤の血漿中濃度推移(平均値)
| パラメータ | 1日目 | 15日目 |
| N | 7 | 5 |
| Tmax(hr)注) | 1.08(0.48-7.17) | 1.83(0.25-3.25) |
| Cmax(ng/mL) | 65.3(61) | 68.8(68) |
| AUC0-168(ng・hr/mL) | 1071(79) | 1588(60) |
16.1.2 併用投与
再発又は難治性の多発性骨髄腫患者にレナリドミド及びデキサメタゾン併用下、イキサゾミブとして1日1回4mgを週1回、3週間経口投与時の本剤の血漿中濃度を測定した。1日目及び15日目共に、本剤の血漿中濃度は投与後約2時間までに最高値に達し、その後多相性の指数関数的な消失プロファイルを示した。投与15日目における本剤の終末相半減期は5.2日であり、また、平均蓄積比は1.78であった1)。
本剤の血漿中濃度推移(平均値)
| パラメータ | 1日目 | 15日目 |
| N | 7 | 6 |
| Tmax(hr)注) | 1.45(1.00-7.17) | 1.38(0.47-7.08) |
| Cmax(ng/mL) | 32.9(52) | 34.5(95) |
| AUC0-168(ng・hr/mL) | 564(41) | 1086(54) |
16.2 吸収
16.2.1 食事の影響
16.3 分布
本剤は高い血漿蛋白結合率(99%)を示した。また、本剤は赤血球に多く分布し、AUCに基づく血液−血漿分配比は約10であった3)(外国人データ)。
16.4 代謝
16.4.1 本剤の放射性標識体を経口投与した時、血漿中に認められた放射能の70%を未変化体が占めていた4)(外国人データ)。
16.4.2 臨床用量における血漿中濃度付近のイキサゾミブの代謝には主にCYP以外の蛋白が関与し、特定のCYP分子種が関与しないことが示唆された。臨床用量における血漿中濃度より高いイキサゾミブ濃度(10μmol/L)では、各CYP分子種の寄与率はCYP3A4が42.3%、1A2が26.1%、2B6が16.0%、2C8が6.0%、2D6が4.8%、2C19が4.8%、2C9が1%未満であった(in vitro)5)。
16.5 排泄
本剤の放射性標識体を進行がん患者5例に単回経口投与した時、投与後34日までに投与した放射能の62%が尿中に、22%が糞中に排泄された。また、投与後7日までに尿中に回収された未変化体は投与量の3.2%であった4)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 リファンピシン
16.7.2 その他の薬剤
クラリスロマイシン500mgを進行がん患者15例に1日2回反復投与時に、本剤2.5mg注1)を併用投与した時、本剤のCmax及びAUCに対する明確な影響は認められなかった(本剤のCmaxが4%減少、AUCが11%増加した。)2)(外国人データ)。
注1)本剤の承認用法・用量はレナリドミド及びデキサメタゾンとの併用の場合は1日1回4mgを週1回、3週間経口投与の後、13日間休薬、単独投与の場合は最初の4サイクルは1日1回3mg、5サイクル以降は1日1回4mgを週1回、3週間経口投与の後、13日間休薬である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<再発又は難治性の多発性骨髄腫>
17.1.1 国際共同第III相試験(二重盲検比較試験)
1〜3レジメンの前治療歴を有する再発又は難治性の多発性骨髄腫患者を対象に、レナリドミド注1)及びデキサメタゾン注2)の併用下で、プラセボを対照としてイキサゾミブとして4mg注3)を経口投与した。なお、レナリドミド又はプロテアソーム阻害剤に難治性の患者は対象から除外した。
合計722例(日本人41例を含む)が無作為割付され、主要評価項目である無増悪生存期間(PFS)は盲検化された独立評価委員会(IRC)により中央検査結果に基づき評価され、イキサゾミブ投与群において有意な延長が認められた(2014年10月30日データカットオフ)。
合計722例(日本人41例を含む)が無作為割付され、主要評価項目である無増悪生存期間(PFS)は盲検化された独立評価委員会(IRC)により中央検査結果に基づき評価され、イキサゾミブ投与群において有意な延長が認められた(2014年10月30日データカットオフ)。
注1)レナリドミドの用法・用量
28日間を1サイクルとし、1日1回25mgを1〜21日目に連日経口投与した後、7日間(22〜28日目)休薬した。
注2)デキサメタゾンの用法・用量
28日間を1サイクルとし、1日1回40mgを1、8、15、22日目に経口投与した。
注3)イキサゾミブの用法・用量
28日間を1サイクルとし、1日1回4mgを1、8、15日目に経口投与した。
IRCの判定に基づく無増悪生存期間のKaplan-Meier曲線(ITT)(2014年10月30日データカットオフ)
| イキサゾミブ群 (n=360) | プラセボ群 (n=362) | |
| PFSイベント数 | 129 | 157 |
| 無増悪生存期間の中央値(月) (95%信頼区間) | 20.6 (17.02〜NE注6)) | 14.7 (12.91〜17.58) |
| p値注4)(有意水準) | 0.012(0.02268) | |
| ハザード比(95%信頼区間)注5) | 0.742(0.587〜0.939) | |
また、副次評価項目である全生存期間(OS)の中間解析(2015年7月12日データカットオフ)の時点でOSイベント数はイキサゾミブ投与群で81件、プラセボ投与群で90件であり、OSは両群とも中央値に到達していない(ハザード比:0.868、95%信頼区間:0.642〜1.175、p=0.359)(2015年7月12日データカットオフ)。
日本人部分集団41例(イキサゾミブ投与群20例、プラセボ投与群21例)における2015年7月12日データカットオフ時点のPFSイベント数はイキサゾミブ投与群で7件、プラセボ投与群で8件であり、PFSの中央値(95%信頼区間)は、イキサゾミブ投与群で17.0ヵ月(10.18〜推定不能)、プラセボ投与群で18.7ヵ月(7.43〜18.83)であった(ハザード比:1.323、95%信頼区間:0.443〜3.954)(2015年7月12日データカットオフ)8)。
日本人部分集団41例(イキサゾミブ投与群20例、プラセボ投与群21例)における2015年7月12日データカットオフ時点のPFSイベント数はイキサゾミブ投与群で7件、プラセボ投与群で8件であり、PFSの中央値(95%信頼区間)は、イキサゾミブ投与群で17.0ヵ月(10.18〜推定不能)、プラセボ投与群で18.7ヵ月(7.43〜18.83)であった(ハザード比:1.323、95%信頼区間:0.443〜3.954)(2015年7月12日データカットオフ)8)。
IRCの判定に基づく無増悪生存期間のKaplan-Meier曲線(日本人部分集団)(2015年7月12日データカットオフ)
<多発性骨髄腫における自家造血幹細胞移植後の維持療法>
17.1.2 国際共同第III相試験(二重盲検比較試験)
自家造血幹細胞移植(ASCT)後の初発の多発性骨髄腫患者を対象に注7)、プラセボを対照としてイキサゾミブを経口投与した注8)。なお、多発性骨髄腫が一次療法施行後に再発した患者、又は一次療法に無反応であった患者(ASCT施行後に奏効が得られなかった患者を含む)は対象から除外した。
合計656例(日本人22例を含む)が3:2の割合でイキサゾミブ又はプラセボに無作為割付され、主要評価項目である無増悪生存期間(PFS)は盲検化された独立評価委員会(IRC)により中央検査結果に基づき評価され、イキサゾミブ投与群において有意な延長が認められた(2018年4月16日データカットオフ)9)。
合計656例(日本人22例を含む)が3:2の割合でイキサゾミブ又はプラセボに無作為割付され、主要評価項目である無増悪生存期間(PFS)は盲検化された独立評価委員会(IRC)により中央検査結果に基づき評価され、イキサゾミブ投与群において有意な延長が認められた(2018年4月16日データカットオフ)9)。
注7)初回治療として寛解導入療法に続いて大量メルファラン療法及びASCTが実施され、部分奏効以上の奏効が得られた患者を対象とした。
注8)イキサゾミブの用法・用量
28日間を1サイクルとし、最初の4サイクルは、イキサゾミブ3mgを週1回(28日サイクルの1、8及び15日目)経口投与し、最初の4サイクル中に忍容性が認められれば、サイクル5の1日目に4mgへと増量した。なお、イキサゾミブ又はプラセボは、最長で約24ヵ月間、又は病勢進行若しくは忍容不能な毒性が確認されるまで(いずれか早い方まで)投与した。
IRCの判定に基づく無増悪生存期間のKaplan-Meier曲線(ITT)(2018年4月16日データカットオフ)
| イキサゾミブ群 (n=395) | プラセボ群 (n=261) | |
| PFSイベント数 | 198(50%) | 156(60%) |
| 無増悪生存期間の中央値(月) (95%信頼区間) | 26.5 (23.69〜33.81) | 21.3 (17.97〜24.67) |
| p値注9)(有意水準) | 0.002(0.05) | |
| ハザード比(95%信頼区間)注10) | 0.720(0.582〜0.890) | |
副作用発現頻度は、イキサゾミブ投与群で78%〔307/394例(日本人13例含む)〕であった。主な副作用(10%以上)は、悪心〔31%(124例)〕、下痢〔22%(86例)〕、嘔吐〔22%(86例)〕及び疲労〔11%(45例)〕であった。
<自家造血幹細胞移植の適応とならない多発性骨髄腫における維持療法>
17.1.3 国際共同第III相試験(二重盲検比較試験)
自家造血幹細胞移植(ASCT)の適応とならず、かつ初回治療により奏効が認められた初発の多発性骨髄腫患者を対象に注11)、プラセボを対照としてイキサゾミブを経口投与した注12)。なお、多発性骨髄腫が一次療法施行後に再発した患者、又は一次療法に無反応であった患者は対象から除外した。
合計706例(日本人32例を含む)が3:2の割合でイキサゾミブ又はプラセボに無作為割付され、主要評価項目である無増悪生存期間(PFS)は盲検化された独立評価委員会(IRC)により中央検査結果に基づき評価され、イキサゾミブ投与群において有意な延長が認められた(2019年8月12日データカットオフ)10)。
合計706例(日本人32例を含む)が3:2の割合でイキサゾミブ又はプラセボに無作為割付され、主要評価項目である無増悪生存期間(PFS)は盲検化された独立評価委員会(IRC)により中央検査結果に基づき評価され、イキサゾミブ投与群において有意な延長が認められた(2019年8月12日データカットオフ)10)。
注11)初回治療に対して部分奏効以上の奏効が認められた患者を対象とした。
注12)イキサゾミブの用法・用量
28日間を1サイクルとし、最初の4サイクルは、イキサゾミブ3mgを週1回(28日サイクルの1、8及び15日目)経口投与し、最初の4サイクル中に忍容性が認められれば、サイクル5の1日目に4mgへと増量した。なお、イキサゾミブ又はプラセボは、最長で約24ヵ月間、又は病勢進行若しくは忍容不能な毒性が確認されるまで(いずれか早い方まで)投与した。
IRCの判定に基づく無増悪生存期間のKaplan-Meier曲線(ITT)(2019年8月12日データカットオフ)
| イキサゾミブ群 (n=425) | プラセボ群 (n=281) | |
| PFSイベント数 | 228(54%) | 198(70%) |
| 無増悪生存期間の中央値(月) (95%信頼区間) | 17.4 (14.78〜20.30) | 9.4 (8.51〜11.47) |
| p値注13)(有意水準) | <0.001(0.04) | |
| ハザード比(95%信頼区間)注14) | 0.659(0.542〜0.801) | |
副作用発現頻度は、イキサゾミブ投与群で67%〔284/426例(日本人17例含む)〕であった。主な副作用(10%以上)は、悪心〔22%(92例)〕、嘔吐〔19%(82例)〕、下痢〔18%(76例)〕及び末梢性感覚ニューロパチー〔12%(50例)〕であった。
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. イキサゾミブクエン酸エステル
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ニンラーロカプセル0.5mg>
患者さん用パッケージ付きPTP
1カプセル×3
<ニンラーロカプセル2.3mg、3mg、4mg>
患者さん用パッケージ付きPTP
1カプセル×1
23. 主要文献
- イキサゾミブクエン酸エステルの薬物動態試験成績[1](2017年3月30日承認,CTD 2.7.6.1)(社内資料)
- イキサゾミブクエン酸エステルの薬物動態試験成績[2](2017年3月30日承認,CTD 2.7.6.7)(社内資料)
- イキサゾミブクエン酸エステルの薬物動態試験成績[3](2017年3月30日承認,CTD 2.7.2)(社内資料)
- イキサゾミブクエン酸エステルの薬物動態試験成績[4](2017年3月30日承認,CTD 2.7.6.9)(社内資料)
- イキサゾミブクエン酸エステルの非臨床薬物動態試験成績(2017年3月30日承認,CTD 2.6.4.5)(社内資料)
- イキサゾミブクエン酸エステルの薬物動態試験成績[5](2017年3月30日承認,CTD 2.7.6.10)(社内資料)
- イキサゾミブクエン酸エステルの薬物動態試験成績[6](2017年3月30日承認,CTD 2.7.6.8)(社内資料)
- イキサゾミブクエン酸エステルの第III相試験成績[1](2017年3月30日承認,CTD 2.7.6.5)(社内資料)
- イキサゾミブクエン酸エステルの第III相試験成績[2](社内資料)
- イキサゾミブクエン酸エステルの第III相試験成績[3](社内資料)
- イキサゾミブクエン酸エステルの非臨床薬理試験成績(2017年3月30日承認,CTD 2.6.2)(社内資料)
- Chauhan D.et al., Clin.Cancer Res., 17 (16), 5311-5321, (2011)
24. 文献請求先及び問い合わせ先
文献請求先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製品情報問い合わせ先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
武田薬品工業株式会社
〒540-8645
大阪市中央区道修町四丁目1番1号