医薬品情報
| 総称名 | ロゼバラミン |
|---|---|
| 一般名 | メコバラミン |
| 欧文一般名 | Mecobalamin |
| 製剤名 | メコバラミン製剤 |
| 薬効分類名 | 筋萎縮性側索硬化症用剤 |
| 薬効分類番号 | 1190 |
| KEGG DRUG |
D03246
メコバラミン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(保険給付上の注意に関する情報削除)(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロゼバラミン筋注用25mg | Rozebalamin for Injection | エーザイ | 1190410E1024 | 10425円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
筋萎縮性側索硬化症(ALS)における機能障害の進行抑制
5. 効能または効果に関連する注意
臨床試験に組み入れられた患者の罹病期間、ALS重症度、呼吸機能等の背景及び試験結果を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.1参照]
6. 用法及び用量
通常、成人には、メコバラミンとして50mgを1日1回、週2回、筋肉内に注射する。
8. 重要な基本的注意
8.1 本剤の投与開始にあたっては、医療施設において、必ず医師によるか、医師の直接の監督の下で投与を行うこと。本剤の在宅自己注射は、医師がその妥当性を慎重に検討し、患者又はその家族が適切に使用可能と判断した場合にのみ適用すること。また、適用にあたっては、以下の点に注意すること。
8.1.1 自己投与の適用については、使用方法等の患者教育を十分に実施した後、在宅にて適切な治療が行えることを確認した上で、医師の管理指導の下で実施すること。
8.1.2 患者又はその家族に対し、本剤の投与により発現する可能性のある副作用等についても十分説明し、在宅自己注射後何らかの異常が認められた場合には、速やかに医療機関へ連絡するよう指導すること。
8.1.3 適用後、本剤による副作用が疑われる場合や自己注射の継続が困難な場合には、直ちに自己注射を中止させるなど適切な処置を行うこと。
8.1.4 使用済みの注射針あるいは注射器を再使用しないよう指導すること。
8.1.5 すべての器具及び使用後の残液の安全な廃棄方法について指導を徹底すること。
9. 特定の背景を有する患者に関する注意
9.7 小児等
小児等を対象とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
血圧降下、呼吸困難等のアナフィラキシーを起こすことがある。
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | ||
| 血液 | 白血球数増加 | ||
| その他 | 注射部位反応 | 頭痛 | 発熱感、発汗 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤の溶解には、日本薬局方生理食塩液を用い、完全に溶解したことを確認すること。
14.1.2 本剤1バイアルあたり生理食塩液2.3mLで溶解し、そのうち2.0mLを投与すること。
14.1.3 光分解を受けやすいので、遮光に留意した上で開封後直ちに使用することとし、生理食塩液にて溶解後は最大60分以内に投与すること。60分以内に投与されない場合は、廃棄すること。
14.1.4 使用後の残液は、細菌汚染のおそれがあるので使用しないこと。
14.2 薬剤投与時の注意
14.2.1 本剤は筋肉内注射のみに使用し、静脈内投与又は皮下投与は行わないこと。
14.2.2 筋肉内注射時
組織・神経などへの影響を避けるため、下記の点に注意すること。
(1)同一部位への反復注射は避けること。
(2)神経走行部位を避けるよう注意すること。
(3)注射針を刺入したとき、激痛を訴えたり、血液の逆流を見た場合には、直ちに針を抜き、部位をかえて注射すること。
14.3 薬剤交付時の注意
光の影響を防ぐために、薬剤バイアルは外箱に入れ遮光した状態で保管すること。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与により、赤色の着色尿があらわれることがある。[本剤及び代謝物の尿中排泄による。]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人男子にメコバラミン25mg注)及び50mgを単回筋肉内投与したときの血漿中濃度推移及び薬物動態パラメータは下記のとおりである1)。
| 投与量(mg) | 例数 | Cmax(ng/mL) | tmaxa)(hr) | AUC(0-inf)(ng・hr/mL) | t1/2(hr) |
| 25mg注) | 6 | 834±133 | 2.0 0.8、2.0 | 4270±531 | 3.1±1.0 |
| 50mg | 6 | 1660±309 | 1.0 0.8、2.0 | 8450±1070 | 2.8±0.4 |
健康成人に単回筋肉内投与したときの血漿中濃度
16.1.2 反復投与
日本人健康成人男子にメコバラミン25mg注)及び50mgを1日1回7日間筋肉内投与したときの7日目の薬物動態パラメータは下記のとおりである2)。
| 投与量(mg/日) | 例数 | Cmax(ng/mL) | tmaxa)(hr) | AUC(0-24hr)(ng・hr/mL) | t1/2(hr) |
| 25mg注) | 6 | 934±196 | 1.0 0.8、2.0 | 4320±519 | 2.6±0.6 |
| 50mg | 6 | 1580±257 | 1.0 0.8、2.0 | 8840±653 | 2.8±0.3 |
16.3 分布
メコバラミン(30〜3000ng/mL)のヒト血漿タンパク結合率は、25.0〜35.8%であった3)(in vitro)。
16.4 代謝
メコバラミンはほとんど代謝されない。
16.5 排泄
メコバラミンは主に未変化体として尿中に排泄される。日本人健康成人男子にメコバラミン25〜75mg注)を単回筋肉内投与したとき、投与後72時間までの尿中未変化体総排泄量は、投与量の93%以上であった1)。
注)本剤の承認された用法及び用量は、「通常、成人には、メコバラミンとして50mgを1日1回、週2回、筋肉内に注射する。」である。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
ALS患者8例の腎機能を血清中シスタチンC濃度で補正した糸球体濾過量によって、正常(≧90mL/min/1.73m2)、軽度腎機能障害(60〜89mL/min/1.73m2)及び中等度腎機能障害(30〜59mL/min/1.73m2)に分類した。メコバラミン50mgを1日1回、週2回筋肉内投与を長期継続した際の薬物動態パラメータは下記のとおりである4)。
| 正常(1例) | 軽度(4例) | 中等度(3例) | |
| 投与量(mg) | 50 | 50 | 50 |
| Cmax(ng/mL) | 1440 | 1830±616 | 2160±879 |
| tmaxa)(hr) | 2.0 | 1.5 0.5、2.0 | 2.0 1.0、4.0 |
| AUC(0-8hr)(ng・hr/mL) | 6780 | 8290±3170 | 10600±1930 |
| t1/2(hr) | 2.71 | 2.91±0.568 | 3.25b) |
| CL/F(L/hr) | 6.21 | 5.45±1.68 | 4.42b) |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(国内763試験:治療期)
ALS患者(罹病期間1年以内で、Updated Awaji基準において、definite、probable、probable-laboratory supportedに該当し、ALS重症度基準1度又は2度、投与前12週間で改訂ALS機能評価尺度(ALSFRS-R)合計点数が1点又は2点低下し、努力性肺活量(%FVC)が60%を超える)130例を対象に、メコバラミン50mg又はプラセボを週2回、16週間筋肉内投与する二重盲検比較試験を実施した。
主要評価項目である観察期終了時から治療期16週時のALSFRS-R合計点数の変化量は下表のとおりであり、メコバラミン50mgのプラセボに対する優越性が検証された。
副作用の発現頻度はプラセボ群で1.6%(1/64例)、メコバラミン50mg群で7.7%(5/65例)であった。メコバラミン50mg群で認められた副作用は、便秘、注射部位疼痛、発熱、心電図QT延長及び発疹が各1.5%(1/65例)であった5)。[5.参照]
主要評価項目である観察期終了時から治療期16週時のALSFRS-R合計点数の変化量は下表のとおりであり、メコバラミン50mgのプラセボに対する優越性が検証された。
副作用の発現頻度はプラセボ群で1.6%(1/64例)、メコバラミン50mg群で7.7%(5/65例)であった。メコバラミン50mg群で認められた副作用は、便秘、注射部位疼痛、発熱、心電図QT延長及び発疹が各1.5%(1/65例)であった5)。[5.参照]
| 投与群 | 観察期終了時ALSFRS-R合計点数a) | 16週時ALSFRS-R合計点数a) | 観察期終了時から16週時の変化量 [95%信頼区間]b) | 観察期終了時から16週時の変化量の群間差 [95%信頼区間]b) | p値c) |
| プラセボ群 | 42.3±2.7 (64例) | 37.5±5.9 (63例) | −4.6 [−5.8,−3.4] | / | / |
| 本剤50mg群 | 42.4±2.6 (65例) | 39.3±4.5 (63例) | −2.7 [−3.9,−1.5] | 2.0 [0.4,3.5] | 0.012 |
17.1.2 国内第III相試験(国内763試験:治療期及び継続投与期)
国内763試験治療期を完了し、継続投与期に移行した症例を対象にメコバラミン50mgを週2回筋肉内投与した。全期間(治療期及び継続投与期(2022年6月28日データカットオフ))におけるALSFRS-R合計点数の推移は下表のとおりであった。全期間における本剤投与例の副作用発現率は7.9%(10/126例)であった。2例以上に認められた副作用はなかった。
| 投与群 | 評価時期a) | 16週 | 40週 | 64週 | 112週 | 160週 | 208週 |
| 治療期 プラセボ群 | 例数 | 63 | 48 | 34 | 17 | 7 | 2 |
| 実測値b) | 37.5±5.9 | 32.1±8.5 | 29.4±9.0 | 26.3±10.7 | 24.3±10.3 | 11.5±0.7 | |
| 治療期 50mg群 | 例数 | 63 | 54 | 39 | 26 | 14 | 5 |
| 実測値b) | 39.3±4.5 | 34.1±8.1 | 31.7±9.6 | 28.3±10.6 | 24.8±10.9 | 20.4±14.0 |
18. 薬効薬理
18.1 作用機序
18.2 ALSモデル動物における効果
18.3 神経細胞保護効果
19. 有効成分に関する理化学的知見
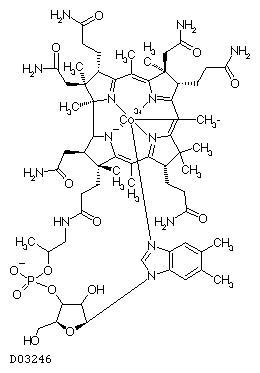
19.1. メコバラミン
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
8バイアル
23. 主要文献
- 社内資料:日本人及び白人健康成人を対象とした用量漸増単回投与試験(2024年9月24日承認、CTD2.7.2.2.2.1)
- 社内資料:日本人及び白人健康成人を対象とした用量漸増反復投与試験(2024年9月24日承認、CTD2.7.2.2.2.2)
- 社内資料:血漿タンパク結合率(2024年9月24日承認、CTD2.7.2.2.1)
- 社内資料:ALS患者を対象とした763試験の継続投与期のサブスタディ(2024年9月24日承認、CTD2.7.2.2.2.3)
- Oki R.et al., JAMA Neurol., 79 (6), 575-583, (2022)
- Kikuchi M.et al., Invest.Ophthalmol.Vis.Sci., 38 (5), 848-854, (1997)
- Akaike A.et al., Eur.J.Pharmacol., 241 (1), 1-6, (1993)
- Hemendinger R.A.et al., Toxicol.Appl.Pharmacol., 251 (3), 217-225, (2011)
- Ikeda K.et al., J.Neurol.Sci., 354 (1-2), 70-74, (2015)
- 社内資料:ALSモデル動物G93A変異SOD1 Tgマウスにおける延命効果(2024年9月24日承認、CTD2.6.2.2.7)
- 社内資料:酸化ストレスによる運動神経突起傷害に対する抑制効果(2024年9月24日承認、CTD2.6.2.2.1)
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売元
エーザイ株式会社
東京都文京区小石川4-6-10