医薬品情報
| 総称名 | ヒドロキシクロロキン硫酸塩 |
|---|---|
| 一般名 | ヒドロキシクロロキン硫酸塩 |
| 欧文一般名 | Hydroxychloroquine Sulfate |
| 製剤名 | ヒドロキシクロロキン硫酸塩錠 |
| 薬効分類名 | 免疫調整剤 |
| 薬効分類番号 | 3999 |
| KEGG DRUG |
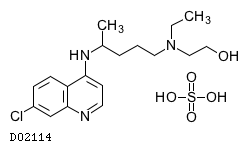
D02114
ヒドロキシクロロキン硫酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ヒドロキシクロロキン硫酸塩錠200mg「DSEP」 (後発品) | HYDROXYCHLOROQUINE SULFATE TABLETS「DSEP」 | 第一三共エスファ | 3999038F1037 | 143.6円/錠 | 毒薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<皮膚エリテマトーデス>
5.1 限局的な皮膚症状のみを有する皮膚エリテマトーデス患者に対して、本剤は、ステロイド等の外用剤が効果不十分な場合又は外用剤の使用が適切でない皮膚状態にある場合に投与を考慮すること。
<全身性エリテマトーデス>
5.2 全身性エリテマトーデス患者に対して、本剤は、皮膚症状、倦怠感等の全身症状、筋骨格系症状等がある場合に投与を考慮すること。
6. 用法及び用量
通常、ヒドロキシクロロキン硫酸塩として200mg又は400mgを1日1回食後に経口投与する。
ただし、1日の投与量はブローカ式桂変法により求められる以下の理想体重に基づく用量とする。
ただし、1日の投与量はブローカ式桂変法により求められる以下の理想体重に基づく用量とする。
女性患者の理想体重(kg)=(身長(cm)−100)×0.85
男性患者の理想体重(kg)=(身長(cm)−100)×0.9
・理想体重が31kg以上46kg未満の場合、1日1回1錠(200mg)を経口投与する。
・理想体重が46kg以上62kg未満の場合、1日1回1錠(200mg)と1日1回2錠(400mg)を1日おきに経口投与する。
・理想体重が62kg以上の場合、1日1回2錠(400mg)を経口投与する。
7. 用法及び用量に関連する注意
7.1 本剤投与後の脂肪組織中濃度は低いことから、実体重に基づき本剤を投与した場合、特に肥満患者では過量投与となり、網膜障害等の副作用発現リスクが高まる可能性があるため、実体重ではなく、身長に基づき算出される理想体重(下表)に基づき投与量を決定すること。[1.2、8.1、11.1.1参照]
身長(理想体重)と1回投与量の関係
女性患者の場合
| 身長 (理想体重) | 1回投与量 |
| 136cm以上154cm未満 (理想体重31kg以上46kg未満) | 1錠(200mg) |
| 154cm以上173cm未満 (理想体重46kg以上62kg未満) | 1錠(200mg)と2錠(400mg)を1日おき |
| 173cm以上 (理想体重62kg以上) | 2錠(400mg) |
男性患者の場合
| 身長 (理想体重) | 1回投与量 |
| 134cm以上151cm未満 (理想体重31kg以上46kg未満) | 1錠(200mg) |
| 151cm以上169cm未満 (理想体重46kg以上62kg未満) | 1錠(200mg)と2錠(400mg)を1日おき |
| 169cm以上 (理想体重62kg以上) | 2錠(400mg) |
8. 重要な基本的注意
8.1 本剤の投与に際しては、事前に両眼の視力、中心視野、色覚等を、視力検査、細隙灯顕微鏡検査、眼圧検査、眼底検査(眼底カメラ撮影、OCT(光干渉断層計)検査を含む)、視野テスト、色覚検査の眼科検査により慎重に観察すること。本剤の投与により、眼障害があらわれることがあるので、定期的に眼科検査を行うこと。長期にわたって投与する場合には、少なくとも年に1回これらの眼科検査を実施すること。また、以下の患者に対しては、より頻回に検査を実施すること。[1.2、7.1、8.2、9.1.6、9.1.7、9.2、9.3、9.8、11.1.1参照]
・累積投与量が200gを超えた患者
・肝機能障害患者又は腎機能障害患者
・視力障害のある患者
・高齢者
8.2 視野異常等の機能的な異常は伴わないが、眼科検査(OCT検査等)で異常が認められる患者に対しては、より頻回に眼科検査を実施するとともに、投与継続の可否を慎重に判断すること。[8.1、11.1.1参照]
8.3 視力低下や色覚異常等の視覚障害が認められた場合は、直ちに投与を中止すること。網膜の変化や視覚障害は投与中止後も進行する場合があるので、投与を中止した後も注意深く観察すること。[11.1.1参照]
8.6 長期投与する場合には定期的に患者の血液学的検査を行うこと。[11.1.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 キニーネに過敏症を有する患者
皮膚反応のリスクが高くなることがある。
9.1.2 グルコース-6-リン酸脱水素酵素欠損症のある患者
溶血を起こすおそれがある。
9.1.3 ポルフィリン症の患者
症状が増悪することがある。
9.1.4 乾癬の患者
皮膚症状が増悪することがある。
9.1.5 胃腸障害、神経系障害、血液障害のある患者
これらの症状が増悪することがある。
9.1.6 SLE網膜症を有する患者
9.1.7 眼障害のリスク因子を有する患者[8.1参照]
9.2 腎機能障害患者
9.3 肝機能障害患者
9.4 生殖能を有する者
妊娠可能な女性に対しては、催奇形性・胎児毒性のリスクを有する可能性があること、及びそのために避妊を行うことが望ましいことを十分に説明し理解を得た上で投与すること。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、催奇形性・胎児毒性のリスクを有する可能性があることを十分に説明し理解を得た上で、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤と化学構造及び薬理学的作用が類似しているクロロキンでは、生殖発生毒性が示唆されており、本剤においても催奇形性・胎児毒性(出生児の発育遅延等)が発現する可能性は否定できない。また、分布試験において、妊娠有色マウスにクロロキンの標識体を静脈内投与したとき、クロロキンは胎盤を速やかに通過し、マウス胎児の網膜に選択的に放射能が認められた。また、放射能は5ヵ月間残存した。[9.4参照]
9.6 授乳婦
授乳を避けさせること。ヒドロキシクロロキンはヒト乳汁中へ移行することが報告されている。4-アミノキノリン化合物の毒性作用は乳児に対して極めて感受性が高いことが知られている。
9.7 小児等
9.8 高齢者
10. 相互作用
10.2 併用注意
| ジゴキシン | 本剤との併用により、ジゴキシンの血中濃度を上昇させるとの報告がある。併用する場合には血中ジゴキシン濃度をモニターするなど慎重に投与すること。 | in vitro試験で本剤のP糖蛋白阻害作用が報告されている。 |
| シクロスポリン | 本剤との併用により、シクロスポリンの血中濃度が上昇したとの報告がある。 | in vitro試験で本剤のP糖蛋白阻害作用が報告されている。 |
| インスリン 糖尿病用薬 [8.4参照] | 本剤との併用により、これらの糖尿病用薬の血糖降下作用が強くあらわれる可能性があるため、必要に応じインスリン又は糖尿病用薬の投与量の減量を考慮すること。 | 糖尿病用薬の併用の有無を問わず、本剤の投与により重度の低血糖を起こすことがある。 |
| QT延長を起こすことが知られている薬剤 アミオダロン モキシフロキサシン等 | 心室性不整脈のリスクが増大するおそれがある。 | 共にQT延長を引き起こすおそれがあるため。 |
| シメチジン | 併用により本剤の血中濃度が上昇するおそれがある。 | 本剤と類似の構造を有するクロロキンと、CYP2C8、CYP3A4等のCYP分子種の阻害作用を有するシメチジンを併用したとき、クロロキンの血中濃度が2倍になったとの報告がある。 |
| 抗マラリア薬 メフロキン等 | 痙攣閾値を低下させる抗マラリア薬を併用すると痙攣のリスクが上昇することがある。 | 本剤は痙攣閾値を低下させるとの報告がある。 |
| 抗てんかん薬 フェニトイン カルバマゼピン等 | 本剤との併用により、抗てんかん薬の作用が減弱する可能性がある。 | 機序不明 |
| プラジカンテル | 本剤と類似の構造を有するクロロキンとの併用により、プラジカンテルの生物学的利用率が低下するとの報告がある。このため、本剤との併用においても同様にプラジカンテルの生物学的利用率を低下させる可能性がある。 | 機序不明 |
| アガルシダーゼ | 本剤との併用により、α-ガラクトシダーゼの作用が減弱する可能性がある。 | 機序不明 |
| タモキシフェン ビガバトリン | 併用により網膜障害のリスクが増大するおそれがある。 | 共に網膜障害を引き起こす可能性があるため。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 眼障害(網膜症、黄斑症、黄斑変性)(いずれも頻度不明)
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(5%未満)、多形紅斑(頻度不明)、紅皮症(剥脱性皮膚炎)(頻度不明)、薬剤性過敏症症候群(頻度不明)、急性汎発性発疹性膿疱症(頻度不明)、急性熱性好中球性皮膚症(Sweet症候群)(頻度不明)
11.1.3 骨髄抑制(血小板減少症、無顆粒球症、白血球減少症、再生不良性貧血)(いずれも頻度不明)
血小板減少症、無顆粒球症、白血球減少症、再生不良性貧血等があらわれることがある。[8.6参照]
11.1.4 心筋症(頻度不明)
心不全に至り、致死的転帰をたどる心筋症があらわれることがある。[8.8参照]
11.1.5 ミオパチー、ニューロミオパチー(いずれも頻度不明)
11.1.6 低血糖(頻度不明)
11.1.7 QT延長、心室頻拍(Torsade de pointesを含む)(いずれも頻度不明)
11.1.8 肝機能障害(頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害があらわれることがある。
注)発現頻度は使用成績調査を含む
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 消化器 | 下痢 | 腹痛、便秘、胃腸炎、口唇炎、鼓腸、胃食道逆流性疾患 | 嘔吐、嘔気 |
| 精神障害 | 感情不安定、神経過敏、精神症状 | ||
| 神経系障害 | 頭痛、神経痛、傾眠、肋間神経痛 | 浮動性めまい、痙攣、ジストニア・ジスキネジア・振戦等の錐体外路障害 | |
| 眼 | 網脈絡膜萎縮、硝子体浮遊物、結膜炎、眼乾燥 | 視野欠損、網膜色素沈着、色覚異常、角膜浮腫、角膜混濁、霧視、光輪視、羞明 | |
| 過敏症 | 蕁麻疹、発疹、全身性皮疹、そう痒症 | 血管浮腫、気管支痙攣、光線過敏症 | |
| 皮膚 | 中毒性皮疹、薬疹、色素沈着障害、皮膚潰瘍、帯状疱疹、爪囲炎 | 毛髪の変色、脱毛症 | |
| 呼吸器 | 気管支炎、口腔咽頭痛 | ||
| 循環器 | 伝導障害、脚ブロック、房室ブロック、心室肥大 | ||
| 筋・骨格系 | 腱反射減退、感覚運動障害、神経伝導検査異常 | ||
| 代謝 | 食欲減退 | ||
| 腎臓 | 蛋白尿、血尿 | ||
| 肝臓 | 肝機能検査異常 | ||
| その他 | 発熱、腎盂腎炎、蜂巣炎、限局性感染 | 回転性めまい、耳鳴、難聴 |
13. 過量投与
13.1 症状
13.2 処置
胃洗浄後、過量投与から30分以内に胃管で投与量の最低5倍の活性炭を投与すれば、それ以上の吸収を妨げる可能性がある。心毒性の緩和にはジアゼパムが有効であるとの報告があることから、ジアゼパムの非経口投与を検討すること。
必要に応じ、呼吸補助及びショック対処法を実施すること。
必要に応じ、呼吸補助及びショック対処法を実施すること。
14. 適用上の注意
14.1 薬剤交付時の注意
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤との因果関係は不明であるが、海外において本剤服用患者で自殺行動が報告されている。
15.1.2 本剤のがん原性試験は実施されていない。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
外国人健康成人5例にヒドロキシクロロキン155mg注)を単回経口投与したとき、終末相の消失半減期は全血及び血漿で、それぞれ約50日及び32日であった1)。
注)本剤の承認された用法及び用量は通常、ヒドロキシクロロキン硫酸塩として200mg又は400mgを1日1回食後に経口投与である。
16.1.2 反復投与
皮膚エリテマトーデスと診断された日本人患者90例(全身性エリテマトーデスの合併の有無を問わない)にヒドロキシクロロキン硫酸塩錠を1日1回200〜400mg(理想体重当たり6.5mg/kgを超えない)反復経口投与したときの定常状態における全血中ヒドロキシクロロキン濃度を用い、母集団薬物動態解析により求めた薬物動態パラメータを以下に示す2)3)。
| 投与量(mg/day) (理想体重の範囲) | 200mg (31kg以上46kg未満) | 200mgと400mgを1日おき (46kg以上62kg未満) | 400mg (62kg以上) |
| Cmax(μg/mL) | 0.63±0.22 | 0.94±0.19 | 0.85±0.17 |
| Tmax(hr) | 4.0±0.1 | 4.0±0.1 | 4.0±0.1 |
| AUC(μg・hr/mL) | 13.2±5.3 | 16.6±4.8 | 16.5±4.2 |
| Ctrough(μg/mL) | 0.46±0.22 | 0.50±0.19 | 0.52±0.17 |
| t1/2(hr) | 41.4±16.6 | 34.7±10.0 | 25.9±6.6 |
| CL/F(L/hr) | 17.5±7.9 | 19.8±6.9 | 25.6±6.1 |
16.2 吸収
16.2.1 バイオアベイラビリティ
16.2.2 食事の影響
健康成人にヒドロキシクロロキンを空腹時及び食後に単回経口投与したとき、全血中ヒドロキシクロロキンのCmaxはそれぞれ223.5及び214.4ng/mL、絶対的バイオアベイラビリティはそれぞれ0.67及び0.64であった5)(外国人データ)。
16.3 分布
健康成人におけるヒドロキシクロロキンのヒト血漿タンパク結合率及びヒト血清アルブミン結合率はそれぞれ、約52%及び約40%であった6)(外国人データ)。
16.4 代謝
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
活動性皮膚病変を有する皮膚エリテマトーデス患者(全身性エリテマトーデスの合併の有無を問わない)103例を対象に、ステロイド剤併用又は非併用下で、理想体重46kg未満の患者はヒドロキシクロロキン硫酸塩錠200mgを毎日、理想体重46kg以上62kg未満の患者はヒドロキシクロロキン硫酸塩錠200mgとヒドロキシクロロキン硫酸塩錠400mgを隔日、理想体重62kg以上の患者はヒドロキシクロロキン硫酸塩錠400mgを毎日、1日1回経口投与したときの有効性及び安全性を検討することを目的とした国内多施設共同第III相試験を実施した。ヒドロキシクロロキン硫酸塩錠投与後16週時点で得られた皮膚症状に対する有効性及び全身性エリテマトーデス患者での症状及び筋骨格系症状に対する有効性はそれぞれ下表のとおりであった。
| ヒドロキシクロロキン硫酸塩錠群 (n=72) | プラセボ群 (n=24) | |
| ベースライン | 13.5±8.0 | 13.6±7.5 |
| 投与16週後 | 8.9±6.0 | 10.4±7.3 |
| ベースラインからの変化量 [95%信頼区間] | −4.6±6.4 [−6.1,−3.1] | −3.2±4.5 [−5.1,−1.3] |
| プラセボ群との差 [95%信頼区間] | −1.6※ [−4.29,1.11] | / |
| RAPID3合計スコア | 倦怠感VASスコア | |||
| ヒドロキシクロロキン硫酸塩錠群 (n=42) | プラセボ群 (n=12) | ヒドロキシクロロキン硫酸塩錠群 (n=42) | プラセボ群 (n=12) | |
| ベースライン | 7.14±4.37 | 7.93±5.30 | 4.07±2.24 | 4.63±2.59 |
| 投与16週後 | 5.47±4.07 | 8.11±6.88 | 2.96±2.31 | 3.92±3.27 |
| ベースラインからの変化量 | −1.67±3.94 | 0.18±4.51 | −1.11±2.48 | −0.71±3.14 |
18. 薬効薬理
18.1 作用機序
ヒドロキシクロロキンの皮膚エリテマトーデス、全身性エリテマトーデスに対する薬効には、主にリソソーム内へのヒドロキシクロロキンの蓄積によるpHの変化とそれに伴うリソソーム内の種々の機能の抑制が関与しているものと推察される12)。
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. ヒドロキシクロロキン硫酸塩
22. 包装
(PTP)
84錠(14錠×6)
23. 主要文献
- Tett SE,et al., Br J Clin Pharmacol., 27 (6), 771-779, (1989) »PubMed
- 国内第III相試験(プラケニル錠:2015年7月3日承認、CTD2.7.6)
- 国内第III相試験(EFC12368試験)における母集団薬物動態成績(プラケニル錠:2015年7月3日承認、CTD2.7.2.2)
- Tett SE,et al., J Pharm Sci., 81 (2), 155-159, (1992) »PubMed
- McLachlan AJ,et al., Br J Clin Pharmacol., 36 (5), 405-411, (1993) »PubMed
- McLachlan AJ,et al., Eur J Clin Pharmacol., 44 (5), 481-484, (1993) »PubMed
- 推定代謝経路(プラケニル錠:2015年7月3日承認、CTD2.6.4.5.1)
- ヒドロキシクロロキンとクロロキンの類似点及び相違点(プラケニル錠:2015年7月3日承認、CTD2.6.4.9)
- Tett SE,et al., Br J Clin Pharmacol., 26 (3), 303-313, (1988) »PubMed
- HCQ群とPlacebo群との群間比較(プラケニル錠:2015年7月3日承認、CTD2.7.3.3.2.1.1.2.3)
- 症例数の考察(プラケニル錠:2015年7月3日承認、CTD2.7.3.1.3.3.4)
- リソソームへの蓄積(プラケニル錠:2015年7月3日承認、CTD2.6.2.2.1.1)
- Shimomatsu T,et al., J Invest Dermatol., 133, S34, (2013)
- Gomez-Guzman M,et al., Hypertension, 64 (2), 330-337, (2014) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
第一三共エスファ株式会社
お客様相談室
〒103-0027
東京都中央区日本橋2-13-12
電話:0120-100-601
製品情報問い合わせ先
第一三共エスファ株式会社
お客様相談室
〒103-0027
東京都中央区日本橋2-13-12
電話:0120-100-601
26. 製造販売業者等
26.1 製造販売元
第一三共エスファ株式会社
東京都中央区日本橋本町3-5-1
26.2 販売提携
第一三共株式会社
東京都中央区日本橋本町3-5-1