医薬品情報
| 総称名 | リジュセア |
|---|---|
| 一般名 | アトロピン硫酸塩水和物 |
| 欧文一般名 | Atropine Sulfate Hydrate |
| 製剤名 | アトロピン硫酸塩点眼液 |
| 薬効分類名 | 近視進行抑制点眼剤 |
| 薬効分類番号 | 1319 |
| KEGG DRUG |
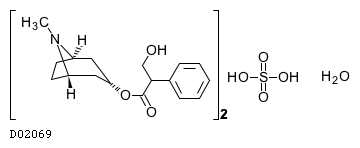
D02069
アトロピン硫酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年12月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リジュセアミニ点眼液0.025% | RYJUSEA Mini ophthalmic solution | 参天製薬 | 131970BQ1026 | 劇薬 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 緑内障及び狭隅角や前房が浅いなどの眼圧上昇の素因のある患者[急性閉塞隅角緑内障の発作を起こすおそれがある。]
4. 効能または効果
5. 効能または効果に関連する注意
5.1 適切な調節の低減下で近視と診断された患者に投与すること(調節緊張により偽近視を呈していることがある)。また弱視等の治療を優先すべき他の眼科疾患を合併していないことを確認すること。
5.2 「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(年齢、近視の状態等)を十分に理解した上で、適応患者を選択すること。[17.1.1参照]
6. 用法及び用量
通常、1回1滴、1日1回就寝前に点眼する。
7. 用法及び用量に関連する注意
定期的に検査を行い近視の進行状況を確認すること。本剤の使用により効果が認められない場合には、漫然と投与を継続しないこと。
8. 重要な基本的注意
8.1 本剤の点眼後、散瞳の影響により羞明、霧視があらわれることがあるため、その症状が回復するまでは落下の恐れがある遊具の使用、自転車・自動車等の運転、機械類の操作は避けるよう注意すること。また、必要に応じてサングラスを着用する等、太陽光や強い光を直接見ないよう指導すること。
9. 特定の背景を有する患者に関する注意
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
低出生体重児、新生児、乳児、5歳未満の幼児を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| 抗コリン作用を有する薬剤 (三環系及び四環系抗うつ剤、フェノチアジン系薬剤、抗ヒスタミン剤等) | 循環器系、精神神経系等の全身性の副作用があらわれるおそれがある。 | 相加的に作用(抗コリン作用)を増強させる。 |
11. 副作用
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | |
| 眼 | 羞明 | 視力障害、霧視、瞳孔障害 | 調節障害、眼瞼湿疹、グレア |
| 精神神経系 | 頭痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・開封時の容器破片除去のため、使用の際は、最初の1〜2滴は点眼せずに捨てること。
・点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜のう内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・保存剤を含有しないため、開封後は1回きりの使用とし、残液は廃棄すること。
・遮光して保存すること。
16. 薬物動態
16.1 血中濃度
本剤を5歳以上15歳以下の男女の近視患者10例の両眼に1回1滴、1日1回7日間反復点眼したときの薬物動態パラメータは表1のとおりであった1)。
| 測定日 | 例数 | Cmax(pg/mL) | tmax(min)a) | AUC0-60min(pg・min/mL) |
| 1日目 | 10 | 19.7±7.0 | 60(5.0,60) | 939±370 |
| 7日目 | 10 | 16.5±3.6 | 60(30,60) | 798±188 |
16.3 分布
白色ウサギの両眼に2%3H-アトロピン溶液を単回点眼したとき、いずれの眼組織においても3H濃度は点眼後1時間が最も高く、その後経時的に減少した。組織中3H濃度は角膜が最も高く、続いて、強膜、虹彩毛様体、房水、脈絡膜、網膜、硝子体の順であった2)。
白色ウサギ及び有色ウサギの両眼に2%3H-アトロピン溶液を単回点眼したとき、点眼後96時間の有色ウサギの虹彩中3H濃度は白色ウサギに比べ約8倍高かったことから、アトロピンはメラニンに結合することが示唆された3)。
16.4 代謝
アトロピンは、N-脱メチル化によりノルアトロピンに、一酸化反応によりアトロピン-N-オキシドに、加水分解によりトロピン及びトロパ酸に代謝される4)(外国人データ)。
16.5 排泄
健康成人男性に14C-アトロピン2mgを筋肉内投与したとき、投与48時間後までに投与された14Cの88%が尿中に排泄され、このうち投与量の約50%がアトロピンとして、2%未満がトロパ酸として尿中に排泄された。投与された14Cは呼気中には認められず、糞中にわずかな量(投与量の0.5%未満)が認められた4)(外国人データ)。
16.7 薬物相互作用
アトロピンはヒト有機カチオントランスポーター2(OCT2)の基質である5)(in vitro)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相試験
5歳〜15歳の調節麻痺下における他覚的等価球面度数が−1.0D〜−6.0Dで、目安として1年以内に等価球面度数が0.5D以上近視の進行が認められた近視患者299例(有効性解析対象299例)を対象とした、無作為化二重遮蔽並行群間比較試験において、本剤、0.01%注)、プラセボ点眼液を1回1滴、1日1回(就寝前)、36ヵ月(治療I期:24ヵ月+治療II期:12ヵ月)点眼した。
主要評価項目である投与24ヵ月後における投与前からの調節麻痺下の他覚的等価球面度数の変化量について、本剤群はプラセボ点眼液群と比較して統計学的に有意な差が認められ、優越性が検証された(表2)。投与36ヵ月後までの投与前からの調節麻痺下の他覚的等価球面度数の変化量の推移は図1のとおりであった。
副作用は、本剤群122例中19例(15.6%)に認められ、主な副作用は羞明9.0%(11/122例)であった6)。
主要評価項目である投与24ヵ月後における投与前からの調節麻痺下の他覚的等価球面度数の変化量について、本剤群はプラセボ点眼液群と比較して統計学的に有意な差が認められ、優越性が検証された(表2)。投与36ヵ月後までの投与前からの調節麻痺下の他覚的等価球面度数の変化量の推移は図1のとおりであった。
副作用は、本剤群122例中19例(15.6%)に認められ、主な副作用は羞明9.0%(11/122例)であった6)。
注)本剤が承認されている濃度は0.025%である。
| 本剤 (101例) | プラセボ (99例) | |
| 投与前からの変化量a) (投与24ヵ月後) | −1.006±0.0606 | −1.643±0.0602 |
| 群間差[95%信頼区間] (本剤−プラセボ群) p値 | 0.637[0.469,0.805] p<0.0001 | |
図1.投与前からの他覚的等価球面度数の変化量(D)の推移(平均値±標準誤差)
18. 薬効薬理
18.1 作用機序
アトロピンは、網膜又は強膜に存在するムスカリン受容体を介して直接的又は間接的に強膜のリモデリングに関与することで眼軸の伸長を抑制すると考えられている7)。
18.1.1 ムスカリン受容体に対する親和性
ムスカリン受容体のサブタイプであるM1、M2、M3、M4及びM5に対して非選択的に親和性を示す8)(in vitro)。
18.2 近視の進行抑制作用
19. 有効成分に関する理化学的知見
19.1. アトロピン硫酸塩水和物
20. 取扱い上の注意
アルミピロー包装開封後は、添付の遮光用投薬袋に入れて室温で保存し、3ヵ月以内に使用すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
プラスチック点眼容器 0.3mL×30本(アルミピロー1袋30本入り)
23. 主要文献
- 社内資料:第I相試験(012703LT)
- Tigges M,et al., Optom Vis Sci., 76, 397-407, (1999) »PubMed
- Salazar M,et al., Invest Ophthalmol., 15, 671-673, (1976) »PubMed
- Gosselin RE,et al., Clin Pharmacol Ther., 1, 597-603, (1960)
- Chen J,et al., Biol Chem., 398, 237-249, (2017) »PubMed
- 社内資料:第II/III相試験(012702LT)
- Upadhyay A,et al., Eye Contact Lens., 46, 129-135, (2020) »PubMed
- Moriya H,et al., Life Sciences., 64, 2351-2358, (1999) »PubMed
- McBrien NA,et al., Invest Ophthalmol Vis Sci., 34, 205-215, (1993) »PubMed
- McKanna JA,et al., Doc Ophthal Proc Series., 28, 187-192, (1981)
- Barathi VA,et al., J Proteome Res., 13, 4647-4658, (2014) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
製品情報問い合わせ先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
25. 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
参天製薬株式会社
大阪市北区大深町4-20
その他の説明
リジュセアミニ点眼液0.025%の使用方法
1)1回分(1本分)の容器を切り離してください。
2)図の様に薬液が入っていない部分を持ち、容器の先端をねじって、取り外してください。
3)点眼する前に、1〜2滴捨ててください。
4)下まぶたを軽く下にひき、まぶたやまつ毛、目に触れないように点眼してください。
両眼に点眼する必要がある場合は、そのままもう片眼に点眼してください。
両眼に点眼する必要がある場合は、そのままもう片眼に点眼してください。