医薬品情報
| 総称名 | テポックス |
|---|---|
| 一般名 | テコビリマト水和物 |
| 欧文一般名 | Tecovirimat Hydrate |
| 製剤名 | テコビリマト水和物カプセル |
| 薬効分類名 | 抗ウイルス剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AX24 |
| KEGG DRUG |
D11557
テコビリマト水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年5月 作成(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| テポックスカプセル200mg | TEPOXX Capsules 200mg | 日本バイオテクノファーマ | 625005YM1020 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
<効能共通>
5.1 痘そう、エムポックス、牛痘又は痘そうワクチン接種後のワクチニアウイルスの増殖による合併症の患者を対象にテコビリマトの有効性及び安全性を評価する臨床試験は実施していない。
5.2 本剤の有効性及び安全性に関する情報を十分に理解した上で、最新のガイドライン等も参照の上、治療上の有益性が危険性を上回ると判断される場合のみ投与すること。
<エムポックス>
5.3 最新のガイドライン等も参照の上、本剤は、重症例及び重症化ハイリスク例に対して投与を検討すること。
6. 用法及び用量
通常、成人及び小児には、以下の用法及び用量で14日間、食後に経口投与する。
体重13kg以上25kg未満
テコビリマトとして200mgを1日2回12時間毎
体重25kg以上40kg未満
テコビリマトとして400mgを1日2回12時間毎
体重40kg以上120kg未満
テコビリマトとして600mgを1日2回12時間毎
体重120kg以上
テコビリマトとして600mgを1日3回8時間毎
7. 用法及び用量に関連する注意
症状の発現後速やかに投与を開始すること。[18.3.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 免疫不全患者及び免疫抑制状態の患者
期待する効果が得られないおそれがある。ワクチニアウイルス感染動物において、本剤投与中又は投与後の免疫応答が病態の回復に重要であることが示唆されている。1)
9.2 腎機能障害患者
9.2.1 末期腎不全患者
テコビリマト代謝物の血漿中濃度が上昇するおそれがある。末期腎不全患者を対象に本剤を反復投与したときの安全性を評価する臨床試験は実施していない。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 重度肝機能障害患者
テコビリマト代謝物の血漿中濃度が上昇するおそれがある。
重度肝機能障害患者(Child-Pugh分類クラスC)を対象に本剤を反復投与したときの安全性を評価する臨床試験は実施していない。[16.6.2参照]
重度肝機能障害患者(Child-Pugh分類クラスC)を対象に本剤を反復投与したときの安全性を評価する臨床試験は実施していない。[16.6.2参照]
9.5 妊婦
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(マウス)で胎盤への移行が報告されている。また、動物実験(ウサギ)において、臨床曝露量未満で一般状態悪化に伴う母動物の死亡、早産、着床後胚損失数及び早期胚吸収数増加、並びに生存胎児数減少が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のヒト乳汁中への移行は不明であるが、動物実験(マウス)では乳汁中にテコビリマトが認められた。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は、チトクロームP450(CYP)3A4及びCYP2B6の弱い誘導剤であり、CYP2C8及びCYP2C19の弱い阻害剤である。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2B6
薬物代謝酵素用語
CYP2C8
薬物代謝酵素用語
CYP2C19
10.2 併用注意
| CYP3A4で代謝される薬剤 ミダゾラム リルピビリン マラビロク アトルバスタチン タクロリムス シルデナフィル タダラフィル バルデナフィル ダルナビル [16.7.2参照] | これらの薬剤の血漿中濃度が低下し、効果が減弱するおそれがある。 | 本剤はCYP3A4を誘導する。 |
| メサドン [16.7.2参照] | メサドンの血漿中濃度が低下し、効果が減弱するおそれがある。 | 本剤はCYP2B6を誘導する。 |
| レパグリニド [16.7.2参照] | レパグリニドの血漿中濃度が上昇する可能性があるため、併用する場合は、低血糖症状等の副作用の発現に十分に注意すること。 | 本剤はCYP2C8を阻害する。 |
| CYP2C19で代謝される薬剤 オメプラゾール ランソプラゾール ラベプラゾール ボリコナゾール [16.7.2参照] | これらの薬剤の血漿中濃度が上昇するおそれがあることから、併用する場合はこれらの薬剤の副作用発現に十分に注意すること。 | 本剤はCYP2C19を阻害する。 |
| 乾燥細胞培養痘そうワクチン | 乾燥細胞培養痘そうワクチンの効果が減弱するおそれがある。 | 本剤の抗ワクチニアウイルス作用により、ワクチンに対する免疫応答が低下するおそれがある。 |
11. 副作用
11.2 その他の副作用
| 10%以上 | 1%以上 | 1%未満 | |
| 血液およびリンパ系障害 | ヘマトクリット減少、ヘモグロビン減少、白血球減少症、血小板減少症 | ||
| 代謝および栄養障害 | 食欲減退 | ||
| 肝胆道系障害 | 肝機能検査値上昇 | ||
| 精神障害 | 不安、うつ病、不快気分、易刺激性、パニック発作 | ||
| 神経系障害 | 頭痛 | 浮動性めまい | 注意力障害、味覚不全、脳波異常、不眠症、片頭痛、傾眠、錯感覚 |
| 心臓障害 | 心拍数増加、動悸 | ||
| 呼吸器、胸郭および縦隔障害 | 口腔咽頭痛 | ||
| 胃腸障害 | 上腹部痛、腹部不快感、下痢、悪心、嘔吐 | 腹部膨満、アフタ性潰瘍、口唇のひび割れ、便秘、口内乾燥、消化不良、おくび、鼓腸、胃食道逆流性疾患、排便回数減少、口の錯感覚 | |
| 皮膚および皮下組織障害 | 触知可能紫斑病、全身性そう痒症、発疹、そう痒性皮疹 | ||
| 筋骨格系および結合組織障害 | 関節痛、変形性関節症 | ||
| 一般・全身障害および投与部位の状態 | 悪寒、疲労、びくびく感、倦怠感、疼痛、発熱、口渇 |
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 イヌにおいて、臨床曝露量未満に相当する用量で痙攣、振戦、嘔吐、流涎等の中枢神経系への影響が認められた。
15.2.2 テコビリマト代謝物であるトリフルオロメチル安息香酸(TFMBA)の安全性を特徴付ける非臨床安全性試験は実施していない。
15.2.3 本剤には遺伝毒性を有する不純物が許容摂取量注)を超えて含まれるおそれがある。
注)「潜在的発がんリスクを低減するための医薬品中DNA反応性(変異原性)不純物の評価及び管理ガイドライン」(ICH M7ガイドライン)において示されている許容摂取量
16. 薬物動態
16.1 血中濃度
日本人健康成人(20例)にテコビリマト600mgを1日2回、14日間反復経口投与したときのテコビリマトの薬物動態パラメータは以下のとおりであった。
| 評価時点 | Cmax(μg/mL) | AUC0-12h(μg・h/mL) | Tmax(h) | t1/2(h) |
| 1日目 | 1.73±0.330 | 9.70±1.92 | 4.00[4.00,16.0] | − |
| 14日目 | 1.94±0.515 | 12.6±3.26 | 4.00[0.00,8.00] | 16.4±5.98 |
16.2 吸収
16.2.1 食事の影響
健康成人にテコビリマト600mgを空腹時又は中脂肪食(約600kcal、脂肪25g)摂取後、1日2回14日間反復経口投与したときの、14日目のテコビリマトの薬物動態パラメータは以下のとおりであり、空腹時投与と比較して食後投与時に曝露量は上昇した(外国人データ)。
| 食事条件 | 例数 | Cmax(μg/mL) | AUC0-24h(μg・h/mL) | Tmax(h) |
| 空腹時 | 15 | 1.71±0.768 | 23.5±11.3 | 14.0[1.00,18.0] |
| 中脂肪食摂取後 | 16 | 2.47±0.958 | 32.5±14.2 | 3.92[0.00,18.0] |
16.3 分布
テコビリマトのヒト血漿タンパク結合率は、テコビリマト14C標識体0.03〜50μmol/Lの濃度範囲で77.3〜82.2%であった(in vitro)。健康成人にテコビリマト14C標識体600mgを単回投与したとき、すべての測定時点で全血液中の総放射能濃度は血漿中と比較して低く、血漿中に対する血液中の放射能濃度のAUCinf比は0.435〜0.814であった(外国人データ)。
16.4 代謝
テコビリマトは主に加水分解体であるM4、M5及びTFMBAに代謝される。また、グルクロン酸抱合にはUGT1A1、UGT1A3及びUGT1A4が関与すると考えられる(in vitro)。
16.5 排泄
健康成人(6例)にテコビリマト14C標識体600mgを単回経口投与したとき、投与192時間後までに72.5%が尿中、22.7%が糞中に排泄された。尿中には主にグルクロン酸抱合体が、糞中には主に未変化体が排泄された(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能正常被験者に対する腎機能障害被験者(軽度、中等度、重度又は血液透析を要する末期腎不全)におけるテコビリマト600mg単回経口投与時のテコビリマト及び主要代謝物(M4、M5及びTFMBA)の薬物動態パラメータ比は以下のとおりであった(外国人データ)。[9.2.1参照]
| 腎機能障害の程度/eGFR区分(mL/min/1.73m2) | ||||
| 軽度 60以上90未満 (8例) | 中等度 30以上60未満 (8例) | 重度 30未満 (7例) | 末期腎不全 血液透析後投与 (8例) | |
| テコビリマト | ||||
| Cmax | 1.17[0.87,1.56] | 1.16[0.87,1.55] | 0.66[0.49,0.89] | 0.66[0.48,0.89] |
| AUClast | 1.17[0.85,1.60] | 1.41[1.02,1.93] | 1.07[0.77,1.48] | 0.55[0.39,0.77] |
| M4 | ||||
| Cmax | 1.11[0.83,1.49] | 1.44[1.08,1.94] | 1.02[0.75,1.39] | 1.27[0.93,1.73] |
| AUClast | 1.26[0.89,1.77] | 1.73[1.23,2.44] | 1.63[1.14,2.33] | 2.30[1.63,3.24] |
| M5 | ||||
| Cmax | 1.15[0.85,1.56] | 1.67[1.23,2.27] | 0.98[0.71,1.34] | 1.21[0.87,1.67] |
| AUClast | 1.37[0.97,1.93] | 1.79[1.23,2.62] | 1.35[0.94,1.92] | 1.45[1.00,2.10] |
| TFMBA | ||||
| Cmax | 1.16[0.87,1.54] | 1.30[0.98,1.72] | 0.90[0.67,1.21] | 1.13[0.84,1.53] |
| AUClast | 1.33[0.92,1.93] | 1.49[1.03,2.15] | 1.56[1.06,2.28] | 2.60[1.76,3.85] |
16.6.2 肝機能障害患者
肝機能正常被験者に対する肝機能障害被験者(軽度、中等度又は重度、それぞれChild-Pugh分類クラスA、B又はC)におけるテコビリマト600mg単回経口投与時のテコビリマト及び主要代謝物(M4、M5及びTFMBA)の薬物動態パラメータ比は以下のとおりであった(外国人データ)。[9.3.1参照]
| 肝機能障害の程度 | |||
| 軽度 (8例) | 中等度 (8例) | 重度 (8例) | |
| テコビリマト | |||
| Cmax | 0.81[0.63,1.04] | 1.14[0.89,1.47] | 1.08[0.84,1.39] |
| AUClast | 0.59[0.42,0.84] | 1.09[0.78,1.52] | 0.93[0.65,1.34] |
| M4 | |||
| Cmax | 1.02[0.78,1.34] | 1.49[1.14,1.94] | 1.94[1.46,2.56] |
| AUClast | 0.80[0.57,1.13] | 1.41[1.02,1.96] | 1.99[1.39,2.83] |
| M5 | |||
| Cmax | 1.02[0.78,1.34] | 1.38[1.06,1.81] | 1.84[1.39,2.43] |
| AUClast | 0.98[0.72,1.33] | 1.29[0.95,1.75] | 1.63[1.20,2.21] |
| TFMBA | |||
| Cmax | 1.16[0.88,1.52] | 1.38[1.05,1.81] | 1.45[1.10,1.90] |
| AUClast | 1.10[0.77,1.56] | 1.40[0.98,1.99] | 1.49[1.05,2.12] |
16.7 薬物相互作用
16.7.1 In vitro試験
(1)CYP阻害作用
テコビリマトの主要代謝物M4はCYP2C19(IC50=71.5μmol/L)及びCYP3A(IC50=77μmol/L)の阻害作用を示し、主要代謝物M5及びTFMBAは検討された最高濃度(100μmol/L)でCYP3Aをそれぞれ33.3%及び31.7%阻害した。
(2)CYP誘導作用
テコビリマトはCYP2B6、CYP2C9、CYP2C19及びCYP3A4に対して誘導作用を示した。また、主要代謝物M4及びM5はCYP2B6及びCYP3A4に対する誘導作用を示した。
(3)トランスポーター阻害作用
テコビリマトはBCRP(IC50=6.03μmol/L)に対して阻害作用を示した。
16.7.2 臨床薬物相互作用試験
(1)CYP分子種基質薬
テコビリマト非併用時に対する併用時(600mg1日2回反復経口投与)の各CYP分子種基質薬の薬物動態パラメータ比は以下のとおりであった(外国人データ)。[10.2参照]
| 併用薬 | 併用薬の用法・用量 | 例数 | 併用薬のCmax | 併用薬のAUClast |
| フルルビプロフェン(CYP2C9基質) | 50mg単回経口投与 | 24 | 1.07[0.98,1.17] | 1.04[1.00,1.09] |
| オメプラゾール(CYP2C19基質) | 20mg単回経口投与 | 24 | オメプラゾール 1.87[1.51,2.31] | オメプラゾール 1.90[1.59,2.28] |
| 5-ヒドロキシオメプラゾール 1.34[1.15,1.56] | 5-ヒドロキシオメプラゾール 1.50[1.36,1.66] | |||
| ミダゾラム(CYP3A基質) | 2mg単回経口投与 | 24 | ミダゾラム 0.61[0.54,0.68] | ミダゾラム 0.68[0.64,0.73] |
| 1-ヒドロキシミダゾラム 2.28[2.01,2.58] | 1-ヒドロキシミダゾラム 3.57[3.29,3.87] | |||
| レパグリニド(CYP2C8基質) | 2mg単回経口投与 | 30 | 1.27[1.12,1.44] | 1.23[1.14,1.32] |
| bupropion(CYP2B6基質) | 150mg単回経口投与 | 24 | 0.86[0.79,0.93] | 0.83[0.78,0.89] |
(2)リン酸吸着剤
リン酸吸着剤非併用時に対する併用時(600mg単回経口投与)のテコビリマトの薬物動態パラメータ比は以下のとおりであった(外国人データ)。
| 併用薬 | 併用薬の用法・用量 | 例数 | テコビリマトのCmax | テコビリマトのAUClast |
| sevelamer carbonate | 1,600mg単回経口投与 | 39 | 1.16[1.08,1.26] | 1.26[1.17,1.36] |
| スクロオキシ水酸化鉄 | 500mg単回経口投与 | 37 | 1.15[1.06,1.24] | 1.21[1.12,1.31] |
| calcium acetate | 1,334mg単回経口投与 | 37 | 1.09[1.01,1.18] | 1.16[1.07,1.25] |
| 炭酸ランタン | 500mg単回経口投与 | 38 | 1.21[1.12,1.30] | 1.21[1.12,1.31] |
18. 薬効薬理
18.1 作用機序
テコビリマトはオルソポックスウイルス属のVP37蛋白質と細胞性Rab9 GTPase及びTIP47との相互作用を阻害することにより、ウイルスのエンベロープ形成及びその後に続くウイルス粒子の細胞外への放出を阻害する。
18.2 In vitro 抗ウイルス活性
テコビリマトは、細胞培養系を用いた試験において、バリオラウイルス、エムポックスウイルス、ウサギ痘ウイルス、牛痘ウイルス及びワクチニアウイルスに対して抗ウイルス活性を示し、細胞変性効果を指標とした50%有効濃度(EC50値)は、それぞれ11〜67、0.01137〜39、14、20〜210及び7〜10nmol/Lであった。
18.3 動物モデルにおける治療効果
18.3.1 サル感染モデルを用いた検討
カニクイザルにエムポックスウイルスを静脈内接種し、全例で皮疹が認められた時点である4日後からプラセボ又はテコビリマト0.3〜10mg/kgを1日1回14日間経口投与し、テコビリマトの最小有効用量を検討した。エムポックスウイルス接種後28日目までの生存率は、プラセボ並びにテコビリマト0.3、1、3及び10mg/kg投与群で、それぞれ0%(0/7例)、20%(1/5例)、0%(0/5例)、80%(4/5例)及び80%(4/5例)であった。
カニクイザルにエムポックスウイルスを静脈内接種し、その4日後からプラセボ又は4、5若しくは6日後からテコビリマト10mg/kgを1日1回14日間経口投与し、テコビリマトの治療効果に対する投与開始時期の影響を検討した。エムポックスウイルス接種後56日目までの生存率は、プラセボ並びにテコビリマトのエムポックスウイルス接種4、5及び6日後投与開始群で、それぞれ0%(0/3例)、83%(5/6例)、83%(5/6例)及び50%(3/6例)であった。
カニクイザルにエムポックスウイルスを静脈内接種し、その4日後からプラセボを10日間又はテコビリマト10mg/kgを3〜10日間1日1回経口投与し、テコビリマトの治療効果に対する投与期間の影響を検討した。エムポックスウイルス接種後28日目までの生存率は、プラセボ並びにテコビリマト3、5、7及び10日間投与群で、それぞれ25%(1/4例)、50%(2/4例)、100%(6/6例)、100%(6/6例)及び80%(4/5例)であった。[7.参照]
カニクイザルにエムポックスウイルスを静脈内接種し、その4日後からプラセボ又は4、5若しくは6日後からテコビリマト10mg/kgを1日1回14日間経口投与し、テコビリマトの治療効果に対する投与開始時期の影響を検討した。エムポックスウイルス接種後56日目までの生存率は、プラセボ並びにテコビリマトのエムポックスウイルス接種4、5及び6日後投与開始群で、それぞれ0%(0/3例)、83%(5/6例)、83%(5/6例)及び50%(3/6例)であった。
カニクイザルにエムポックスウイルスを静脈内接種し、その4日後からプラセボを10日間又はテコビリマト10mg/kgを3〜10日間1日1回経口投与し、テコビリマトの治療効果に対する投与期間の影響を検討した。エムポックスウイルス接種後28日目までの生存率は、プラセボ並びにテコビリマト3、5、7及び10日間投与群で、それぞれ25%(1/4例)、50%(2/4例)、100%(6/6例)、100%(6/6例)及び80%(4/5例)であった。[7.参照]
18.3.2 ウサギ感染モデルを用いた検討
NZWウサギにウサギ痘ウイルスを皮内接種し、全例で発熱とウイルス血症が認められた時点である4日後からプラセボ又はテコビリマト20〜120mg/kgを1日1回14日間経口投与し、テコビリマトの最小有効用量を検討した。ウサギ痘ウイルス接種後30日目までの生存率は、プラセボ並びにテコビリマト20、40、80及び120mg/kg投与群で、それぞれ0%(0/10例)、90%(9/10例)、90%(9/10例)、80%(8/10例)及び80%(8/10例)であった。
18.4 耐性
サル及びウサギ感染モデルにテコビリマトを投与したとき、治療失敗又はウイルスの消失が認められなかった例において、テコビリマト耐性と関連するVP37蛋白質のアミノ酸変異が認められた。また、テコビリマト投与経験がある患者から分離されたエムポックスウイルスにおいても、テコビリマト耐性と関連するVP37蛋白質のアミノ酸変異が認められた2)。
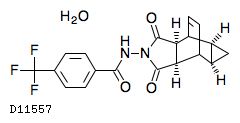
19. 有効成分に関する理化学的知見
19.1. テコビリマト水和物
20. 取扱い上の注意
開栓後は遮光して保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 製造販売後、一定数の症例に係るデータが集積されるまでの間は、可能な限り全症例を対象に使用成績調査を実施すること。
22. 包装
42カプセル[瓶]
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
日本バイオテクノファーマ株式会社
〒103-0023
東京都中央区日本橋本町2丁目6番13号
電話:03-6231-0850 受付時間:9:30〜17:00(土・日・祝日及び会社休日を除く)
FAX:03-6231-0859
製品情報問い合わせ先
日本バイオテクノファーマ株式会社
〒103-0023
東京都中央区日本橋本町2丁目6番13号
電話:03-6231-0850 受付時間:9:30〜17:00(土・日・祝日及び会社休日を除く)
FAX:03-6231-0859
26. 製造販売業者等
26.1 製造販売元
日本バイオテクノファーマ株式会社
〒103-0023
東京都中央区日本橋本町2丁目6番13号