医薬品情報
| 総称名 | リブマーリ |
|---|---|
| 一般名 | マラリキシバット塩化物 |
| 欧文一般名 | Maralixibat Chloride |
| 製剤名 | マラリキシバット塩化物内用液 |
| 薬効分類名 | 回腸胆汁酸トランスポーター阻害剤 |
| 薬効分類番号 | 3919 |
| ATCコード | A05AX04 |
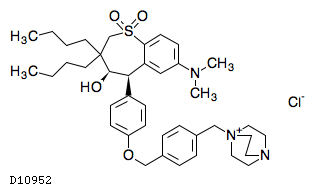
| KEGG DRUG |
D10952
マラリキシバット塩化物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リブマーリ内用液10mg/mL | Livmarli Oal Solution 10mg/mL | 武田薬品工業 | 3919008S1025 | 3888640.7円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
次の疾患における胆汁うっ滞に伴うそう痒
○アラジール症候群
○進行性家族性肝内胆汁うっ滞症
5. 効能または効果に関連する注意
<進行性家族性肝内胆汁うっ滞症>
ABCB11遺伝子変異を有する患者のうち、胆汁酸塩排出ポンプ蛋白質(BSEP)の機能を完全に喪失する変異を有する患者では、本剤の効果は期待できない。
6. 用法及び用量
<アラジール症候群>
通常、マラリキシバット塩化物として、200μg/kgを1日1回食前に経口投与する。1週間後、400μg/kg 1日1回に増量する。
<進行性家族性肝内胆汁うっ滞症>
通常、マラリキシバット塩化物として、300μg/kgを1日1回食前に経口投与する。1週間後、1回300μg/kg 1日2回に増量する。さらに、1週間後、1回600μg/kg 1日2回に増量する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 本剤を3ヵ月間投与しても効果が認められない場合には、投与継続の是非を検討すること。
<アラジール症候群>
7.2 本剤投与に際しては、下記の体重別投与量表を参考にすること。
| 体重 | 200μg/kg | 400μg/kg |
| 1回投与量 | 1回投与量 | |
| 4kg | 0.1mL | 0.15mL |
| 5〜6kg | 0.1mL | 0.2mL |
| 7〜9kg | 0.15mL | 0.3mL |
| 10〜12kg | 0.2mL | 0.45mL |
| 13〜15kg | 0.3mL | 0.6mL |
| 16〜19kg | 0.35mL | 0.7mL |
| 20〜24kg | 0.45mL | 0.9mL |
| 25〜29kg | 0.5mL | 1mL |
| 30〜34kg | 0.6mL | 1.25mL |
| 35〜39kg | 0.7mL | 1.5mL |
| 40〜49kg | 0.9mL | 1.75mL |
| 50〜59kg | 1mL | 2.25mL |
| 60〜69kg | 1.25mL | 2.5mL |
| 70kg以上 | 1.5mL | 3mL |
<進行性家族性肝内胆汁うっ滞症>
7.3 本剤投与に際しては、下記の体重別投与量表を参考にすること。
| 体重 | 300μg/kg | 600μg/kg |
| 1回投与量 | 1回投与量 | |
| 3kg | 0.1mL | 0.2mL |
| 4kg | 0.1mL | 0.25mL |
| 5kg | 0.15mL | 0.3mL |
| 6〜7kg | 0.2mL | 0.4mL |
| 8〜9kg | 0.25mL | 0.5mL |
| 10〜12kg | 0.35mL | 0.6mL |
| 13〜15kg | 0.4mL | 0.8mL |
| 16〜19kg | 0.5mL | 1mL |
| 20〜24kg | 0.6mL | 1.25mL |
| 25〜29kg | 0.8mL | 1.5mL |
| 30〜34kg | 0.9mL | 2mL |
| 35〜39kg | 1.25mL | 2.25mL |
| 40〜49kg | 1.25mL | 2.75mL |
| 50〜59kg | 1.5mL | 3mL |
| 60〜69kg | 2mL | 3mL |
| 70〜79kg | 2.25mL | 3mL |
| 80kg以上 | 2.5mL | 3mL |
8. 重要な基本的注意
8.1 本剤投与中に腹痛や下痢が持続し、他の原因が認められない場合は、減量又は休薬を検討すること。下痢による脱水に注意し、異常が認められた場合には速やかに適切な処置を行うこと。
8.2 本剤の投与開始前及び投与中は定期的に肝機能検査を行い、患者の状態を十分に観察すること。
8.3 本剤の投与開始前及び投与中は定期的に血中脂溶性ビタミン(A、D、E、K)濃度及びプロトロンビン時間国際標準比(PT-INR)を測定して患者の状態について十分に観察を行い、必要に応じて脂溶性ビタミンの補給を考慮すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
1ヵ月齢未満の新生児を対象とした臨床試験は実施されていない。
11. 副作用
11.2 その他の副作用
| 5%以上 | |
| 消化器 | 下痢(23.3%)、腹痛(13.3%) |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 患者又は保護者に対し、使用説明書及び投与量に応じた専用の経口投与用ディスペンサーを渡し、服用方法を指導すること。
14.1.2 小児の手の届かない所に保管するよう指導すること。
14.1.3 開封後は室温(1〜30℃)で保管するよう指導すること。
14.1.4 開封後は130日以内に使用し、使用されなかった薬液は廃棄するよう指導すること。
14.2 薬剤投与時の注意
内服用にのみ使用させること。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人12例を対象に、マラリキシバット塩化物30mg注)を空腹時に単回経口投与したときのTmaxの中央値は0.75時間、Cmax及びAUClastの平均値(標準偏差)はそれぞれ1.65(1.10)ng/mL及び3.43(2.13)ng・hr/mLであった。t1/2の平均値は1.8時間であった1)(外国人データ)。
16.1.2 反復投与
(1)日本人のアラジール症候群患者7例(4ヵ月齢〜10歳)及び進行性家族性肝内胆汁うっ滞症(PFIC)患者5例(4〜11歳)にマラリキシバット塩化物をそれぞれ400μg/kgを1日1回、600μg/kgを1日2回反復経口投与した場合の血漿中濃度の平均値は、400μg/kgを1日1回経口投与での投与4時間後では0.96ng/mL、600μg/kgを1日2回経口投与での投与2.5時間後では0.39ng/mLであり、日本人のアラジール症候群患者2例及びPFIC患者2例で定量下限(0.250ng/mL)未満であった2)。
(2)健康成人8例を対象に、マラリキシバット塩化物100mg注)を食直前に1日1回反復経口投与したとき、血漿中での蓄積は認められなかった1)(外国人データ)。
16.2 吸収
16.2.1 食事の影響
健康成人各群12例を対象に、マラリキシバット塩化物30mg又は45mg注)を高脂肪食摂取後に単回経口投与したときのAUClast及びCmaxは、空腹時投与と比較して、69.3%〜85.8%及び64.8%〜73.2%減少した3)(外国人データ)。
16.3 分布
In vitro試験において、マラリキシバットのヒト血漿タンパク結合率は91%であった4)。
16.4 代謝
健康成人8例を対象に、[14C]マラリキシバット塩化物5mg注)を空腹時に単回経口投与したとき、血漿中に代謝物は認められなかった1)(外国人データ)。
16.5 排泄
健康成人8例を対象に、[14C]マラリキシバット塩化物5mg注)を空腹時に単回経口投与したとき、投与放射能量の72%が糞中に、0.066%が尿中に排泄され、糞中の放射能の94%が未変化体であった1)(外国人データ)。
16.7 薬物相互作用
16.7.1 In vitro試験
マラリキシバットはOATP2B1に対する阻害作用を示した5)。
注)本剤の承認用量(最大投与量)は、アラジール症候群患者に対しては400μg/kg 1日1回、進行性家族性肝内胆汁うっ滞症患者に対しては1回600μg/kg 1日2回、経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<アラジール症候群>
17.1.1 国内第III相試験(非盲検非対照試験)
日本人アラジール症候群患者7例(4ヵ月齢〜10歳)を対象に、非盲検下、2週間の用量漸増後、マラリキシバット塩化物400μg/kgを1日1回経口投与した。18週から22週までの空腹時血清総胆汁酸濃度(主要評価項目)及びItch Reported Outcome(Observer)[ItchRO(Obs)]スコアで測定した朝のそう痒の週平均重症度スコアの変化量は下表のとおりであった6)。
| 例数 | 空腹時血清総胆汁酸濃度(μmol/L) | そう痒 ItchRO(Obs)スコア注) | |
| MRX | 7 | 17.64±53.29[−31.64,66.92] | −0.28±0.43[−0.68,0.12] |
ベースラインから18週までの空腹時血清総胆汁酸濃度及びItchRO(Obs)スコアで測定した朝のそう痒の週平均重症度スコアの変化量は下表のとおりであった6)。
| 例数 | 空腹時血清総胆汁酸濃度(μmol/L) | そう痒 ItchRO(Obs)スコア注) | |
| MRX | 7 | 8.30±49.43[−37.41,54.01] | −1.33±0.84[−2.11,−0.55] |
副作用発現頻度(48週まで)は14.3%(1/7例)であり、認められた副作用は便意切迫であった6)。
17.1.2 海外第II相試験(プラセボ対照二重盲検比較試験)
1歳以上のアラジール症候群患者31例を対象に、非盲検下、6週間の用量漸増後、マラリキシバット塩化物400μg/kgを1日1回12週間経口投与し、二重盲検下、プラセボ又はマラリキシバット塩化物400μg/kgを1日1回4週間経口投与した。なお、その後、すべての患者に非盲検下でマラリキシバット塩化物400μg/kgを1日1回投与した。18週から22週までの空腹時血清総胆汁酸濃度(主要評価項目)及びItchRO(Obs)で測定した朝のそう痒の週平均重症度スコアの変化量は、下表のとおりであった7)8)。
| 空腹時血清総胆汁酸濃度(μmol/L) | そう痒 ItchRO(Obs)スコア注2) | ||||
| 例数 | 変化量 | 群間差 | 変化量 | 群間差 | |
| PBO | 10 | 95.55±30.49[29.12,161.97] | −117.28±52.83[−232.38,−2.18] | 2.11±0.20[1.69,2.54] | −2.05±0.35[−2.80,−1.29] |
| MRX | 5 | −21.73±43.13[−115.69,72.23] | 0.07±0.28[−0.54,0.68] | ||
ベースラインから18週までの空腹時血清総胆汁酸濃度及びItchRO(Obs)スコアで測定した朝のそう痒の週平均重症度スコアの変化量は下表のとおりであった7)。
| 例数 | 空腹時血清総胆汁酸濃度(μmol/L) | そう痒 ItchRO(Obs)スコア注) | |
| MRX | 29 | −87.73±119.98[−133.37,−42.09] | −1.70±0.91[−2.05,−1.36] |
副作用発現頻度(48週まで)は、本剤投与において38.7%(12/31例)であり、主な副作用は腹痛29.0%(9/31例)、下痢22.6%(7/31例)であった9)。
<進行性家族性肝内胆汁うっ滞症>
17.1.3 国内第III相試験(非盲検非対照試験)
日本人PFIC患者5例(4〜11歳)を対象に、非盲検下、4週間(最長6週間)の用量漸増後、マラリキシバット塩化物600μg/kgを1日2回経口投与した。PFIC2※患者において、ItchRO(Obs)スコアで測定した朝のそう痒の重症度スコアの15週から26週までの平均値を用いたベースラインからの変化量(主要評価項目)及びベースラインから26週までの空腹時血清総胆汁酸濃度の変化量は下表のとおりであった10)。
| 例数 | 空腹時血清総胆汁酸濃度(μmol/L) | そう痒 ItchRO(Obs)スコア注) | |
| MRX | 3 | −149.90±165.65[−561.40,261.60] | −1.51±0.86[−3.65,0.63] |
MRX:マラリキシバット塩化物
平均値±標準偏差、[ ]は両側95%信頼区間
※PFIC2:BSEP欠損、ただしBSEP機能の完全喪失を除く
注)そう痒の評価尺度で、介護者が0点(無症状)〜4点(非常に重度)の5段階で評価する。
本試験に組み入れられた全PFIC※患者において、ItchRO(Obs)スコアで測定した朝のそう痒の重症度スコアの15週から26週までの平均値を用いたベースラインからの変化量及びベースラインから26週までの空腹時血清総胆汁酸濃度の変化量は下表のとおりであった10)。
| 例数 | 空腹時血清総胆汁酸濃度(μmol/L) | そう痒 ItchRO(Obs)スコア注) | |
| MRX | 5 | −97.24±137.82[−268.37,73.89] | −0.99±0.96[−2.18,0.20] |
MRX:マラリキシバット塩化物
平均値±標準偏差、[ ]は両側95%信頼区間
※全PFIC:PFIC1(FIC1欠損)、PFIC2(BSEP欠損、ただしBSEP機能の完全喪失を除く)
注)そう痒の評価尺度で、介護者が0点(無症状)〜4点(非常に重度)の5段階で評価する。
副作用発現頻度(48週まで)は20.0%(1/5例)であり、認められた副作用は下痢、皮膚炎であった10)。
17.1.4 海外第III相試験(プラセボ対照二重盲検比較試験)
1歳以上のPFIC患者93例を対象に二重盲検下、4週間(最長6週間)の用量漸増後、プラセボ又はマラリキシバット塩化物600μg/kgを1日2回経口投与した。本試験に組み入れられたPFIC2※患者において、ItchRO(Obs)スコアで測定した朝のそう痒の重症度スコアの15週から26週までの平均値を用いたベースラインからの変化量及び空腹時血清総胆汁酸濃度の18週、22週及び26週の平均値を用いたベースラインからの変化量は下表のとおりであり、主要評価項目であるItchRO(Obs)スコアでプラセボに対するマラリキシバットの優越性が認められた11)。
| 空腹時血清総胆汁酸濃度(μmol/L) | そう痒 ItchRO(Obs)スコア注1) | ||||
| 例数 | 変化量 | 群間差注2) | 変化量 | 群間差注3) | |
| PBO | 17 | 11.19±33.74[−58.07,80.45] | −186.72±51.95[−293.45,−79.99] | −0.63±0.25[−1.14,-0.12] | −1.09±0.37[−1.85,−0.33] p=0.0063 |
| MRX | 14 | −175.54±39.49[−256.72,−94.36] | −1.72±0.27[−2.27,−1.16] | ||
PBO:プラセボ、MRX:マラリキシバット塩化物
最小二乗平均値±標準誤差、[ ]は両側95%信頼区間
※PFIC2:BSEP欠損、ただしBSEP機能の完全喪失を除く
注1)そう痒の評価尺度で、介護者が0点(無症状)〜4点(非常に重度)の5段階で評価する。
注2)投与群、時点、投与群と時点の交互作用、ベースライン値、ベースライン値と時点の交互作用を説明変数とし、被験者内誤差の分散共分散構造に無構造を仮定したMixed-effects model for repeated measuresによる推定を行った後、3時点(18週、22週、26週)の各推定値を平均することにより算出
注3)投与群、期間、投与群と期間の交互作用、ベースライン値、ベースライン値と期間の交互作用を説明変数とし、被験者内誤差の分散共分散構造に無構造を仮定したMixed-effects model for repeated measuresによる推定を行った後、3期間(15〜18週、19〜22週、23〜26週)の各推定値を平均することにより算出、両側有意水準5%
本試験に組み入れられた全PFIC※患者において、ItchRO(Obs)スコアで測定した朝のそう痒の重症度スコアの15週から26週までの平均値を用いたベースラインからの変化量及び空腹時血清総胆汁酸濃度の18週、22週及び26週の平均値を用いたベースラインからの変化量は、下表のとおりであった11)。
| 空腹時血清総胆汁酸濃度(μmol/L) | そう痒 ItchRO(Obs)スコア注1) | ||||
| 例数 | 変化量 | 群間差注2) | 変化量 | 群間差注3) | |
| PBO | 31 | 2.91±22.63[−42.32,48.15] | −160.40±30.18[−220.84,−99.97] | −0.61±0.19[−1.00,−0.22] | −1.20±0.26[−1.73,−0.67] |
| MRX | 33 | −157.49±21.36[−200.28,−114.70] | −1.81±0.18[−2.18,−1.44] | ||
PBO:プラセボ、MRX:マラリキシバット塩化物
最小二乗平均値±標準誤差、[ ]は両側95%信頼区間
※全PFIC:PFIC1(FIC1欠損)、PFIC2(BSEP欠損、ただしBSEP機能の完全喪失を除く)、PFIC3(MDR3欠損)、PFIC4(ZO-2欠損)、PFIC10(MyosinVB欠損)
注1)そう痒の評価尺度で、介護者が0点(無症状)〜4点(非常に重度)の5段階で評価する。
注2)投与群、時点、投与群と時点の交互作用、ベースライン値、ベースライン値と時点の交互作用、PFICタイプを説明変数とし、被験者内誤差の分散共分散構造に無構造を仮定したMixed-effects model for repeated measuresによる推定を行った後、3時点(18週、22週、26週)の各推定値を平均することにより算出
注3)投与群、期間、投与群と期間の交互作用、ベースライン値、ベースライン値と期間の交互作用、PFICタイプを説明変数とし、被験者内誤差の分散共分散構造に無構造を仮定したMixed-effects model for repeated measuresによる推定を行った後、3期間(15〜18週、19〜22週、23〜26週)の各推定値を平均することにより算出
副作用発現頻度は本剤群では38.3%(18/47例)であり、主な副作用は下痢27.7%(13/47例)、腹痛6.4%(3/47例)及び血中ビリルビン増加6.4%(3/47例)であった12)。
18. 薬効薬理
18.1 作用機序
マラリキシバットは、可逆的かつ選択的な回腸胆汁酸トランスポーター(IBAT)の阻害剤である。マラリキシバットは回腸末端部の管腔内で作用し、IBATを介した胆汁酸の再吸収を阻害することで胆汁酸の腸肝循環を阻害する13)。
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. マラリキシバット塩化物
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
30mL[1瓶]
23. 主要文献
- マラリキシバットの薬物動態試験成績[1](2025年3月27日承認、CTD 2.7.2.2.2.1)
- マラリキシバットの薬物動態試験成績[2](2025年3月27日承認、CTD 2.7.2.2.2.2)
- マラリキシバットの薬物動態試験成績[3](2025年3月27日承認、CTD 2.7.1.2.1.1)
- マラリキシバットの薬物動態試験成績[4](2025年3月27日承認、CTD 2.7.2.3.1.2)
- マラリキシバットの薬物動態試験成績[5](2025年3月27日承認、CTD 2.6.4.7.2.2)
- マラリキシバットの国内第III相臨床試験成績(ALGS)(2025年3月27日承認、CTD 2.7.6.17)
- マラリキシバットの海外第II相臨床試験成績(ALGS)[1](2025年3月27日承認、CTD 2.7.3.2.2)
- マラリキシバットの海外第II相臨床試験成績(ALGS)[2](社内資料)
- マラリキシバットの海外第II相臨床試験成績(ALGS)[3](2025年3月27日承認、CTD 2.7.4.2.1.3)
- マラリキシバットの国内第III相臨床試験成績(PFIC)(2025年3月27日承認、CTD 2.7.6.21)
- マラリキシバットの海外第III相臨床試験成績(PFIC)[1](2025年3月27日承認、CTD 2.7.3.2.2)
- マラリキシバットの海外第III相臨床試験成績(PFIC)[2](2025年3月27日承認、CTD 2.7.4.2.1.3)
- マラリキシバットの薬理試験成績(2025年3月27日承認、CTD 2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製品情報問い合わせ先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
武田薬品工業株式会社
〒540-8645
大阪市中央区道修町四丁目1番1号
26.2 提携
mirum