医薬品情報
| 総称名 | スリンダ |
|---|---|
| 一般名 | ドロスピレノン |
| 欧文一般名 | Drospirenone |
| 製剤名 | ドロスピレノン錠 |
| 薬効分類名 | 経口避妊剤 |
| 薬効分類番号 | 2549 |
| ATCコード | G03AC10 |
| KEGG DRUG |
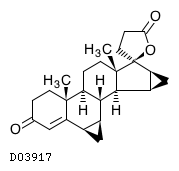
D03917
ドロスピレノン
|
| KEGG DGROUP |
DG01676
アルドステロン拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第2版)
経口避妊剤は、HIV感染(エイズ)及び他の性感染症(例えば梅毒、性器ヘルペス、淋病、クラミジア感染症、尖圭コンジローマ、腟トリコモナス症、B型肝炎等)を防止するものではないこと、これらの感染防止には、コンドームの使用が有効であることを服用者に十分説明すること。
なお、必要に応じ、性感染症検査の実施を考慮すること。
なお、必要に応じ、性感染症検査の実施を考慮すること。
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| スリンダ錠28 | Slinda28 Tablets | あすか製薬 | 254900BF1022 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
避妊
5. 効能または効果に関連する注意
経口避妊剤使用開始1年間の飲み忘れを含めた一般的使用における失敗率は7%との報告がある。[17.3参照]
6. 用法及び用量
1日1錠を毎日一定の時刻に白色錠から開始し、指定された順番に従い28日間連続経口投与する。
以上28日間を投与1周期とし、29日目から次の周期の錠剤を投与し、以後同様に繰り返す。
以上28日間を投与1周期とし、29日目から次の周期の錠剤を投与し、以後同様に繰り返す。
7. 用法及び用量に関連する注意
7.1 毎日一定の時刻に服用させること。
7.2 服用開始日
経口避妊剤を初めて服用させる場合、月経第1日目から服用を開始させる。服用開始日が月経第1日目から遅れた場合、飲みはじめの最初の1週間は他の避妊法を併用させること。
7.3 本剤の投与にあたっては飲み忘れ等がないよう服用方法を十分指導すること。万一飲み忘れがあり(淡黄色錠を除く)、翌日までに気づいたならば直ちに飲み忘れた錠剤を服用し、その日の錠剤も通常どおりに服用させる。
2日連続して飲み忘れた場合は、気づいた時点で直ちに飲み忘れた錠剤を1錠服用し、その日の錠剤も通常どおりに服用させる。
3日以上連続して飲み忘れた場合は服用を中止させ、次の月経を待ち投与を再開させること。
なお、2日以上連続した飲み忘れにより妊娠する可能性が高くなるので、その周期は他の避妊法を使用させること。
2日連続して飲み忘れた場合は、気づいた時点で直ちに飲み忘れた錠剤を1錠服用し、その日の錠剤も通常どおりに服用させる。
3日以上連続して飲み忘れた場合は服用を中止させ、次の月経を待ち投与を再開させること。
なお、2日以上連続した飲み忘れにより妊娠する可能性が高くなるので、その周期は他の避妊法を使用させること。
7.4 他の経口避妊剤から本剤に切り替える場合
本剤の服用は、切替え前に服用していた薬剤の1周期分の錠剤のうち、有効成分を含む錠剤を用法に従ってすべて服用した翌日から開始させること。
本剤の服用開始が遅れた場合、妊娠する可能性がある。
本剤の服用開始が遅れた場合、妊娠する可能性がある。
7.5 子宮内避妊器具又は子宮内避妊システムから切り替える場合
本剤の服用は、除去後同日に開始させること。
8. 重要な基本的注意
8.1 本剤の投与にあたっては、服用者の病歴調査及び検診が必要である。この検診には、乳房・腹部の検査及び臨床検査が含まれる。
8.6 服用中に激しい下痢、嘔吐が続いた場合には本剤の吸収不良を来すことがあり、その場合には妊娠する可能性が高くなるので、その周期は他の避妊法を併用させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨成長が終了していない可能性がある女性
エストラジオールの血清中濃度を低下させ、骨密度の減少をもたらすおそれがある。
9.1.2 乳癌の既往歴のある女性
乳癌が再発するおそれがある。[8.3参照]
9.1.3 うつ病又はうつ状態の患者並びにそれらの既往歴のある患者
症状が悪化するおそれがある。
9.1.4 活動性の静脈血栓塞栓症の患者
静脈血栓塞栓症の治療を優先すること。
9.2 腎機能障害患者
9.2.1 重篤な腎障害又は急性腎障害のある患者
投与しないこと。本剤のアルドステロン拮抗作用により、カリウム値が上昇するおそれがある。[2.4参照]
9.2.2 腎障害のある患者(重篤な腎障害又は急性腎障害のある患者を除く)
本剤のアルドステロン拮抗作用により、カリウム値が上昇するおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。[2.5参照]
9.3.2 肝障害のある患者(重篤な肝障害のある患者を除く)
代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へ移行するとの報告がある。
10. 相互作用
10.2 併用注意
| リファンピシン バルビツール酸系製剤 フェノバルビタール等 ヒダントイン系製剤 フェニトインナトリウム等 カルバマゼピン ボセンタン モダフィニル トピラマート 非ヌクレオシド系逆転写酵素阻害剤 ネビラピン セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | 本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | これらの薬剤等は薬物代謝酵素を誘導し、本剤の代謝を促進する可能性があると考えられる。 |
| フルコナゾール ボリコナゾール HIVプロテアーゼ阻害剤 リトナビル、ダルナビル、ホスアンプレナビル(リトナビル併用時)、ロピナビル・リトナビル配合剤、アタザナビル等 | 本剤の血中濃度が上昇するおそれがある。 | これらの薬剤は薬物代謝酵素を阻害し、本剤の代謝を阻害する可能性があると考えられる。 |
| Gn-RH誘導体 ブセレリン酢酸塩等 レルゴリクス リュープロレリン | これらの薬剤の作用を減弱するおそれがある。 | これらの薬剤は性ホルモンの分泌を低下することにより薬効を示すため、性ホルモンである本剤の投与によってこれらの薬剤の効果を減弱する可能性が考えられる。 |
| 黄体ホルモン含有製剤 プロゲステロン製剤 メドロキシプロゲステロン酢酸エステル製剤 ノルエチステロン製剤 ジドロゲステロン製剤等 | プロゲステロン作用が増強する可能性がある。 | ともにプロゲステロン受容体に対するアゴニスト活性を示すことから、プロゲステロン作用が相加的に増強する可能性がある。 |
| ACE阻害剤 カプトプリル、エナラプリル等 アンジオテンシンII受容体拮抗剤 ロサルタンカリウム、カンデサルタンシレキセチル等 カリウム保持性利尿剤 スピロノラクトン、トリアムテレン、カンレノ酸カリウム等 カリウム製剤 塩化カリウム、グルコン酸カリウム等 ヘパリン アルドステロン拮抗剤 非ステロイド性消炎鎮痛剤 インドメタシン等 シクロスポリン | 高カリウム血症を誘発することがあるので、血清カリウム値を観察するなど十分注意すること。 | これらの薬剤による血清カリウム値の上昇とドロスピレノンの抗ミネラルコルチコイド作用によると考えられる。 危険因子:腎障害患者、血清カリウム値の高い患者 |
11. 副作用
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 女性生殖器 | 不正性器出血(月経中間期出血、異常子宮出血)(89.9%)、下腹部痛(13.4%)、月経異常(過少月経、過長過多不規則月経、重度月経出血)(14.9%) | 無月経、卵巣嚢胞、子宮頸部上皮異形成、子宮筋腫、カンジダ症、外陰部炎、性器分泌物 | 陰部そう痒症、子宮ポリープ、外陰腟痛、卵巣腫大 | リビドー減退 |
| 乳房 | 乳房不快感 | 乳頭痛、乳腺良性腫瘍、乳腺嚢胞症 | 乳房痛 | |
| 精神神経系 | 頭痛(16.3%) | 傾眠、いらいら感、不安感、めまい、片頭痛 | 抑うつ | |
| 消化器 | 腹痛(12.3%)、悪心、下痢 | 上腹部痛、嘔吐、胃腸障害 | 便秘、消化不良、腹部膨満、口内炎 | |
| 皮膚 | ざ瘡 | 発疹、そう痒症 | 紅斑、皮膚乾燥 | |
| 筋・骨格系 | 背部痛 | 関節痛、肋軟骨炎 | ||
| その他 | 倦怠感、浮腫、発熱、体重増加 | 貧血、肝機能検査値異常 | 高カリウム血症、ほてり |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
正常な月経を有する健康成人女性(12例)にドロスピレノン(DRSP)4mgを単回経口投与したときのDRSPの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。血漿中DRSP濃度は、投与4時間後に最高濃度に達し、その後二相性の消失を示した1)。
| Cmax(ng/mL) | Tmax(h) | AUC0-72h(ng・h/mL) | AUC∞(ng・h/mL) | T1/2(h) |
| 28.2128±4.4199 | 4.0(1-8) | 491.23±129.94 | 590.53±223.32 | 27.22±8.39 |
16.1.2 反復投与
正常な月経を有する健康成人女性(12例)にDRSP4mgを1日1回24日間反復経口投与したときの薬物動態パラメータは以下のとおりであった。投与6日目には血漿中DRSP濃度は定常状態に達し、蓄積はなかった1)。
| Cmax(ng/mL) | Tmax(h) | AUC0-72h(ng・h/mL) | AUC∞(ng・h/mL) | T1/2(h) |
| 49.5253±11.7808 | 3.0(1-5) | 1077.07±492.87 | 1303.92±753.02 | 25.61±8.51 |
16.2 吸収
16.2.1 食事の影響
健康成人女性(24例)を対象に2期クロスオーバー試験を実施し、DRSPの薬物動態に対する食事の影響を検討した。空腹時単回投与に対する食後単回投与後のAUC0-72hは107.99%、Cmaxは129.35%であった2)(外国人データ)。
16.3 分布
In vitro試験において、DRSPのヒト血清タンパクへの結合率は95〜97%であり、主にアルブミンと結合していると考えられ、性ホルモン結合グロブリン(SHBG)やコルチコステロイド結合グロブリン(CBG)とは結合しない3)。
16.4 代謝
健康閉経後女性(6例)に14C-DRSPを経口投与後、血漿中にラクトン環の開環により生じたDRSPの酸性型及び4,5-ジヒドロ-DRSP-3-硫酸が主要な不活性代謝物として検出された4)(外国人データ)。
16.5 排泄
健康閉経後女性(6例)に14C-DRSPを経口投与後、放射活性は投与10日以内にほぼ完全に糞尿中に排泄された。尿中より糞中にやや多く排泄され、経口投与後では糞中に44%、尿中に39%が回収された。糞尿中に排泄された未変化体は僅かであった4)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
軽度(クレアチニンクリアランス51〜80mL/min)の腎機能障害(10例)又は中等度(クレアチニンクリアランス30〜50mL/min)の腎機能障害(7例)の女性患者、並びに正常な腎機能の女性被験者(11例)にDRSP3mgを1日1回14日間反復経口投与し、DRSPの薬物動態を検討した結果、正常被験者と比較して、軽度及び中等度腎機能障害患者でCmaxはそれぞれ1.11倍及び1.18倍、AUC0-24hはそれぞれ1.04倍及び1.37倍に増加した5)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
避妊を希望する女性(276例)を対象として本剤を投与したときの有効性及び安全性を評価する非盲検非対照試験を実施した。13周期までの投与期を終了したうちの52例が24周期までの継続投与期に移行した。投与期において、13周期までの曝露周期注1)(3319周期)の間に1例が妊娠し、主要評価項目とされた全般パール指数(PI)注2)は0.3917(95%信頼区間:0.0099〜2.1823)であり、95%信頼区間の上限値が閾値(4)を下回った。また、継続投与期に妊娠は認められなかった。
投与期終了時の副作用発現頻度は95.65%(264/276例)で、主な副作用は、月経中間期出血89.49%(247例)、頭痛16.30%(45例)、下腹部痛13.04%(36例)、腹痛12.32%(34例)、重度月経出血11.59%(32例)であった。継続投与期終了時の副作用発現頻度は96.15%(50/52例)で、主な副作用は、月経中間期出血94.23%(49例)、頭痛17.31%(9例)、下痢13.46%(7例)、重度月経出血13.46%(7例)、下腹部痛11.54%(6例)、乳房不快感11.54%(6例)であった6)。
投与期終了時の副作用発現頻度は95.65%(264/276例)で、主な副作用は、月経中間期出血89.49%(247例)、頭痛16.30%(45例)、下腹部痛13.04%(36例)、腹痛12.32%(34例)、重度月経出血11.59%(32例)であった。継続投与期終了時の副作用発現頻度は96.15%(50/52例)で、主な副作用は、月経中間期出血94.23%(49例)、頭痛17.31%(9例)、下痢13.46%(7例)、重度月経出血13.46%(7例)、下腹部痛11.54%(6例)、乳房不快感11.54%(6例)であった6)。
注1)少なくとも1回の服薬が確認された28日間の周期。ただし、28日未満でも妊娠が確認された周期は含む。
注2)(受胎推定日が曝露周期にある妊娠の合計×1300)/(曝露周期の合計)
17.3 その他
各種避妊法使用開始1年間の失敗率(妊娠率)は以下のとおりである7)。[5.参照]
| 方法 | 理想的な使用※(%) | 一般的な使用※※(%) |
| 経口避妊剤 | 0.3 | 7 |
| レボノルゲストレル放出IUS | 0.3 | 0.4 |
| 銅付加IUD | 0.6 | 0.8 |
| コンドーム | 2 | 13 |
| リズム法 | 0.4〜5 | 2〜23 |
| 女性避妊手術 | 0.5 | 0.5 |
| 男性避妊手術 | 0.1 | 0.15 |
| 避妊せず | 85 | 85 |
18. 薬効薬理
18.1 作用機序
DRSPはプロゲステロン作用と抗ミネラルコルチコイド作用、弱い抗アンドロゲン作用を持つスピロノラクトン誘導体であり、排卵の抑制、子宮内膜の菲薄化、子宮頸管粘液の高粘稠による精子の侵入障害等により避妊効果を発揮する8)。
18.2 排卵の抑制
健康成人女性(12例)を対象とした国内第I/II相試験において、本剤を単回投与又は24日間反復投与し、血清プロゲステロン濃度を測定した結果、反復投与期にプロゲステロン濃度が排卵の有無を判定する基準値を超えた被験者は認められず、排卵抑制作用が示唆された9)。
18.3 子宮内膜の変化
健康な閉経前女性(21例)を対象とした海外第III相試験において、本剤を13周期投与した結果、子宮内膜厚の減少が認められた10)(外国人データ)。
18.4 子宮頸管粘液の変化
健康成人女性(27例)を対象とした海外第II相試験において、本剤を2周期投与した結果、子宮頸管粘液スコアが低下し、子宮頸管粘液の粘度の増加が認められた11)(外国人データ)。
19. 有効成分に関する理化学的知見
19.1. ドロスピレノン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
280錠[28錠(PTP)×10]
23. 主要文献
- 社内資料:国内第I/II相臨床試験(2025年5月19日承認、CTD2.7.6.4)
- 社内資料:海外第I相臨床試験(2025年5月19日承認、CTD2.7.6.2)
- Krattenmacher,R., Contraception., 62 (1), 29-38, (2000) »PubMed
- 社内資料:海外薬物動態試験(2025年5月19日承認、CTD2.7.2.2.2.4)
- Schurmann,R.et al., J.Clin.Pharmacol., 46 (8), 867-75, (2006) »PubMed
- 社内資料:国内第III相臨床試験(2025年5月19日承認、CTD2.7.6.10)
- Cason,P.et al., Contraceptive Technology:Twenty-second Edition.Burlington.Jones-Bartlett Learning., (2023), (改変)
- 社内資料:DRSPの薬理作用(2025年5月19日承認、CTD2.6.1.2)
- 社内資料:国内第I/II相臨床試験:日本人健康女性におけるPD的作用(2025年5月19日承認、CTD2.7.2.2.4.1)
- 社内資料:海外第III相臨床試験(2025年5月19日承認、CTD2.7.6.8)
- 社内資料:海外第II相臨床試験(2025年5月19日承認、CTD2.7.6.5)
24. 文献請求先及び問い合わせ先
文献請求先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
製品情報問い合わせ先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
25. 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号