医薬品情報
| 総称名 | スピジア |
|---|---|
| 一般名 | ジアゼパム |
| 欧文一般名 | Diazepam |
| 製剤名 | ジアゼパム点鼻液 |
| 薬効分類名 | 抗けいれん剤 |
| 薬効分類番号 | 1139 |
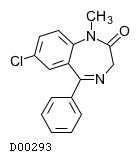
| KEGG DRUG |
D00293
ジアゼパム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| スピジア点鼻液5mg | Spydia Nasal Spray | アキュリスファーマ | 1139701R1029 | 8336.5円/瓶 | 向精神薬(第三種向精神薬), 処方箋医薬品注) |
| スピジア点鼻液7.5mg | Spydia Nasal Spray | アキュリスファーマ | 1139701R2025 | 9337.6円/瓶 | 向精神薬(第三種向精神薬), 処方箋医薬品注) |
| スピジア点鼻液10mg | Spydia Nasal Spray | アキュリスファーマ | 1139701R3021 | 10120円/瓶 | 向精神薬(第三種向精神薬), 処方箋医薬品注) |
1. 警告
本剤を交付する際には、本剤交付前に保護者(家族)又はそれに代わる適切な者が投与できるよう、本剤の投与が必要な症状の判断方法、本剤の保存方法、使用方法、使用時に発現する可能性のある副作用等を保護者(家族)又はそれに代わる適切な者が理解したことを確認した上で交付すること。[8.1参照]
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 急性閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
2.3 重症筋無力症の患者[本剤の筋弛緩作用により症状が悪化するおそれがある。]
2.4 リトナビル(HIVプロテアーゼ阻害剤)、ニルマトレルビル・リトナビルを投与中の患者[10.1参照]
4. 効能または効果
てんかん重積状態
5. 効能または効果に関連する注意
5.1 国内第III相試験で本剤が投与された患者、試験結果等を十分に理解した上で、適応患者の選択を行うこと。[17.1参照]
5.2 非けいれん性てんかん重積状態に対して、保護者(家族)又はそれに代わる適切な者が本剤を投与する場合は、本剤の投与が必要な症状を判断可能であると医師が適切に判断した患者にのみ投与すること。
6. 用法及び用量
通常、成人及び2歳以上の小児にはジアゼパムとして、患者の年齢及び体重を考慮し、5〜20mgを1回鼻腔内に投与する。効果不十分な場合には4時間以上あけて2回目の投与ができる。ただし、6歳未満の小児の1回量は15mgを超えないこと。
7. 用法及び用量に関連する注意
7.1 1回あたりの本剤の投与量は、下表を参考にすること。
| 患者の年齢及び体重 | 投与量 | ||
| 2歳以上6歳未満 | 6歳以上12歳未満 | 12歳以上 | |
| 6kg以上 12kg未満 | 10kg以上 19kg未満 | 14kg以上 28kg未満 | 5mg |
| 12kg以上 23kg未満 | 19kg以上 38kg未満 | 28kg以上 51kg未満 | 10mg |
| 23kg以上 | 38kg以上 56kg未満 | 51kg以上 76kg未満 | 15mg |
| / | 56kg以上 | 76kg以上 | 20mg |
7.2 1回あたりの投与に用いる製剤と投与方法は、下表を参考にすること。
| 投与量 | 用いる製剤 | 投与方法 |
| 5mg | スピジア点鼻液5mg | 片方の鼻腔1回 |
| 10mg | スピジア点鼻液10mg | 片方の鼻腔1回 |
| 15mg | スピジア点鼻液7.5mg | 両方の鼻腔1回ずつ |
| 20mg | スピジア点鼻液10mg | 両方の鼻腔1回ずつ |
7.3 2歳以上6歳未満の小児に投与する場合は、患者の状態を観察することができ、必要時に救急蘇生のための医療機器、薬剤等の使用が可能な医師の監視下においてのみ行うこと。
8. 重要な基本的注意
8.1 保護者(家族)又はそれに代わる適切な者が本剤を投与する場合は、その適用開始にあたり、医師は保護者(家族)又はそれに代わる適切な者に対して、患者向けの説明文書を用いて以下の点について指導すること。また、保護者(家族)又はそれに代わる適切な者が、以下の投与方法及び使用方法並びに副作用及びその対処方法等について理解し、事前に医師と十分に連携し、救急搬送の必要性を保護者(家族)又はそれに代わる適切な者が判断できることを確認した上で本剤を交付すること。[1.参照]
8.1.1 本剤に関する患者向けの説明文書等を熟読し、日頃から本剤の使用方法について理解しておくこと。
8.1.2 医師と保護者(家族)又はそれに代わる適切な者が、本剤の投与が必要となるてんかん重積状態の症状について認識を共有した上で、本剤投与前に本剤投与の必要性について確認すること。
8.1.3 原則として本剤投与後は救急搬送の手配を行い、10分以内に発作が停止しない場合、浅表性呼吸や意識消失等が認められた場合は、医療機関に救急搬送すること。その際、本剤投与状況の確認のため、使用済みの製剤を医療従事者に提示すること。
8.1.4 本剤の2回目投与後に発作が再発した場合は、本剤を追加投与せず、救急搬送すること。
8.1.5 呼吸抑制及び徐脈等があらわれるおそれがあるため、患者の呼吸数及び脈拍数を確認し、無呼吸、呼吸抑制、脈拍数低下がないか等、患者の状態を注意深く観察するとともに、救急搬送の手配等の緊急事態の対応に備えること。
8.2 無呼吸、呼吸抑制、舌根沈下等があらわれるおそれがあるため、医療機関で投与する場合は、本剤投与前に救急蘇生のための医療機器、薬剤等を準備しておくとともに、本剤投与中は、パルスオキシメーターや血圧計等を用いて、患者の呼吸及び循環動態を継続的に観察すること。
8.3 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
8.4 連用により薬物依存を生じることがあるので、漫然とした長期使用を避けること。本剤を長期使用する場合には、治療上の必要性を十分に検討すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 中等度又は重篤な呼吸不全のある患者
症状が悪化するおそれがある。
9.1.2 心障害のある患者
症状が悪化するおそれがある。
9.1.3 脳に器質的障害のある患者
作用が強くあらわれる。
9.1.4 衰弱患者
作用が強くあらわれる。
9.2 腎機能障害患者
排泄が遅延するおそれがある。
9.3 肝機能障害患者
排泄が遅延するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.5.1 妊娠中にジアゼパム製剤の投与を受けた患者の中に奇形を有する児等の障害児を出産した例が対照群と比較して有意に多いとの疫学的調査報告がある。
9.5.2 ベンゾジアゼピン系薬剤で新生児に哺乳困難、嘔吐、活動低下、筋緊張低下、過緊張、嗜眠、傾眠、呼吸抑制・無呼吸、易刺激性、神経過敏、振戦、低体温、頻脈等を起こすことが報告されている。なお、これらの症状は、離脱症状あるいは新生児仮死として報告される場合もある。また、ベンゾジアゼピン系薬剤で新生児に黄疸の増強を起こすことが報告されている。
9.5.3 分娩前に連用した場合、出産後新生児に離脱症状があらわれることが、ベンゾジアゼピン系薬剤で報告されている。
9.6 授乳婦
授乳を避けさせること。ヒト母乳中へ移行し、新生児に嗜眠、体重減少等を起こすことがあり、また、黄疸を増強する可能性がある。
9.7 小児等
低出生体重児、新生児、乳児又は2歳未満の幼児を対象とした臨床試験は実施していない。ベンジルアルコールの静脈内大量投与(99〜234mg/kg)により、中毒症状(あえぎ呼吸、アシドーシス、痙攣等)が新生児、低出生体重児に発現したとの報告がある(外国人データ)。本剤は添加剤としてベンジルアルコールを含有している。
9.8 高齢者
他の疾患や他の治療等を考慮し、患者の状態を観察しながら慎重に投与すること。運動失調等の副作用が発現しやすい。
10. 相互作用
相互作用序文
本剤は、主として肝薬物代謝酵素CYP2C19及びCYP3A4により代謝される。[16.4参照]
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| リトナビル ノービア ニルマトレルビル・リトナビル パキロビッド [2.4参照] | 過度の鎮静や呼吸抑制等を起こすおそれがある。 | これらの薬剤のCYPに対する競合的阻害作用により、併用した場合、本剤の血中濃度が大幅に上昇することが予測される。 |
10.2 併用注意
| 中枢神経抑制剤 フェノチアジン誘導体、バルビツール酸誘導体等 | 作用が増強されることがある。 | 相互に中枢神経抑制作用を増強することが考えられている。 |
| オピオイド鎮痛剤 | 作用が増強されることがある。 | 相互に中枢神経抑制作用を増強することが考えられている。 |
| アルコール(飲酒) | 作用が増強されることがある。 | 相互に中枢神経抑制作用を増強することが考えられている。 |
| モノアミン酸化酵素阻害剤 | 作用が増強されることがある。 | 相互に中枢神経抑制作用を増強することが考えられている。 |
| シメチジン、オメプラゾール、エソメプラゾール、ランソプラゾール | 作用が増強されることがある。 | シメチジン・オメプラゾールにより肝臓のCYPによる代謝が阻害され、本剤のクリアランスが減少し、血中濃度が上昇することによる。 本剤の代謝、排泄を遷延させるおそれがある。 |
| シプロフロキサシン | 作用が増強されることがある。 | 本剤のクリアランスがシプロフロキサシンとの併用により低下することが報告されている。 |
| フルボキサミンマレイン酸塩 | 作用が増強されることがある。 | 本剤の代謝が阻害されることにより本剤のクリアランスが低下することが報告されている。 |
| 強いCYP3Aを阻害する薬剤 コビシスタットを含有する製剤、ボリコナゾール等 | 本剤の血中濃度が上昇する可能性がある。 | これら薬剤のCYP3A阻害作用により、本剤の代謝が阻害されるため。 |
| CYP3A4で代謝される薬剤 アゼルニジピン、ホスアンプレナビル等 | 本剤又はこれらの薬剤の作用が増強されるおそれがある。 | 本剤とこれらの薬剤がCYP3A4を競合的に阻害することにより、相互のクリアランスが低下すると考えられる。 |
| エトラビリン | 本剤の血中濃度が上昇する可能性がある。 | エトラビリンのCYP2C9、CYP2C19阻害作用により、本剤の代謝が阻害される。 |
| マプロチリン塩酸塩 | 中枢神経抑制作用を増強することがある。 | 相互に中枢神経抑制作用を増強することが考えられている。 |
| ミルタザピン | 鎮静作用が増強されるおそれがある。また、ミルタザピンとの併用により精神運動機能及び学習獲得能力が減退するとの報告がある。 | 相加的な鎮静作用を示すことが考えられる。 |
| バルプロ酸ナトリウム | 本剤の作用が増強することがある。 | 本剤の非結合型の血中濃度を上昇させる。 |
| ダントロレンナトリウム水和物、ボツリヌス毒素製剤 | 筋弛緩作用を増強することがある。 | 相互に筋弛緩作用を増強することが考えられている。 |
| リファンピシン | 本剤の血中濃度が低下し、作用が減弱するおそれがある。 | リファンピシンのCYP3A4誘導作用により、本剤の代謝が誘導され、血中濃度が低下する可能性がある。 |
| アパルタミド | 本剤の血中濃度が低下し、作用が減弱するおそれがある。 | アパルタミドのCYP2C19誘導作用により、本剤の代謝が誘導され、血中濃度が低下する可能性がある。 |
| シナカルセト、エボカルセト | これら薬剤の血中濃度に影響を与えるおそれがある。 | 血漿蛋白結合率が高いことによる。 |
| 無水カフェイン | 本剤の血中濃度が減少することがある。 | 不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 依存性、離脱症状(いずれも頻度不明注))
連用により薬物依存を生じることがあるので、観察を十分に行い、用量及び使用期間に注意し慎重に投与すること。[8.4参照]
11.1.2 刺激興奮、錯乱等(いずれも頻度不明注))
11.1.3 呼吸抑制(頻度不明注))
注)同一有効成分又は類薬で報告されており、国内でも発生が予想される副作用。
11.2 その他の副作用
| 10%以上 | 5〜10%未満 | 頻度不明注) | |
| 精神神経系 | 傾眠 | 意識レベルの低下 | 眠気、ふらつき、眩暈、頭痛、言語障害、振戦、複視、霧視、眼振、失神、失禁、歩行失調、多幸症 |
| 肝臓 | − | − | 黄疸 |
| 血液 | − | 貧血 | 顆粒球減少、白血球減少 |
| 循環器 | − | − | 血圧低下、頻脈、徐脈 |
| 呼吸器 | − | 口腔咽頭不快感 | − |
| 消化器 | − | − | 悪心、嘔吐、便秘、口渇、食欲不振 |
| 過敏症 | − | − | 発疹 |
| その他 | − | − | 倦怠感、脱力感、浮腫 |
13. 過量投与
13.1 処置
本剤の過量投与が明白又は疑われた場合の処置としてフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与する場合には、使用前にフルマゼニルの使用上の注意を必ず読むこと。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 本剤は鼻腔内投与のみで使用するよう患者及び保護者(家族)又はそれに代わる適切な者に指導すること。
14.1.2 冷蔵又は凍結しないよう指導すること。
14.1.3 本剤は1回使用の製剤である。本剤は空打ちや再使用しないよう指導すること。
15. その他の注意
15.1 臨床使用に基づく情報
投与した薬剤が特定されないままにフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与された患者で、新たに本剤を投与する場合、本剤の鎮静・抗けいれん作用が変化、遅延するおそれがある。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
(1)日本人健康成人に本剤(5、10、20mg)を単回鼻腔内投与した時のジアゼパム及び代謝物デスメチルジアゼパムの薬物動態パラメータを以下に示す1)。
| Cmax(ng/mL) | Tmax(h) | AUCt(ng・h/mL) | T1/2(h) | |
| 5mg (30例) | 135.08±52.818 | 1.500[0.75,4.00] | 5096.6±1610.49 | 56.23±21.142 |
| 10mg (27例) | 225.85±88.078 | 2.000[0.75,8.00] | 10389.0±3109.79 | 54.82±20.916 |
| 20mg (30例) | 418.13±139.559 | 2.000[0.50,8.00] | 18982.1±5420.69 | 55.92±22.413 |
| Cmax(ng/mL) | Tmax(h) | AUCinf(ng・h/mL) | T1/2(h) | |
| 5mg (30例) | 28.52±6.342 | 96.000[36.00,144.00] | 9932.7±5579.31a) | 205.38±140.003a) |
| 10mg (27例) | 53.19±12.588 | 96.000[36.00,192.00] | 15648.0±7023.83b) | 159.39±99.629b) |
| 20mg (30例) | 98.26±28.594 | 96.000[36.00,240.00] | 29156.6±11199.01c) | 168.12±107.339c) |
(2)外国人健康成人に本剤(5、10、20mg)を単回鼻腔内投与した時又は4時間間隔で2回鼻腔内投与した時のジアゼパム及び代謝物デスメチルジアゼパムの薬物動態パラメータを以下に示す2)。
| Cmax(ng/mL) | Tmax(h) | AUCinf(ng・h/mL) | T1/2(h) | |
| 単回鼻腔内投与 | ||||
| 5mg (32例) | 85.6±57.5 | 1.50[0.33,8] | 2411±1164a) | 70±30a) |
| 10mg (31例) | 133.6±85.7 | 1.50[0.75,36] | 4505±2528b) | 71±32b) |
| 20mg (32例) | 235.3±138.0 | 1.38[0.50,8] | 9168±5055c) | 74±36c) |
| 4時間間隔で2回鼻腔内投与 | ||||
| 10mg/回 (29例) | 180.2±122.1 | 5.25[0.50,12] | 7936±4535a) | 74±33a) |
| Cmax(ng/mL) | Tmax(h) | AUCinf(ng・h/mL) | T1/2(h) | |
| 単回鼻腔内投与 | ||||
| 5mg (32例) | 11.7±5.6 | 96[8,240] | 3229±1626a) | 91±46a) |
| 10mg (31例) | 19.3±11.8 | 96[12,240] | 4503±1651a) | 68±20a) |
| 20mg (32例) | 36.6±20.8 | 96[36,240] | 8838±5219b) | 85±27b) |
| 4時間間隔で2回鼻腔内投与 | ||||
| 10mg/回 (29例) | 32.1±17.8 | 144[24,240] | 10840±2446c) | 69±15c) |
16.1.2 てんかん患者
(1)6歳以上66歳未満のてんかん患者を対象に、本剤を年齢及び体重に応じた用量(5〜20mg注))を単回鼻腔内投与した時のジアゼパムの薬物動態パラメータを以下に示す。ジアゼパムの薬物動態パラメータは発作時と非発作時で類似していた3)(外国人データ)。
注)6歳以上12歳未満は0.3mg/kg、12歳以上は0.2mg/kgを目安として設定された。
| Cmax(ng/mL) | Tmax(h) | AUC0-6h(ng・h/mL) | ||
| 非発作時 | 全体 (47例) | 189±110 | 2.00[0.47,12.00] | 615±368 |
| 10mg (11例) | 213±145 | 2.05[0.78,6.00] | 719±519 | |
| 15mg (14例) | 176±106 | 1.88[0.47,5.23] | 570±340 | |
| 20mg (22例) | 185±95 | 2.00[0.75,12.00] | 592±297 | |
| 発作時 | 全体 (47例) | 164±88 | 2.17[0.50,12.3] | 532±313 |
| 10mg (11例) | 163±84 | 1.77[1.00,3.18] | 534±352 | |
| 15mg (15例) | 165±100 | 3.18[0.50,12.3] | 550±358 | |
| 20mg (21例) | 163±85 | 2.83[0.75,8.08] | 518±270 |
(2)2歳以上6歳未満の小児てんかん患者を対象に本剤を年齢及び体重に応じた用量(5〜15mg注))で単回鼻腔内投与した時のジアゼパムの薬物動態パラメータを以下に示す4)(外国人データ)。
注)0.5mg/kgを目安として設定された。
| Cmax(ng/mL) | Tmax(h) | AUC0-6h(ng・h/mL) | ||
| 2,3歳 | 5mg (3例) | 94.3±60.3 | 5.35[2.10,6.13] | 391±212 |
| 10mg (15例) | 269.3±258.8 | 3.08[1.37,6.07] | 1042±1027 | |
| 4,5歳 | 10mg (13例) | 279.9±198.6 | 3.15[1.20,6.07] | 1038±764a) |
| 15mg (4例) | 243.1±249.4 | 4.43[1.37,6.05] | 847±776 |
16.2 吸収
ジアゼパム静脈内投与に対する本剤投与時の絶対的バイオアベイラビリティ(AUC0-∞の幾何平均値比)は97%であった5)(外国人データ)。
16.3 分布
ジアゼパム及びその代謝物デスメチルジアゼパムの血漿蛋白結合率はいずれも98%であった6)(外国人データ)。
16.4 代謝
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
6歳以上18歳未満のてんかん重積状態又はてんかん重積状態に移行するおそれのある発作を有する患者を対象とした本剤の有効性及び安全性を検討する非盲検非対照試験が実施された。本剤の用法・用量は、患者の年齢及び体重に応じた用量(5〜20mg注))を単回鼻腔内投与することとされた。発作がコントロールできない場合や再発が認められた場合は、4時間以上あけて2回目を投与することとされた。
注)6歳以上12歳未満は0.3mg/kg、12歳以上は0.2mg/kgを目安として設定された。
本試験では以下のいずれかの運動症状が持続していることを目視により確認した後、本剤を単回鼻腔内投与した。
・単発のけいれん発作が5分以上持続している
・けいれん発作が1時間に3回以上発現し、現在もけいれん発作が持続している
・意識が回復することなく連続して2回以上のけいれんが発現し、現在もけいれん発作が持続している
17.1.2 海外第III相試験
6歳以上66歳未満のてんかん患者を対象とした本剤の安全性を検討する非盲検非対照試験が実施された。本剤の用法・用量は、患者の年齢及び体重に応じた用量(5〜20mg注))を単回鼻腔内投与することとされた。発作がコントロールできない場合や再発が認められた場合は、4時間以上あけて2回目を投与することとされた。
注)6歳以上12歳未満は0.3mg/kg、12歳以上は0.2mg/kgを目安として設定された。
本剤2回目の投与が必要とされた発作は、12カ月間における4390回のうち485回であった。
副作用発現率は18.4%(30/163例)であった。主な副作用は、鼻部不快感6.1%(10/163例)、頭痛2.5%(4/163例)、鼻出血、味覚異常、傾眠各1.8%(3/163例)、咳嗽、鼻痛、鼻漏、片頭痛、眼刺激、流涙増加及び疲労各1.2%(2/163例)であった9)(外国人データ)。
副作用発現率は18.4%(30/163例)であった。主な副作用は、鼻部不快感6.1%(10/163例)、頭痛2.5%(4/163例)、鼻出血、味覚異常、傾眠各1.8%(3/163例)、咳嗽、鼻痛、鼻漏、片頭痛、眼刺激、流涙増加及び疲労各1.2%(2/163例)であった9)(外国人データ)。
17.1.3 海外第I/II相試験
2歳以上6歳未満の小児てんかん患者を対象とした本剤の安全性を検討する非盲検非対照試験が実施された。本剤の用法・用量は、患者の年齢及び体重に応じた用量(5〜15mg注))を単回鼻腔内投与することとされた。発作がコントロールできない場合や再発が認められた場合は、4時間以上あけて2回目を投与することとされた。
注)0.5mg/kgを目安として設定された。
本剤2回目の投与が必要とされた発作は、24カ月間における385回のうち45回であった。
副作用発現率は20.0%(7/35例)であった。副作用は鼻粘膜障害、鼻浮腫、鼻漏、眼瞼炎、嘔吐、投与部位疼痛、誤嚥性肺炎及び傾眠各2.9%(1/35例)であった10)(外国人データ)。
副作用発現率は20.0%(7/35例)であった。副作用は鼻粘膜障害、鼻浮腫、鼻漏、眼瞼炎、嘔吐、投与部位疼痛、誤嚥性肺炎及び傾眠各2.9%(1/35例)であった10)(外国人データ)。
18. 薬効薬理
18.1 作用機序
ジアゼパムのGABAA受容体のベンゾジアゼピン結合部位に結合し、GABA作動性神経伝達を亢進すると考えられている。
19. 有効成分に関する理化学的知見
19.1. ジアゼパム
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<スピジア点鼻液5mg>
0.1mL[1容器]
<スピジア点鼻液7.5mg>
0.1mL[1容器]
<スピジア点鼻液10mg>
0.1mL[1容器]
23. 主要文献
- 社内資料:日本人健康成人を対象としたジアゼパムの薬物動態試験(2025年6月24日承認、CTD2.7.2.2.4)
- 社内資料:外国人健康成人を対象としたジアゼパムの薬物動態試験(2025年6月24日承認、CTD2.7.2.2.1)
- 社内資料:外国人てんかん患者を対象としたジアゼパムの薬物動態試験(2025年6月24日承認、CTD2.7.2.3.2)
- 社内資料:外国人小児てんかん患者を対象としたジアゼパムの薬物動態試験(2025年6月24日承認、CTD2.7.2.2.5)
- 社内資料:外国人健康成人を対象としたジアゼパムのバイオアベイラビリティ試験(2025年6月24日承認、CTD2.7.1.2.1)
- 社内資料:ジアゼパムの分布(2025年6月24日承認、CTD2.6.4.4)
- 社内資料:ジアゼパムの代謝(2025年6月24日承認、CTD2.6.4.5)
- 社内資料:ジアゼパムの国内第III相臨床試験(2025年6月24日承認、CTD2.7.6.7)
- 社内資料:ジアゼパムの海外第III相臨床試験(2025年6月24日承認、CTD2.7.6.8)
- 社内資料:ジアゼパムの海外第I/II相臨床試験(2025年6月24日承認、CTD2.7.6.6)
24. 文献請求先及び問い合わせ先
文献請求先
アキュリスファーマ株式会社
製品情報担当
〒107-0061
東京都港区北青山2-14-4
電話:0120-46-4193
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
製品情報問い合わせ先
アキュリスファーマ株式会社
製品情報担当
〒107-0061
東京都港区北青山2-14-4
電話:0120-46-4193
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
25. 保険給付上の注意
本剤は厚生労働省告示第97号(平成20年3月19日付)に基づき、投薬量は1回14日分を限度とされています。
26. 製造販売業者等
26.1 製造販売元
アキュリスファーマ株式会社
東京都港区北青山2-14-4 the ARGYLE aoyama 6F
26.2 販売提携
ヴィアトリス製薬合同会社
東京都港区麻布台一丁目3番1号