医薬品情報
| 総称名 | カペシタビン |
|---|---|
| 一般名 | カペシタビン |
| 欧文一般名 | Capecitabine |
| 製剤名 | カペシタビン錠 |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4223 |
| ATCコード | L01BC06 |
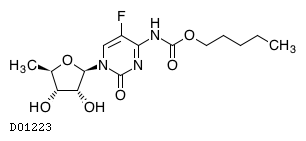
| KEGG DRUG |
D01223
カペシタビン
|
| KEGG DGROUP |
DG02018
代謝拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カペシタビン錠300mg「タカタ」 (後発品) | Capecitabine Tablets"TAKATA" | ダイト | 4223005F1090 | 54.1円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
1.1 本剤を含むがん化学療法は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤が適切と判断される症例についてのみ実施すること。適応患者の選択にあたっては、本剤及び各併用薬剤の添付文書を参照して十分注意すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<手術不能又は再発乳癌>
5.1 本剤の術後補助化学療法における有効性及び安全性は確立していない。
5.2 単剤投与を行う場合には、アントラサイクリン系抗悪性腫瘍剤を含む化学療法の増悪若しくは再発例に限る。
5.3 併用療法に関して、初回化学療法における有効性及び安全性は確立していない。
6. 用法及び用量
手術不能又は再発乳癌にはA法又はB法を使用し、ラパチニブトシル酸塩水和物と併用する場合にはC法を使用する。結腸・直腸癌における補助化学療法にはB法を使用し、オキサリプラチンと併用する場合にはC法を使用する。治癒切除不能な進行・再発の結腸・直腸癌には他の抗悪性腫瘍剤との併用でC法又はE法を使用する。直腸癌における補助化学療法で放射線照射と併用する場合にはD法を使用する。胃癌には白金製剤との併用でC法を使用する。
A法
体表面積にあわせて次の投与量を朝食後と夕食後30分以内に1日2回、21日間連日経口投与し、その後7日間休薬する。
これを1コースとして投与を繰り返す。
これを1コースとして投与を繰り返す。
| 体表面積 | 1回用量 |
| 1.31m2未満 | 900mg |
| 1.31m2以上1.64m2未満 | 1,200mg |
| 1.64m2以上 | 1,500mg |
B法
体表面積にあわせて次の投与量を朝食後と夕食後30分以内に1日2回、14日間連日経口投与し、その後7日間休薬する。
これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
| 体表面積 | 1回用量 |
| 1.33m2未満 | 1,500mg |
| 1.33m2以上1.57m2未満 | 1,800mg |
| 1.57m2以上1.81m2未満 | 2,100mg |
| 1.81m2以上 | 2,400mg |
C法
体表面積にあわせて次の投与量を朝食後と夕食後30分以内に1日2回、14日間連日経口投与し、その後7日間休薬する。
これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
| 体表面積 | 1回用量 |
| 1.36m2未満 | 1,200mg |
| 1.36m2以上1.66m2未満 | 1,500mg |
| 1.66m2以上1.96m2未満 | 1,800mg |
| 1.96m2以上 | 2,100mg |
D法
体表面積にあわせて次の投与量を朝食後と夕食後30分以内に1日2回、5日間連日経口投与し、その後2日間休薬する。
これを繰り返す。なお、患者の状態により適宜減量する。
これを繰り返す。なお、患者の状態により適宜減量する。
| 体表面積 | 1回用量 |
| 1.31m2未満 | 900mg |
| 1.31m2以上1.64m2未満 | 1,200mg |
| 1.64m2以上 | 1,500mg |
E法
体表面積にあわせて次の投与量を朝食後と夕食後30分以内に1日2回、14日間連日経口投与し、その後7日間休薬する。
これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
| 体表面積 | 1回用量 |
| 1.31m2未満 | 900mg |
| 1.31m2以上1.69m2未満 | 1,200mg |
| 1.69m2以上2.07m2未満 | 1,500mg |
| 2.07m2以上 | 1,800mg |
7. 用法及び用量に関連する注意
<効能共通>
7.1 各用法の開始用量(1回用量)は以下の体表面積あたりの用量から算出している。
・A法:825mg/m2
・B法:1,250mg/m2
・C法:1,000mg/m2
・D法:825mg/m2
・E法:800mg/m2
7.2 休薬・減量について
7.2.1 B法及びC法において副作用が発現した場合には、以下の規定を参考にして休薬・減量を行うこと。なお、胃癌における術後補助化学療法においてGrade2の非血液毒性が発現した場合には、以下のGrade3の休薬・減量規定を参考にして休薬・減量を考慮すること。
| NCIによる毒性のGrade判定注) | 治療期間中の処置 | 治療再開時の投与量 | |
| Grade1 | 休薬・減量不要 | 減量不要 | |
| Grade2 | 初回発現 | Grade0-1に軽快するまで休薬 | 減量不要 |
| 2回目発現 | Grade0-1に軽快するまで休薬 | 減量段階1 | |
| 3回目発現 | Grade0-1に軽快するまで休薬 | 減量段階2 | |
| 4回目発現 | 投与中止・再投与不可 | − | |
| Grade3 | 初回発現 | Grade0-1に軽快するまで休薬 | 減量段階1 |
| 2回目発現 | Grade0-1に軽快するまで休薬 | 減量段階2 | |
| 3回目発現 | 投与中止・再投与不可 | − | |
| Grade4 | 初回発現 | 投与中止・再投与不可 あるいは治療継続が患者にとって望ましいと判定された場合は、Grade0-1に軽快するまで投与中断 | 減量段階2 |
上記の休薬・減量の規定に応じて減量を行う際、以下の用量を参考にすること。
| 体表面積 | 1回用量 | |
| 減量段階1 | 減量段階2 | |
| 1.13m2未満 | 900mg | 600mg |
| 1.13m2以上1.21m2未満 | 1,200mg | |
| 1.21m2以上1.45m2未満 | 900mg | |
| 1.45m2以上1.69m2未満 | 1,500mg | |
| 1.69m2以上1.77m2未満 | 1,200mg | |
| 1.77m2以上 | 1,800mg | |
| 体表面積 | 1回用量 | |
| 減量段階1 | 減量段階2 | |
| 1.41m2未満 | 900mg | 600mg |
| 1.41m2以上1.51m2未満 | 1,200mg | |
| 1.51m2以上1.81m2未満 | 900mg | |
| 1.81m2以上2.11m2未満 | 1,500mg | |
| 2.11m2以上 | 1,200mg | |
7.2.2 一旦減量した後に増量は行わないこと。
注)B法による国内臨床試験においてはNCI-CTC(Ver.2.0)によりGradeを判定した。手足症候群は以下の判定基準に従った。また、C法による国内臨床試験においては手足症候群も含めてCTCAE v3.0又はCTCAE v4.03によりGradeを判定した。
| Grade | 臨床領域 | 機能領域 |
| 1 | しびれ、皮膚知覚過敏、ヒリヒリ・チクチク感、無痛性腫脹、無痛性紅斑 | 日常生活に制限を受けることはない症状 |
| 2 | 腫脹を伴う有痛性皮膚紅斑 | 日常生活に制限を受ける症状 |
| 3 | 湿性落屑、潰瘍、水疱、強い痛み | 日常生活を遂行できない症状 |
| 該当する症状のGradeが両基準(臨床領域、機能領域)で一致しない場合は、より適切と判断できるGradeを採用する | ||
<治癒切除不能な進行・再発の結腸・直腸癌>
<胃癌における術後補助化学療法>
7.4 本剤と併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知した上で、患者の状態やがん化学療法歴に応じて選択すること。[17.1.12参照]
<結腸癌及び胃癌における術後補助化学療法>
7.5 投与期間が8コースを超えた場合の有効性及び安全性は確立していない。
8. 重要な基本的注意
8.2 本剤投与中は定期的(特に投与初期は頻回)に臨床検査(血液検査、肝機能・腎機能検査等)を行うなど、患者の状態を十分に観察すること。[9.1.2、9.2.2、11.1.4-11.1.6、11.1.13参照]
8.3 感染症・出血傾向の発現又は悪化に十分注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
9.2.2 腎障害のある患者(重篤な腎障害のある患者を除く)
9.3 肝機能障害患者
9.4 生殖能を有する者
9.4.1 生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.4.2 妊娠可能な女性患者には、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.4.3 パートナーが妊娠する可能性のある男性患者には、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[15.2参照]
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。動物実験(マウス)において、乳汁への移行(198mg/kg 単回投与)が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。特に80歳以上の高齢者において、重症の下痢、嘔気、嘔吐等の発現率が上昇したとの報告がある。
10. 相互作用
相互作用序文
本剤が肝チトクロームP450(CYP2C9)の酵素蛋白合成系に影響し、酵素活性が低下する可能性があるので、CYP2C9で代謝を受ける薬剤と併用する場合に併用薬剤の血中濃度が上昇するおそれがある。
薬物代謝酵素用語
CYP2C9
10.1 併用禁忌
10.2 併用注意
| ワルファリンカリウム [1.3、16.7.1参照] | 併用開始数日後から本剤投与中止後1ヶ月以内の期間に血液凝固能検査値異常、出血の発現が報告されている。定期的に血液凝固能検査(プロトロンビン時間、INR等)を行い、必要に応じて適切な処置を行うこと。 | 本剤が肝チトクロームP450(CYP2C9)の酵素蛋白合成系に影響し、酵素活性が低下している可能性が考えられている。 |
| フェニトイン | フェニトインの血中濃度が上昇したとの報告があるので、フェニトインの血中濃度の変化に注意すること。 | 本剤が肝チトクロームP450(CYP2C9)の酵素蛋白合成系に影響し、酵素活性が低下している可能性が考えられている。 |
| トリフルリジン・チピラシル塩酸塩配合剤 | 副作用が増強するおそれがある。 | フッ化ピリミジン系抗悪性腫瘍剤の代謝に影響を及ぼす可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 脱水症状(頻度不明注1))
激しい下痢(初期症状:腹痛、頻回の軟便等)があらわれ脱水症状まで至ることがある。このような症状があらわれた場合には、投与を中止し補液、電解質投与等の適切な処置を行うこと。
11.1.2 手足症候群(Hand-foot syndrome)(頻度不明注1))
手掌及び足底に湿性落屑、皮膚潰瘍、水疱、疼痛、知覚不全、有痛性紅斑、腫脹等の手足症候群があらわれることがある。
11.1.3 心障害(頻度不明注1))
心筋梗塞、狭心症、律動異常、心停止、心不全、突然死、心電図異常(心房性不整脈、心房細動、心室性期外収縮等)等の心障害があらわれることがある。[9.1.1参照]
11.1.4 肝障害、黄疸(頻度不明注1))
肝機能検査値異常、黄疸を伴う肝障害があらわれ、肝不全に至った症例も報告されている。なお、肝機能検査値異常を伴わない黄疸があらわれることが報告されている。[8.2参照]
11.1.5 腎障害(頻度不明)
腎機能検査値異常を伴う腎障害があらわれることがある。[8.2参照]
11.1.6 骨髄抑制(頻度不明注1))
11.1.7 口内炎(頻度不明注1))
口内炎(粘膜炎、粘膜潰瘍、口腔内潰瘍等)があらわれることがある。有痛性の紅斑、口内潰瘍、舌潰瘍等が認められた場合には、投与を中止し適切な処置を行うこと。
11.1.8 間質性肺炎(頻度不明)
間質性肺炎(初期症状:咳嗽、息切れ、呼吸困難、発熱等)があらわれることがある。異常が認められた場合には投与を中止し、胸部X線等の検査を行い、副腎皮質ホルモン剤を投与するなど適切な処置を行うこと。
11.1.9 重篤な腸炎(頻度不明)
出血性腸炎、虚血性腸炎、壊死性腸炎等があらわれることがある。激しい腹痛・下痢・血便等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.10 重篤な精神神経系障害(白質脳症等)(頻度不明)
歩行障害、麻痺、錐体外路症状、失調、協調運動障害、平衡障害、構音障害、意識障害、嗜眠、錯乱、健忘、指南力低下、知覚障害、尿失禁等があらわれることがある。また、このような症状が白質脳症等の初期症状としてあらわれることがある。
11.1.11 血栓塞栓症(頻度不明)
深部静脈血栓症、脳梗塞、肺塞栓症等があらわれることがある。
11.1.12 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.1.13 溶血性貧血(頻度不明)[8.2参照]
注1)国内外の臨床試験及び自発報告で報告され、頻度を算出できない副作用
11.2 その他の副作用
| 10%以上注2) | 10%未満注2) | 頻度不明注1) | |
| 精神神経系 | 味覚異常、頭痛、浮動性めまい | 不眠症、うつ病、錯感覚 | |
| 消化器 | 悪心(33.2%)、食欲不振(30.5%)、嘔吐 | 便秘、腹痛、上腹部痛、口唇炎 | 消化不良、鼓腸、食道炎、十二指腸炎、胃腸出血、胃炎、口内乾燥、軟便、口渇、胃不快感 |
| 循環器 | 胸痛、下肢浮腫、心筋症、心筋虚血、頻脈 | ||
| 呼吸器 | 咳嗽 | 呼吸困難 | |
| 血液 | 赤血球数減少(26.2%)、白血球数減少(24.8%)、リンパ球数減少(21.5%)、ヘモグロビン減少 | ヘマトクリット減少、血小板数減少、単球数増加、プロトロンビン時間延長、好中球数減少 | 貧血 |
| 皮膚 | 色素沈着障害 | 発疹、脱毛症 | 爪の異常(爪甲離床症、脆弱爪、爪変色、爪ジストロフィー等)、紅斑性皮疹、皮膚亀裂、光線過敏、放射線照射リコール症候群、皮膚乾燥、剥脱性皮膚炎、皮膚落屑、そう痒症、皮膚炎 |
| 眼 | 眼障害(結膜炎、角膜炎、眼刺激等)、流涙増加 | ||
| 肝臓・腎臓 | 血中ビリルビン増加(24.2%)、AST増加、LDH増加、ALT増加、Al-P増加 | 尿沈渣陽性、蛋白尿、BUN増加、尿中ブドウ糖陽性 | 肝機能異常、血中クレアチニン増加 |
| その他 | 倦怠感、体重減少、発熱、血中ブドウ糖増加 | 鼻咽頭炎、体重増加、疲労、背部痛、血中アルブミン減少、関節痛、血圧上昇 | 無力症、脱力、四肢痛、電解質異常、胸痛、筋痛、高トリグリセリド血症 |
| 10%以上注3) | 10%未満注3) | 頻度不明注1) | |
| 精神神経系 | 神経毒性(末梢性感覚ニューロパシー、末梢性運動ニューロパシー等)(93.9%)、味覚異常(32.3%)、神経痛 | 浮動性めまい、頭痛、不眠症 | 錯感覚、異常感覚、感覚鈍麻 |
| 消化器 | 悪心(82.9%)、食欲不振(75.0%)、嘔吐(40.9%)、便秘、腹痛 | 口唇炎、胃不快感、下腹部痛、歯周病、歯痛、歯肉出血、上腹部痛、齲歯、歯肉炎 | 消化不良、口内乾燥 |
| 呼吸器 | 鼻出血 | 鼻漏、発声障害、鼻粘膜障害、咽喉痛、しゃっくり | 呼吸困難 |
| 血液 | 好中球数減少(66.5%)、血小板数減少(35.4%)、白血球数減少 | ヘモグロビン減少、貧血、リンパ球数減少 | 発熱性好中球減少症 |
| 皮膚 | 色素沈着障害(35.4%)、発疹 | 爪の障害、脱毛症、爪囲炎、蕁麻疹、皮膚乾燥、そう痒症 | |
| 眼 | 流涙増加、霧視 | ||
| 肝臓・腎臓 | 蛋白尿、AST増加、肝機能異常 | 血尿、ALT増加、血中ビリルビン増加、Al-P増加、γ-GTP増加、血中アルブミン減少 | |
| その他 | 疲労(57.9%)、注射部位反応(疼痛、血管炎、紅斑、腫脹等)(40.9%)、過敏症、倦怠感、体重減少 | 背部痛、胸部不快感、潮紅、膀胱炎、高血圧、発熱、上気道感染(鼻咽頭炎等)、四肢痛、浮腫、関節痛、筋骨格痛、起立性低血圧、血中リン減少、CRP増加、頻脈 | 無力症、温度変化不耐症、低カリウム血症、顎痛、低ナトリウム血症、悪寒、粘膜の炎症、口腔カンジダ症、疼痛、高トリグリセリド血症 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
フルオロウラシルの異化代謝酵素であるジヒドロピリミジンデヒドロゲナーゼ(DPD)欠損等の患者がごくまれに存在し、このような患者にフルオロウラシル系薬剤を投与した場合、投与初期に重篤な副作用(口内炎、下痢、血液障害、神経障害等)が発現するとの報告がある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 A法で投与した場合の血漿中濃度
固形癌患者12名にカペシタビン829mg/m2注1)を食後に単回経口投与したとき、カペシタビン、5'-DFCR、5'-DFUR及び5-FUは、投与後1.1〜1.3時間でCmaxに到達し、半減期0.4〜0.8時間で減少した。5-FUのAUClastは、5'-DFURの約1/20であった4)。
| 化合物 | Tmax(h) | Cmax(μg/mL) | AUClast(μg・h/mL) | t1/2(h) |
| カペシタビン | 1.1±0.7 | 4.85±3.74 | 4.77±2.51 | 0.42±0.70 |
| 5'-DFCR | 1.3±0.7 | 5.35±3.04 | 9.63±4.25 | 0.79±0.19 |
| 5'-DFUR | 1.3±0.7 | 4.33±2.09 | 6.96±1.66 | 0.67±0.11 |
| 5-FU | 1.3±0.7 | 0.25±0.18 | 0.39±0.20 | 0.69±0.17 |
また固形癌患者16名に251〜1,255mg/m2注1)の投与量で、カペシタビン及び各代謝物のCmax、AUClastは投与量に比例して増加し、初回投与後のカペシタビン及び各代謝物の体内動態は線形性を示すことが示唆された5)。
注1)承認された用法・用量は体表面積にあわせてA法及びD法では1回900〜1,500mgを、B法では1回1,500〜2,400mgを、C法では1回1,200〜2,100mgを、E法では1回900〜1,800mgを1日2回である。
16.1.2 B法で投与した場合の血漿中濃度
結腸・直腸癌患者20名にカペシタビン1,250mg/m2を食後1日2回連日経口投与したときの投与1日目注2)のカペシタビン、5'-DFCR、5'-DFUR及び5-FUの血漿中濃度は、投与後1.7〜2.3時間でCmaxに到達し、半減期0.55〜0.81時間で減少した。投与1日目の5-FUのAUClastは、5'-DFURの約1/30であった。投与14日目の薬物動態パラメータは5-FUを除き、初回投与後の値とほぼ同様であった6)7)。
注2)投与1日目は1,250mg/m2を朝食後に1日1回経口投与した。
| 化合物 | Cmax(μg/mL) | AUClast(μg・h/mL) | n | |||
| 1日目 | 14日目 | 1日目 | 14日目 | 1日目 | 14日目 | |
| カペシタビン | 4.80±1.75 | 4.19±2.55 | 6.91±2.40 | 6.14±1.92 | 20 | 19 |
| 5'-DFCR | 5.95±2.50 | 5.20±1.90 | 15.1±4.31 | 14.1±4.58 | 20 | 19 |
| 5'-DFUR | 6.02±2.49 | 6.59±2.83 | 12.8±3.74 | 13.0±3.31 | 20 | 19 |
| 5-FU | 0.22±0.12 | 0.38±0.21 | 0.45±0.18 | 0.71±0.23 | 20 | 19 |
16.1.3 生物学的同等性
日本人癌患者にカペシタビン錠300mg「タカタ」とゼローダ錠300をクロスオーバー法により、それぞれ5錠(カペシタビンとして1,500mg)を食後に単回経口投与し、血漿中カペシタビン未変化体濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された8)。
| 判定パラメータ | 参考パラメータ | |||
| AUC(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| カペシタビン錠300mg「タカタ」 | 3868±1475 | 2645±1102 | 1.9±1.2 | 0.5±0.2 |
| ゼローダ錠300 | 3968±1807 | 2645±1260 | 2.0±1.2 | 0.4±0.1 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 組織内移行性
16.3.2 腫瘍選択的5-FUの生成
ヒト結腸癌HCT116、CXF280及びCOLO205株(カペシタビン感受性)担癌ヌードマウスにカペシタビン(経口投与)、ドキシフルリジン(5'-DFUR、経口投与)及び5-FU(腹腔内投与)を等毒性用量(長期投与時の最大耐量)投与し、経時的に腫瘍組織、筋肉及び血漿中の5-FU量を測定した。カペシタビン投与マウスで腫瘍組織に選択的に高濃度の5-FUが検出された。腫瘍組織5-FU AUCは筋肉及び血漿中の5-FU AUCに比べカペシタビン投与でそれぞれ22倍及び114〜209倍、5'-DFUR投与でそれぞれ6倍及び21〜34倍高い値を示した。一方、5-FU投与では、5-FUは腫瘍組織ばかりでなく筋肉及び血漿中にも同様に分布した。カペシタビン投与マウスの腫瘍組織5-FU AUCは5'-DFUR及び5-FU投与マウス腫瘍組織5-FU AUCに比べ、それぞれ3.6〜4.3倍及び16〜35倍高い値を示した11)。
16.4 代謝
カペシタビンはカルボキシルエステラーゼにより5'-DFCRに代謝され、さらにシチジンデアミナーゼにより5'-DFURへ変換される。5'-DFURはピリミジンヌクレオシドホスホリラーゼ(PyNPase)(ヒトの場合チミジンホスホリラーゼ、げっ歯類の場合ウリジンホスホリラーゼが関与)により5-FUに変換される12)。
16.5 排泄
結腸・直腸癌患者20名にカペシタビン1,250mg/m2を経口投与したとき、投与後24時間までに投与量の69〜80%に相当する量が尿中へ排泄された。このうち未変化体の尿中排泄率は約3%と低値を示し、FBALは約50%を示した6)7)。
固形癌患者6名に14Cで標識したカペシタビン水溶液2,000mgを食後単回経口投与したとき、7日目までの尿中累積排泄率は投与量の96%に相当し、投与量のほとんどが尿中に排泄された。尿中排泄は、大部分(平均84%)が投与後12時間以内に排泄され、約144時間で完了した。尿中で認められたカペシタビンの代謝物は5'-DFCR、5'-DFUR、5-FU、FUH2、FUPA及びFBALであり、また血漿中に認められた代謝物は5'-DFCR、5'-DFUR、5-FU、FUH2及びFBALであった。血漿中及び尿中における総放射能と各化合物の合計がほぼ同様であったことから、血漿中及び尿中に未知代謝物が存在する可能性は低いことが示唆された13)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
固形癌患者27名の腎機能をクレアチニン・クリアランスによって、正常(>80mL/min)、腎機能障害軽度(51〜80mL/min)、中等度(30〜50mL/min)及び高度(<30mL/min)に分類し、カペシタビン1,255mg/m2注1)を経口投与した際のカペシタビンとその代謝物のAUCinfは以下のとおりであった14)(外国人データ)。[2.3、9.2.2参照]
| 化合物 | クレアチニン・クリアランス(mL/min) | |||
| >80 n=6 | 51-80 n=8 | 30-50 n=6 | <30 n=4 | |
| カペシタビン | 6.24±2.06 | 5.98±3.06 | 7.88±4.32 | 7.79±4.43 |
| 5'-DFCR | 11.6±4.12 | 12.4±2.25 | 13.5±7.18 | 12.0±2.09 |
| 5'-DFUR | 13.7±2.62 | 13.8±3.57 | 19.4±7.16 | 23.4±5.38 |
| 5-FU | 0.87±0.45 | 0.57±0.17 | 0.78±0.27 | 1.07±0.43 |
| FBAL | 39.6±14.6 | 42.6±12.8 | 73.5±28.2 | 142±53.2 |
16.7 薬物相互作用
16.7.1 ワルファリン
16.7.2 その他
ヒト肝ミクロゾーム画分を用いてカペシタビン、5'-DFCR、5'-DFUR、5-FU及びFBALの薬物代謝酵素系(CYP1A2、CYP2A6、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4)への影響をin vitroで検討した。その結果、カペシタビンは臨床上で推定される血漿中非結合型薬物濃度(約0.015mM、5.4μg/mL)の7倍に相当する濃度(0.1mM、約36μg/mL)では阻害は認められなかったが、130倍に相当する高濃度(2mM、約700μg/mL)においてCYP2C9、CYP2E1を50%近く阻害した。一方、代謝物については薬物代謝酵素系への直接的な阻害は認められなかった16)。
固形癌患者12名にカペシタビン1,250mg/m2を食後水酸化アルミニウム、水酸化マグネシウムを含む制酸剤と併用投与したとき、カペシタビン及び5'-DFCRのCmaxは単独投与時と比較して14〜21%上昇したものの、その他の代謝物に影響は認められなかった17)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<手術不能又は再発乳癌>
17.1.1 国内前期第II相臨床試験
前治療1レジメンまでの進行・再発乳癌患者にカペシタビン錠を投与する試験を実施した(1,657mg/m2/日、1日2回分割投与、21日間投与・7日間休薬)。有効性解析対象例22例に対する奏効率は45.5%(10/22)であった18)。副作用は19/23例(82.6%)に発現した。主な副作用は、総ビリルビン上昇10例(43.5%)、赤血球減少10例(43.5%)、皮膚色素沈着7例(30.4%)、LDH上昇7例(30.4%)、白血球減少7例(30.4%)等であった。
17.1.2 国内後期第II相臨床試験
前治療1レジメンまでの進行・再発乳癌患者にカペシタビン錠を投与する試験を実施した(1,657mg/m2/日、1日2回分割投与、21日間投与・7日間休薬)。有効性解析対象例46例に対する奏効率は28.3%(13/46)であった19)。副作用は50/50例(100.0%)に発現した。主な副作用は、手足症候群33例(66.0%)、赤血球減少26例(52.0%)、白血球減少25例(50.0%)、リンパ球減少25例(50.0%)、顆粒球減少19例(38.0%)、ビリルビン値上昇17例(34.0%)等であった。
17.1.3 国内後期第II相臨床試験
ドセタキセル無効の進行・再発乳癌患者にカペシタビン錠を投与する試験を実施した(1,657mg/m2/日、1日2回分割投与、21日間投与・7日間休薬)。有効性解析対象例55例に対する奏効率は20.0%(11/55)であった20)。副作用は58/60例(96.7%)に発現した。主な副作用は、手足症候群36例(60.0%)、AST上昇29例(48.3%)、リンパ球減少26例(43.3%)、LDH上昇26例(43.3%)、赤血球減少25例(41.7%)、食欲不振24例(40.0%)、悪心22例(36.7%)、Al-P上昇18例(30.0%)、白血球減少18例(30.0%)、ビリルビン値上昇18例(30.0%)、顆粒球減少18例(30.0%)等であった。
17.1.4 国内第II相臨床試験
タキサン系薬剤(パクリタキセル又はドセタキセル)無効の進行・再発乳癌患者にカペシタビン錠を投与する試験を実施した(2,500mg/m2/日、1日2回分割投与、14日間投与・7日間休薬)。有効性解析対象例32例に対する奏効率は21.9%(7/32)であった21)。副作用は35/35例(100.0%)に発現した。主な副作用は、手足症候群29例(82.9%)、悪心19例(54.3%)、食欲不振18例(51.4%)、口内炎16例(45.7%)、下痢14例(40.0%)、嘔吐11例(31.4%)等であった。
17.1.5 海外第II相臨床試験
17.1.6 海外第II相臨床試験
パクリタキセル又はドセタキセル無効の進行・再発乳癌患者にカペシタビン錠を投与する試験を実施した(2,510mg/m2/日、1日2回分割投与、14日間投与・7日間休薬)。有効性解析対象例69例に対する奏効率は24.6%(17/69)であった24)。副作用は66/74例(89.2%)に発現した。主な副作用は、手足症候群46例(62.2%)、下痢43例(58.1%)、悪心41例(55.4%)、嘔吐27例(36.5%)、口内炎25例(33.8%)等であった。
<結腸癌における術後補助化学療法>
17.1.7 海外第III相臨床試験
外科的切除が実施されたDukes Cの結腸癌患者(1,987例)を対象に、フルオロウラシル・ホリナート療法(5-FU/LV療法、Mayoレジメン注1))又はカペシタビン錠を単独投与する試験を実施した(カペシタビン錠:1,250mg/m2/日、1日2回、14日間投与・7日間休薬)。その結果、無病生存期間、無再発生存期間、全生存期間において、カペシタビン錠の5-FU/LV療法に対する非劣性が確認された25)26)。
注1)本試験における5-FU/LV療法は国内で承認されているレボホリナート・フルオロウラシル療法及びレボホリナート・フルオロウラシル持続静注併用療法の用法・用量とは異なる。
副作用はカペシタビン錠群では868/995例(87.2%)に発現した。主な副作用は、手足症候群594例(59.7%)、下痢458例(46.0%)、悪心326例(32.8%)等であった(カットオフ日:2004年4月1日)。
17.1.8 海外第III相臨床試験
外科的切除が実施されたDukes Cの結腸癌患者(1,886例)を対象に、フルオロウラシル・ホリナート療法(5-FU/LV療法、Mayoレジメン注1)又はRoswell Parkレジメン)又はXELOX療法(カペシタビン錠とオキサリプラチン併用)を行う試験を実施した(カペシタビン錠:1,000mg/m21日2回、14日間投与・7日間休薬)。その結果、無病生存期間においてXELOX療法の5-FU/LV療法に対する優越性が確認された27)。
副作用はXELOX療法では921/938例(98%)に発現した。主な副作用は、神経毒性730例(78%)、悪心618例(66%)、下痢564例(60%)、嘔吐406例(43%)、疲労325例(35%)、手足症候群273例(29%)等であった28)。
副作用はXELOX療法では921/938例(98%)に発現した。主な副作用は、神経毒性730例(78%)、悪心618例(66%)、下痢564例(60%)、嘔吐406例(43%)、疲労325例(35%)、手足症候群273例(29%)等であった28)。
<治癒切除不能な進行・再発の結腸・直腸癌>
17.1.9 国内第I/II相臨床試験
進行・転移性結腸・直腸癌患者を対象にXELOX療法(本剤とオキサリプラチン併用)、XELOX+BV療法(XELOX療法とベバシズマブ併用)を行う試験を実施した(本剤:1,000mg/m21日2回、14日間投与・7日間休薬)。進行・転移性結腸・直腸癌患者に対するXELOX療法の奏効率は66.7%(4/6)であり、XELOX+BV療法の奏効率は71.9%(41/57)であった。また、XELOX+BV療法の無増悪生存期間(PFS)の中央値は336.0日(95%信頼区間:293-380日)であった。副作用はXELOX療法では6/6例(100.0%)、XELOX+BV療法では58/58例(100.0%)に発現した。主な副作用は、XELOX療法では悪心6例(100.0%)、末梢性感覚ニューロパシー6例(100.0%)、食欲不振5例(83.3%)、下痢4例(66.7%)、手足症候群4例(66.7%)、疲労4例(66.7%)、発疹3例(50.0%)、好中球数減少3例(50.0%)、しゃっくり3例(50.0%)等であり、XELOX+BV療法では末梢性感覚ニューロパシー54例(93.1%)、食欲不振50例(86.2%)、疲労48例(82.8%)、手足症候群44例(75.9%)、悪心43例(74.1%)、色素沈着障害34例(58.6%)、下痢32例(55.2%)、口内炎31例(53.4%)、好中球数減少29例(50.0%)等であった。[7.3参照]
17.1.10 海外第III相臨床試験
転移性結腸・直腸癌患者2,035例を対象に、オキサリプラチン・フルオロウラシル・ホリナート療法(FOLFOX4療法)、FOLFOX4療法+プラセボ(P)、FOLFOX4+ベバシズマブ(BV)療法、XELOX療法、XELOX療法+P、XELOX+BV療法を行う試験を実施した(本剤:1,000mg/m21日2回、14日間投与・7日間休薬)。無増悪生存期間(PFS)を主要評価項目、全生存期間(OS)を副次的評価項目とした。その結果、FOLFOX4療法に対するXELOX療法の非劣性が主要解析及び副次的解析で認められた。
| 主要解析 | |||
| 評価注2)項目 | FOLFOX4/FOLFOX4+P/FOLFOX4+BV (N=937) | XELOX/XELOX+P/XELOX+BV (N=967) | ハザード比(97.5%CI) |
| 中央値(日) | 中央値(日) | ||
| PFS | 259.0 | 241.0 | 1.05(0.94;1.18) |
| OS | 594.0注3) | 600.0 | 1.00(0.88;1.13) |
| 副次的解析 | |||
| 評価注2)項目 | FOLFOX4/FOLFOX4+P (N=620) | XELOX/XELOX+P (N=630) | ハザード比(97.5%CI) |
| 中央値(日) | 中央値(日) | ||
| PFS | 241.0 | 220.0 | 1.06(0.92;1.22) |
| OS | 565.0注4) | 572.0 | 1.01(0.87;1.17) |
注2)PFSカットオフ日:2006年1月31日、OSカットオフ日:2007年1月31日
注3)解析対象集団の例数は939例
注4)解析対象集団の例数は622例
また、化学療法(FOLFOX4+P/XELOX+P)に対する化学療法+BV療法の優越性が主要解析で認められ、XELOX療法に対するXELOX+BV療法の優越性が副次的解析で認められた。
| 主要解析 | |||
| 評価注2)項目 | FOLFOX4+P/XELOX+P (N=701) | FOLFOX4+BV/XELOX+BV (N=699) | ハザード比 P値(log-rank test) |
| 中央値(日) | 中央値(日) | ||
| PFS | 244.0 | 285.0 | 0.83 P=0.0023 |
| OS | 606.0 | 646.0 | 0.89 P=0.0769 |
| 副次的解析 | |||
| 評価注2)項目 | XELOX+P (N=350) | XELOX+BV (N=350) | ハザード比 P値(log-rank test) |
| 中央値(日) | 中央値(日) | ||
| PFS | 225.0 | 282.0 | 0.77 P=0.0026 |
| OS | 584.0 | 650.0 | 0.84 P=0.0698 |
副作用はXELOX療法(XELOX療法、XELOX療法+P)では642/655例(98.0%)、XELOX+BV療法では349/353例(98.9%)に発現した。主な副作用は、XELOX療法では下痢414例(63.2%)、悪心395例(60.3%)、嘔吐262例(40.0%)、錯感覚240例(36.6%)、疲労238例(36.3%)、手足症候群198例(30.2%)等であり、XELOX+BV療法では悪心226例(64.0%)、下痢220例(62.3%)、嘔吐157例(44.5%)、手足症候群139例(39.4%)、錯感覚131例(37.1%)、疲労127例(36.0%)等であった(カットオフ日:2006年1月31日)。[7.3参照]
17.1.11 海外第III相臨床試験
イリノテカン・フルオロウラシル・ホリナート療法の治療歴がある転移性結腸・直腸癌患者627例を対象に、オキサリプラチン・フルオロウラシル・ホリナート療法(FOLFOX4療法)とXELOX療法を比較する試験を実施した(本剤:1,000mg/m21日2回、14日間投与・7日間休薬)。無増悪生存期間(PFS)を主要評価項目、全生存期間(OS)を副次的評価項目とした。その結果、FOLFOX4療法に対するXELOX療法の非劣性が認められた。
| 評価注5)項目 | FOLFOX4 (N=252) | XELOX (N=251) | ハザード比(95%CI) |
| 中央値(日) | 中央値(日) | ||
| PFS | 168.0 | 154.0 | 1.03(0.87;1.24) |
| OS | 402.0 | 393.0注6) | 1.05(0.88;1.27) |
副作用はXELOX療法では302/311例(97.1%)に発現した。主な副作用は、悪心181例(58.2%)、下痢169例(54.3%)、嘔吐131例(42.1%)、疲労113例(36.3%)、錯感覚103例(33.1%)等であった(カットオフ日:2006年8月31日)。[7.3参照]
<胃癌における術後補助化学療法>
17.1.12 海外第III相臨床試験
外科的切除が実施されたStageII/IIIの胃癌患者(1,035例)を対象に、経過観察とXELOX療法(本剤とオキサリプラチン併用)を比較する試験を実施した(本剤:1,000mg/m21日2回、14日間投与・7日間休薬)。無病生存期間を主要評価項目、全生存期間を副次的評価項目とした。その結果、経過観察に対するXELOX療法の優越性が認められた29)30)。
無病生存期間のKaplan-Meier曲線
カットオフ日:2010年9月24日
全生存期間のKaplan-Meier曲線
カットオフ日:2012年11月22日
副作用はXELOX療法では488/496例(98.4%)に発現した。主な副作用は、悪心326例(65.7%)、好中球減少症300例(60.5%)、食欲減退292例(58.9%)、末梢性ニューロパチー276例(55.6%)、下痢230例(46.4%)、嘔吐189例(38.1%)、疲労152例(30.6%)等であった(カットオフ日:2010年9月24日)。[7.4参照]
18. 薬効薬理
18.1 作用機序
カペシタビンは消化管より未変化体のまま吸収され、肝臓でカルボキシルエステラーゼにより5'-DFCRに代謝される。次に主として肝臓や腫瘍組織に存在するシチジンデアミナーゼにより5'-DFURに変換される。更に、腫瘍組織に高レベルで存在するチミジンホスホリラーゼにより活性体である5-FUに変換され抗腫瘍効果を発揮する31)。5-FUはFdUMPに代謝され、チミジル酸合成酵素及び5,10-メチレンテトラヒドロ葉酸と不活性複合体を形成する。その結果チミジル酸合成を抑制することにより、DNA合成を阻害する。また、5-FUはFUTPに代謝され、UTPの代わりにRNAに取り込まれてF-RNAを生成し、リボソームRNA及びメッセンジャーRNAの機能を障害すると考えられている32)。
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. カペシタビン
20. 取扱い上の注意
アルミピロー包装開封後は湿気を避けて保存すること。
22. 包装
56錠[14錠(PTP)×4、乾燥剤入り]
140錠[14錠(PTP)×10、乾燥剤入り]
23. 主要文献
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:カペシタビン(進行性胃癌)
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:カペシタビン(直腸癌における補助化学療法)
- Cavaliere A,et al., Tumori., 76, 179-181, (1990) »PubMed
- 日本人患者における薬物動態(国内前期臨床第2相試験)(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.3-2)
- 日本人患者における薬物動態(国内臨床第1相試験)(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.3-1)
- Hyodo I,et al., Jpn.J.Clin.Oncol., 36, 410-417, (2006) »PubMed
- 日本人患者における薬物動態(国内後期臨床第2相試験)(ゼローダ錠:2007年12月12日審査報告書)
- 社内資料:生物学的同等性試験(カペシタビン錠300mg「タカタ」)
- 臓器、組織中濃度(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.2-2-1)
- 胎児移行性(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.2-2-3)
- カペシタビンの5-FUへの腫瘍選択的変換(ゼローダ錠:2003年4月16日承認、申請資料概要ホ-1.3-2)
- 代謝経路(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.2-3-1)
- Judson IR,et al., Invest New Drugs., 17, 49-56, (1999) »PubMed
- 腎機能障害を伴う固形癌患者の薬物動態(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.3-3-7)
- Camidge R,et al., J Clin Oncol., 23, 4719-4725, (2005) »PubMed
- 肝ミクロソーム薬物代謝酵素系に対する影響(ゼローダ錠:2003年4月16日承認、申請資料概要ヘ.2-3-4)
- Reigner B,et al., Cancer Chemother Pharmacol., 43, 309-315, (1999) »PubMed
- 進行・再発乳癌を対象とした前期第2相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.1-2-1)
- 進行・再発乳癌を対象とした後期第2相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.1-3-1)
- ドセタキセル無効の進行・再発乳癌を対象とした後期第2相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.1-3-2)
- タキサン系薬剤無効の乳癌を対象とした第2相臨床試験(ゼローダ錠:2007年12月12日審査報告書)
- Blum JL,et al., J Clin Oncol., 17, 485-493, (1999) »PubMed
- パクリタキセル無効の進行・転移性乳癌に対する第2相臨床試験(ゼローダ錠:2003年4月16日承認、申請資料概要ト.3-2-1)
- パクリタキセル又はドセタキセル無効の進行・再発乳癌を対象とした第2相臨床試験(ゼローダ錠:2007年12月12日審査報告書)
- Twelves C,et al., N Engl J Med., 352, 2696-2704, (2005) »PubMed
- Dukes Cの結腸癌を対象とした術後補助化学療法の第3相臨床試験(ゼローダ錠:2007年12月12日審査報告書)
- Schmoll H,et al., J Clin Oncol., 33, 3733-3740, (2015) »PubMed
- Schmoll H,et al., J Clin Oncol., 25, 102-109, (2007) »PubMed
- Bang YJ,et al., Lancet., 379, 315-321, (2012) »PubMed
- Noh SH,et al., Lancet Oncol., 15, 1389-1396, (2014) »PubMed
- 作用部位・作用機序(ゼローダ錠:2003年4月16日承認、申請資料概要ホ-1.1-1)
- Pinedo HM,et al., J Clin Oncol., 6, 1653-1664, (1988) »PubMed
- 抗腫瘍効果(ゼローダ錠:2003年4月16日承認、申請資料概要ホ-1.4-1)
- Yanagisawa M,et al., Oncol Rep., 22, 241-247, (2009) »PubMed
- Sawada N,et al., Oncol Rep., 18, 775-778, (2007) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-838-2121
製品情報問い合わせ先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-838-2121
26. 製造販売業者等
26.1 製造販売元
ダイト株式会社
富山県富山市八日町326番地
26.2 販売元
高田製薬株式会社
さいたま市西区宮前町203番地1