医薬品情報
| 総称名 | リュープロレリン酢酸塩 |
|---|---|
| 一般名 | リュープロレリン酢酸塩 |
| 欧文一般名 | Leuprorelin Acetate |
| 製剤名 | 注射用リュープロレリン酢酸塩 |
| 薬効分類名 | LH-RH注1)誘導体 注1)LH-RH:黄体形成ホルモン放出ホルモン マイクロカプセル型徐放性製剤 |
| 薬効分類番号 | 2499 |
| ATCコード | L02AE02 |
| KEGG DRUG |
D00989
リュープロレリン酢酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
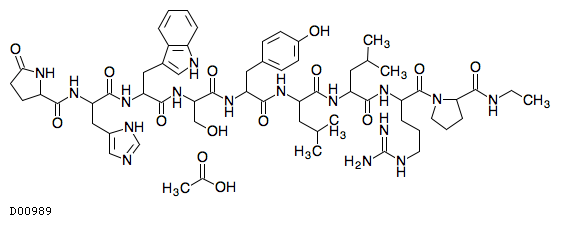
|---|---|---|---|---|---|
| リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」 (後発品) | LEUPRORELIN ACETATE SR FOR INJECTION KIT | あすか製薬 | 2499407G3057 | 23590円/筒 | 劇薬, 処方箋医薬品注2) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<閉経前乳癌>
本剤の使用開始にあたっては、原則としてホルモン受容体の発現の有無を確認し、ホルモン受容体が陰性と判断された場合には本剤を使用しないこと。
6. 用法及び用量
通常、成人には12週に1回リュープロレリン酢酸塩として11.25mgを皮下に投与する。
投与に際しては、注射針を上にしてプランジャーロッドを押して、懸濁用液全量を粉末部に移動させて、泡立てないように注意しながら、十分に懸濁して用いる。
投与に際しては、注射針を上にしてプランジャーロッドを押して、懸濁用液全量を粉末部に移動させて、泡立てないように注意しながら、十分に懸濁して用いる。
7. 用法及び用量に関連する注意
本剤は12週間持続の徐放性製剤であり、12週を超える間隔で投与すると下垂体−性腺系刺激作用により性腺ホルモン濃度が再度上昇し、臨床所見が一過性に悪化するおそれがあるので、12週に1回の用法を遵守すること。
8. 重要な基本的注意
<効能共通>
8.1 本剤は内分泌療法剤であり、がんに対する薬物療法について十分な知識・経験を持つ医師のもとで、本剤による治療が適切と判断される患者についてのみ使用すること。
8.2 本剤は12週間持続性の製剤であり、徐放性の薬剤が注射部位に長くとどまり、硬結等の注射部位反応が発現することがあるので、注射部位を毎回変更し、注射部位をもまないように患者に説明するなど十分注意して投与すること。[14.2.2参照]
8.3 本剤は徐放性製剤であるので、最終投与後も薬効持続期間中は患者の状態を観察すること。
8.4 アナフィラキシーがあらわれることがあるので、問診を十分に行うこと。[11.1.2参照]
<前立腺癌>
8.5 初回投与初期に、高活性LH-RH誘導体としての下垂体−性腺系刺激作用による血清テストステロン濃度の上昇に伴って骨疼痛の一過性増悪がみられることがある。また、尿路閉塞あるいは脊髄圧迫のみられるおそれがあるので慎重に投与し、投与開始1ヵ月間は十分観察を行うこと。[11.1.8参照]
<閉経前乳癌>
8.6 初回投与初期に、高活性LH-RH誘導体としての下垂体−性腺系刺激作用による血清エストロゲン濃度の上昇に伴って骨疼痛の一過性増悪等がみられることがある。
8.7 本剤で抗腫瘍効果が得られず進行を認めた場合は、投与を中止すること。
8.8 エストロゲン低下作用に基づく骨塩量の低下がみられることがあるので、長期にわたり投与する場合には、可能な限り骨塩量の検査を行い慎重に投与すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
<前立腺癌>
9.1.1 脊髄圧迫又は尿路閉塞による腎障害を既に呈している患者又は新たに発生するおそれのある患者
初回投与初期の血清テストステロン濃度の上昇に伴い、原疾患の症状が悪化する可能性がある。
<閉経前乳癌>
9.1.2 粘膜下筋腫のある患者
出血症状が増悪することがある。
9.4 生殖能を有する者
治療に際しては妊娠していないことを確認し、治療期間中は非ホルモン性の避妊をさせること。[9.5参照]
9.5 妊婦
9.6 授乳婦
投与しないこと。ラットで乳汁への移行がみられている。[2.3参照]
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
<効能共通>
11.1.1 間質性肺炎(0.1%未満)
発熱、咳嗽、呼吸困難、胸部X線異常等を伴う間質性肺炎があらわれることがあるので、患者の状態を十分に観察し、異常が認められた場合には、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.2 アナフィラキシー(0.1%未満)[8.4参照]
11.1.3 肝機能障害、黄疸(いずれも頻度不明)
AST、ALTの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.4 糖尿病の発症又は増悪(頻度不明)
11.1.5 下垂体卒中(頻度不明)
下垂体卒中が下垂体腺腫患者で報告されているので、初回投与直後に頭痛、視力・視野障害等があらわれた場合には、検査のうえ外科的治療等の適切な処置を行うこと。
11.1.6 心筋梗塞、脳梗塞、静脈血栓症、肺塞栓症等の血栓塞栓症(頻度不明)
<前立腺癌>
11.1.7 うつ状態(0.1%未満)
11.1.8 骨疼痛の一過性増悪、尿路閉塞あるいは脊髄圧迫(5%以上)
下垂体−性腺系刺激作用による血清テストステロン濃度の上昇に伴って骨疼痛の一過性増悪、尿路閉塞あるいは脊髄圧迫がみられることがある。[8.5参照]
11.1.9 心不全(0.1〜5%未満)
<閉経前乳癌>
11.1.10 更年期障害様のうつ状態(0.1〜5%未満)
エストロゲン低下作用に基づく更年期障害様のうつ状態があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 肝臓 | LDH上昇 | 黄疸、AST、ALT、γ-GTP、AL-Pの上昇 | ||
| 内分泌系 | ほてり、熱感 | 頭痛、不眠、顔面潮紅、めまい、発汗、性欲減退、勃起障害、女性化乳房、睾丸萎縮、会陰部不快感 | ||
| 筋・骨格系 | 関節痛、骨疼痛、肩・腰・四肢等の疼痛、歩行困難、手指等のこわばり | 筋肉痛、骨塩量の低下 | ||
| 皮膚 | 皮膚炎、頭部発毛 | |||
| 泌尿器系 | 頻尿、血尿、BUNの上昇 | |||
| 循環器 | 心電図異常、心胸比増大 | |||
| 血液 | 貧血、血小板減少 | |||
| 消化器 | 悪心、嘔吐、食欲不振、便秘 | 下痢 | ||
| 過敏症 | 発疹、そう痒 | |||
| 投与部位 | 硬結 | 疼痛、発赤 | 膿瘍、腫脹、潰瘍、そう痒、肉芽腫、腫瘤、熱感、壊死等の注射部位反応 | |
| その他 | 浮腫、胸部圧迫感、悪寒、倦怠感、口唇・四肢のしびれ、体重増加、知覚異常、難聴、耳鳴、発熱、総コレステロール上昇、トリグリセライド上昇、尿酸上昇、高カリウム血症、血糖値上昇 | 脱力感 | 痙攣 |
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 低エストロゲン症状 | ほてり、熱感、のぼせ、肩こり、頭痛、不眠、めまい、発汗 | 性欲減退、冷感、視覚障害、情緒不安定 | ||
| 女性生殖器 | 不正出血、腟乾燥、性交痛、腟炎、帯下増加、卵巣過剰刺激症状、乳房の疼痛・緊満感・萎縮 | |||
| 筋・骨格系 | 関節痛、骨疼痛等の疼痛 | 手指等のこわばり、腰痛、筋肉痛、筋痙攣、骨塩量の低下、血清リン上昇、高カルシウム血症 | ||
| 皮膚 | ざ瘡、皮膚乾燥、脱毛、多毛、爪の異常 | |||
| 精神神経系 | 眠気、いらいら感、記憶力低下、注意力低下、知覚異常 | |||
| 過敏症 | 発疹、そう痒 | |||
| 肝臓 | AST、ALT、AL-P、LDH、γ-GTP、ビリルビンの上昇 | 黄疸 | ||
| 消化器 | 悪心、嘔吐、食欲不振、腹痛、腹部膨満感、下痢、便秘、口内炎、口渇 | |||
| 循環器 | 心悸亢進、血圧上昇 | |||
| 血液 | 赤血球増多、貧血、白血球減少、血小板減少、部分トロンボプラスチン時間延長 | |||
| 泌尿器系 | 頻尿、排尿困難、BUNの上昇 | |||
| 投与部位 | 硬結 | 疼痛、発赤 | 膿瘍、腫脹、潰瘍、そう痒、肉芽腫、腫瘤、熱感、壊死等の注射部位反応 | |
| その他 | 疲労、倦怠感、脱力感、口唇・四肢のしびれ、手根管症候群、耳鳴、難聴、胸部不快感、浮腫、体重増加、下肢痛、息苦しさ、発熱、総コレステロール上昇、LDLコレステロール上昇、トリグリセライド上昇、高カリウム血症 | 体重減少、味覚異常、甲状腺機能異常 | 痙攣 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 用時調製し、懸濁後は直ちに使用すること。
14.2 薬剤投与時の注意
14.2.1 皮下注射のみに使用すること。静脈注射により血栓症を誘発するおそれがある。
14.2.2 皮下注射にあたっては下記の点に注意すること。[8.2参照]
(1)注射部位は上腕部、腹部、臀部の皮下とすること。
(2)注射部位は毎回変更し、同一部位への反復注射は行わないこと。
(3)注射針が血管内に入っていないことを確認すること。
(4)注射部位をもまないように患者に指示すること。
15. その他の注意
15.2 非臨床試験に基づく情報
ラットにリュープロレリン酢酸塩として4週間持続の徐放性製剤0.8、3.6及び16mg/kg/4週を1年間、並びにリュープロレリン酢酸塩水溶液注射剤0.6、1.5及び4mg/kg/日を2年間それぞれ皮下投与した試験で、良性下垂体腺腫が認められたとの報告がある2)。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
<前立腺癌>
前立腺癌患者(未治療例)に、リュープロレリン酢酸塩として11.25mgを単回皮下投与した場合の血中濃度[代謝物M-I(Tyr-D-Leu-Leu-Arg-Pro-NHC2H5)を含む]は以下のとおりであった3)。
血中濃度推移(代謝物M-Iを含む)
平均値(標準偏差)、n=10
16.1.2 反復投与
<前立腺癌>
前立腺癌既治療患者(リュープロレリン酢酸塩注射用3.75mgの投与により抗腫瘍効果が安定して得られている患者)51例を対象に、リュープロレリン酢酸塩として11.25mgを12週ごとに2回皮下投与した時の血中濃度(代謝物M-Iを含む)は、投与24週後までほぼ0.2〜0.3ng/mLで推移した。血中濃度の推移からみて蓄積性はないと考えられる4)。
<閉経前乳癌>
閉経前乳癌患者(術後患者)に、リュープロレリン酢酸塩として11.25mgを12週ごとに2回皮下投与(タモキシフェンクエン酸塩を併用投与)した時の血中濃度(代謝物M-Iを含む)は、定常状態に達した投与16週後以降、投与24週後までほぼ0.1〜0.2ng/mLで推移した5)。
16.1.3 生物学的同等性試験
閉経後健康成人女性を対象とした並行群間比較試験において、リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」又はリュープリンSR注射用キット11.25mgを、リュープロレリン酢酸塩として11.25mg絶食下単回皮下投与して血漿中未変化体濃度を測定した。得られた薬物動態パラメータについて90%信頼区間法にて統計解析を行った結果、主要評価項目であるAUC0→16w及びCmaxはlog(0.80)〜log(1.25)の範囲内であった6)。
| Cmax(ng/mL) | AUC0→16w(ng・hr/mL) | AUC1→12w(ng・hr/mL) | Tmax(hr) | |
| リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」注1) | 25.969±4.743 | 389.653±113.957 | 139.730±68.217 | 1.88±0.39 |
| リュープリンSR注射用キット11.25mg注2) | 28.614±4.069 | 349.059±92.022 | 117.732±71.800 | 1.66±0.48 |
血漿中未変化体濃度推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<前立腺癌>
17.1.1
前立腺癌患者を対象に、12週に1回、リュープロレリン酢酸塩として11.25mgを皮下投与した国内第II相非盲検群間比較試験及び国内第II相非対照試験における抗腫瘍効果(奏効率)及び血清テストステロン濃度の去勢レベル維持率は以下のとおりであった。
| 対象患者 | 投与回数 | 投与・観察期間 | 抗腫瘍効果 (奏効率)注2) | 去勢レベル維持率注3) |
| 未治療例 | 1回 | 12週 | 100%(10/10例) | 100%(10/10例) |
| 既治療例注1) | 2回 | 24週 | 80.4%(41/51例) | 100%(46/46例) |
副作用の発現頻度は、既治療例を対象とした国内第II相非盲検群間比較試験で23.5%(12/51例)であり、主な症状は発汗、ほてり及び注射部位硬結(注射部疼痛性硬結を含む)であった。未治療例を対象とした国内第II相非対照試験では副作用はみられなかった7)。
<閉経前乳癌>
17.1.2
閉経前乳癌患者を対象に、12週に1回、リュープロレリン酢酸塩として11.25mgを皮下投与(タモキシフェンクエン酸塩を併用投与)した国内第II相非盲検群間比較試験及び国内第II相非対照試験における抗腫瘍効果(奏効率)及び血清エストラジオール濃度の閉経期レベル抑制率は以下のとおりであった。
| 対象患者 | 投与回数 | 投与・観察期間 | 抗腫瘍効果(奏効率)注1) | 閉経期レベルへの抑制率注2) |
| 閉経前進行・再発乳癌 | 2回 | 24週 | 22.7%(5/22例) | − |
| 閉経前乳癌術後 | 2回 | 24週 | − | 96.8%(60/62例) |
また、外国(欧州)においてリンパ節転移陽性の閉経前及び閉経周辺期乳癌術後患者を対象に、リュープロレリン酢酸塩の投与又はCMF療法を行った海外第III相無作為割付群間比較試験における無再発生存率は以下のとおりであった。
| 投与薬剤 | 用法用量 | 投与開始2年後の無再発生存率(主要評価項目) | 投与開始5年後の無再発生存率(副次評価項目) |
| リュープロレリン酢酸塩11.25mg | 3ヵ月に1回皮下投与・24ヵ月間投与 | 83.0%(224/270例) | 60.5%(153/253例) |
| CMF療法 シクロホスファミド500mg/m2、 メトトレキサート40mg/m2、 フルオロウラシル600mg/m2 | 各薬剤を1ヵ月毎に2回(1日目及び8日目)静脈内投与することを1サイクルとし、6サイクル(6ヵ月間)投与 | 80.9%(207/256例) | 60.6%(146/241例) |
有害事象の発現頻度は、ホルモン動態及び安全性に関する国内第II相非盲検群間比較試験では97.2%(69/71例)であり、主な症状は熱感、頭重(感)、発汗、悪心、注射部位硬結及び注射部位疼痛であった。国内第II相非対照試験では100%(22/22例)であり、主な症状は熱感、頭重(感)、頭痛、発汗、腰痛であった。海外第III相無作為割付群間比較試験では97.6%(287/294例)であり、主な症状はほてり、体重増加、多汗であった5)。
18. 薬効薬理
18.1 作用機序
高用量のLH-RH又は高活性LH-RH誘導体であるリュープロレリン酢酸塩を反復投与すると、初回投与直後一過性に下垂体−性腺系刺激作用(急性作用)がみられた後、下垂体においては性腺刺激ホルモンの産生・放出が低下する。更に、精巣及び卵巣の性腺刺激ホルモンに対する反応性が低下し、テストステロン及びエストラジオール産生能が低下する(慢性作用)。リュープロレリン酢酸塩のLH放出活性はLH-RHの約100倍であり、その下垂体−性腺機能抑制作用はLH-RHより強い。リュープロレリン酢酸塩が高活性LH-RH誘導体であり、下垂体−性腺機能抑制作用が強い理由は、リュープロレリン酢酸塩が、LH-RHと比較して蛋白分解酵素に対する抵抗性が高いこと、LH-RHリセプターに対する親和性が高いことなどによる。更に、本剤は徐放性製剤であるので、常時血中にリュープロレリン酢酸塩を放出して効果的に精巣及び卵巣の反応性低下をもたらし、下垂体−性腺機能抑制作用を示す8)9)10)11)12)。
18.2 性腺ホルモン濃度抑制作用
18.2.1 前立腺癌患者において12週に1回の皮下投与により血清テストステロン濃度が持続的に去勢レベル以下に低下し、薬物的去勢作用が認められる13)。
18.2.2 閉経前乳癌患者において12週に1回の皮下投与により血清エストラジオール濃度は概ね閉経期レベル以下に低下し、卵巣機能抑制作用を認め、通常排卵は抑制され、月経は停止する5)。
18.3 生物学的同等性試験(薬力学的試験)
<前立腺癌>
18.3.1
未治療前立腺癌患者を対象とした並行群間比較試験において、リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」又はリュープリンSR注射用キット11.25mgを、リュープロレリン酢酸塩として11.25mg単回皮下投与した。投与4週後の血清中テストステロン濃度は以下のとおりであった。投与群間の平均値の差の95%信頼区間は、同等性の判定基準とした±20ng/dLの範囲内であった。
| N | 投与4週後の血清中テストステロン濃度の平均値(ng/dL)(両側95%信頼区間) | 平均値の差(ng/dL)(両側95%信頼区間) | |
| リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」 | 16 | 13.2(7.5,18.9) | 1.9(−6.5,10.2) |
| リュープリンSR注射用キット11.25mg | 15 | 11.3(4.8,17.9) |
副作用発現頻度は、リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」投与群で56.3%(9/16例)であった。主な副作用は、ほてり43.8%(7/16例)であった14)。
18.3.2
未治療前立腺癌患者を対象とした並行群間比較試験において、リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」又はリュープリンSR注射用キット11.25mgを、リュープロレリン酢酸塩として11.25mg単回皮下投与した。投与4週後から12週後に血清中テストステロン濃度が去勢レベル(50ng/dL)以下となった被験者の割合は以下のとおりであった。投与群間の割合の差の95%信頼区間の下側信頼限界は、非劣性マージンとした−15%を上回った。
| N | 血清中テストステロン濃度が去勢レベル(50ng/dL)以下となった被験者の割合 | 割合の差(両側95%信頼区間) | |
| リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」 | 54 | 100.0%(54/54例) | 3.8%(−3.4,13.0) |
| リュープリンSR注射用キット11.25mg | 52 | 96.2%(50/52例) |
副作用発現頻度は、リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」投与群で40.7%(22/54例)であった。主な副作用は、ほてり18.5%(10/54例)であった15)。
<閉経前乳癌>
18.3.3
閉経前乳癌術後患者(ホルモン療法未治療)を対象とした並行群間比較試験において、リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」又はリュープリンSR注射用キット11.25mgを、リュープロレリン酢酸塩として11.25mg単回皮下投与(タモキシフェンクエン酸塩20mg/日を併用投与)した。投与4週後から12週後に血清中エストラジオール濃度が閉経期レベル(30pg/mL)以下となった被験者の割合は以下のとおりであった。投与群間の割合の差の95%信頼区間の下側信頼限界は、非劣性マージンとした−15%を上回った。
| N | 血清中エストラジオール濃度が閉経期レベル(30pg/mL)以下となった被験者の割合 | 割合の差(両側95%信頼区間) | |
| リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」 | 73 | 93.2%(68/73例) | −2.7%(−11.3,5.7) |
| リュープリンSR注射用キット11.25mg | 72 | 95.8%(69/72例) |
副作用発現頻度は、リュープロレリン酢酸塩SR注射用キット11.25mg「あすか」投与群で61.6%(45/73例)であった。主な副作用は、ほてり38.4%(28/73例)、倦怠感6.8%(5/73例)、注射部位疼痛6.8%(5/73例)であった16)。
19. 有効成分に関する理化学的知見
19.1. リュープロレリン酢酸塩
22. 包装
1キット
23. 主要文献
- 大島洋次郎他, 薬理と治療, 18 (Suppl.3), 589-607,609-623,625-631,633-639, (1990)
- 茶谷文雄他, 薬理と治療, 18 (Suppl.3), 575-588, (1990)
- 単回投与時の前立腺癌患者における検討(リュープリンSR注射用キット:2002年7月5日承認、申請資料概要ヘ.2.1、略号一覧表)
- 反復投与時の前立腺癌患者における検討(リュープリンSR注射用キット:2002年7月5日承認、申請資料概要へ.2.2)
- 臨床試験の試験成績に関する資料(リュープリンSR注射用キット:2005年8月18日承認、審査報告書)
- 社内資料:生物学的同等性試験
- 国内における臨床試験(リュープリンSR注射用キット:2002年7月5日承認、申請資料概要ト.1.1)
- 須藤勝一他, 薬理と治療, 18 (Suppl.3), 515-520, (1990)
- 前多敬一郎他, 薬理と治療, 18, 2615-2629, (1990)
- 山崎 巌他, 武田研究所報, 36, 64-70, (1977)
- 須藤勝一他, 薬理と治療, 18 (Suppl.3), 521-528, (1990)
- 薬理試験の概要文のまとめ(リュープリンPRO注射用キット:2015年9月28日承認、CTD2.6.2.1)
- ホルモン動態(リュープリンSR注射用キット:2002年7月5日承認、申請資料概要ト.3.(1))
- 社内資料:生物学的同等性試験(薬力学的試験)<前立腺癌>[1]
- 社内資料:生物学的同等性試験(薬力学的試験)<前立腺癌>[2]
- 社内資料:生物学的同等性試験(薬力学的試験)<閉経前乳癌>
24. 文献請求先及び問い合わせ先
文献請求先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
製品情報問い合わせ先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
26. 製造販売業者等
26.1 製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
26.2 販売元
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号