医薬品情報
| 総称名 | エピリド |
|---|---|
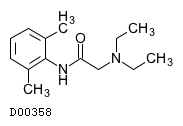
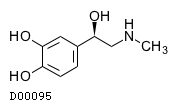
| 一般名 | リドカイン アドレナリン |
| 欧文一般名 | Lidocaine Adrenaline |
| 製剤名 | リドカイン塩酸塩・アドレナリン注射液 |
| 薬効分類名 | 局所麻酔剤 |
| 薬効分類番号 | 2710 |
| KEGG DRUG |
D04052
アドレナリン・リドカイン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エピリド配合注歯科用カートリッジ1.0mL (後発品) | EPILIDO Combination Injection Dental Cartridges | ニプロ | 2710806U3024 | 63.5円/管 | 劇薬, 処方箋医薬品注) |
| エピリド配合注歯科用カートリッジ1.8mL | EPILIDO Combination Injection Dental Cartridges | ニプロ | 2710806U1056 | 66.5円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又はアミド型局所麻酔薬に対し過敏症の既往歴のある患者
4. 効能または効果
歯科領域における浸潤麻酔又は伝達麻酔
6. 用法及び用量
浸潤麻酔又は伝達麻酔には、通常成人0.3〜1.8mLを使用する。口腔外科領域の麻酔には、3〜5mLを使用する。
なお、年齢、麻酔領域、部位、組織、症状、体質により適宜増減するが、増量する場合には注意すること。
なお、年齢、麻酔領域、部位、組織、症状、体質により適宜増減するが、増量する場合には注意すること。
8. 重要な基本的注意
8.1 まれにショックあるいは中毒症状を起こすことがあるので、本剤の投与に際しては、十分な問診により患者の全身状態を把握するとともに、異常が認められた場合に直ちに救急処置のとれるよう、常時準備をしておくこと。
8.2 本剤の投与に際し、その副作用を完全に防止する方法はないが、ショックあるいは中毒症状をできるだけ避けるために、以下の点に留意すること。
8.2.1 患者の全身状態の観察を十分に行うこと。
8.2.2 できるだけ必要最少量にとどめること。
8.2.3 血管の多い部位(顔面等)に注射する場合には、吸収が速いので、できるだけ少量を投与すること。
8.2.4 注射針が、血管に入っていないことを確かめること。
8.2.5 注射の速度はできるだけ遅くすること。
8.3 注射針が適切に位置していないなどにより、神経障害が生じることがあるので、穿刺に際し異常を認めた場合には本剤の注入を行わないこと。
8.4 本剤の投与により、誤嚥・口腔内咬傷の危険性を増加させるおそれがあるので注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 次の患者には治療上やむを得ないと判断される場合を除き、投与しないこと。これらの症状が悪化するおそれがある。
(1)高血圧のある患者
(2)動脈硬化のある患者
(3)心不全のある患者
(4)甲状腺機能亢進のある患者
(5)糖尿病のある患者
(6)血管攣縮の既往のある患者
9.1.2 心刺激伝導障害のある患者
症状を悪化させることがある。
9.1.3 全身状態が不良な患者
生理機能の低下により麻酔に対する忍容性が低下していることがある。[8.2.6参照]
9.2 腎機能障害患者
9.2.1 重症の腎機能障害のある患者
中毒症状が発現しやすくなる。
9.3 肝機能障害患者
9.3.1 重症の肝機能障害のある患者
中毒症状が発現しやすくなる。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。[8.2.6参照]
9.8 高齢者
患者の全身状態を観察しながら慎重に投与すること。生理機能の低下により麻酔に対する忍容性が低下していることがある。また、本剤に含まれているアドレナリンの作用に対する感受性が高いことがある。[8.2.6参照]
10. 相互作用
相互作用序文
本剤は、主として肝代謝酵素CYP1A2及びCYP3A4で代謝される。
薬物代謝酵素用語
CYP1A2
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| ハロゲン含有吸入麻酔薬 ハロタン等 | 頻脈、不整脈、場合によっては心停止を起こすことがある。 | これらの薬剤は、心筋のアドレナリン受容体の感受性を亢進させる。 |
| 三環系抗うつ薬 イミプラミン等 MAO阻害薬 | 血圧上昇を起こすことがある。 | これらの薬剤は、アドレナリン作動性神経終末でのカテコールアミンの再取り込みを阻害し、受容体でのカテコールアミン濃度を上昇させ、アドレナリン作動性神経刺激作用を増強させる。 |
| 非選択性β遮断薬 プロプラノロール等 | 血管収縮、血圧上昇、徐脈を起こすことがある。 | これらの薬剤のβ受容体遮断作用により、アドレナリンのα受容体刺激作用が優位になり、血管抵抗性を上昇させる。 |
| 抗精神病薬(ブチロフェノン系、フェノチアジン系等) ハロペリドール クロルプロマジン等 α遮断薬 | 過度の血圧低下を起こすことがある。 | これらの薬剤のα受容体遮断作用により、アドレナリンのβ受容体刺激作用が優位になり、血圧低下があらわれる。 |
| 分娩促進薬 オキシトシン等 麦角アルカロイド類 エルゴメトリン等 | 血圧上昇を起こすことがある。 | 併用により血管収縮作用が増強される。 |
| クラスIII抗不整脈薬 アミオダロン等 | 心機能抑制作用が増強するおそれがある。 | 作用が増強することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)
徐脈、不整脈、血圧低下、呼吸抑制、チアノーゼ、意識障害等を生じ、まれに心停止を来すことがある。また、まれにアナフィラキシーショックを起こしたとの報告がある。
11.1.2 意識障害、振戦、痙攣(いずれも頻度不明)
意識障害、振戦、痙攣等の中毒症状があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には、直ちに投与を中止し、適切な処置を行うこと。[13.参照]
11.1.3 異常感覚、知覚・運動障害(いずれも頻度不明)
注射針の留置時に神経に触れることにより一過性の異常感覚が発現することがある。また、神経が注射針や薬剤あるいは虚血によって障害を受けると、まれに持続的な異常感覚、疼痛、知覚障害、運動障害等の神経学的疾患があらわれることがある。
11.1.4 悪性高熱(頻度不明)
まれに原因不明の頻脈・不整脈・血圧変動、急激な体温上昇、筋強直、血液の暗赤色化(チアノーゼ)、過呼吸、発汗、アシドーシス、高カリウム血症、ミオグロビン尿(ポートワイン色尿)等を伴う重篤な悪性高熱があらわれることがある。本剤を投与中、悪性高熱に伴うこれらの症状を認めた場合は、直ちに投与を中止し、ダントロレンナトリウムの静注、全身冷却、純酸素による過換気、酸塩基平衡の是正等、適切な処置を行うこと。また、本症は腎不全を続発することがあるので、尿量の維持を図ること。
11.2 その他の副作用
| 頻度不明 | |
| 中枢神経注) | 眠気、不安、興奮、霧視、眩暈、頭痛等 |
| 循環器 | 動悸、頻脈、血圧上昇等 |
| 消化器注) | 悪心・嘔吐等 |
| 過敏症 | 蕁麻疹等の皮膚症状、浮腫等 |
| 投与部位 | 潰瘍、壊死等 |
13. 過量投与
局所麻酔薬の血中濃度の上昇に伴い、中毒が発現する。特に誤って血管内に投与した場合には、数分以内に発現することがある。その症状は、主に中枢神経系及び心血管系の症状としてあらわれる。[11.1.2参照]
13.1 症状
13.1.1 中枢神経系の症状
初期症状として不安、興奮、多弁、口周囲の知覚麻痺、舌のしびれ、ふらつき、聴覚過敏、耳鳴、視覚障害、振戦等があらわれる。症状が進行すると意識消失、全身痙攣があらわれ、これらの症状に伴い低酸素血症、高炭酸ガス血症が生じるおそれがある。より重篤な場合には呼吸停止を来すこともある。
13.1.2 心血管系の症状
血圧低下、徐脈、心筋収縮力低下、心拍出量低下、刺激伝導系の抑制、心室性頻脈及び心室細動等の心室性不整脈、循環虚脱、心停止等があらわれる。
13.2 処置
振戦や痙攣が著明であれば、ジアゼパム又は超短時間作用型バルビツール酸製剤(チオペンタールナトリウム等)を投与する。
14. 適用上の注意
14.1 使用回数
本品は一回限り使用のディスポーザブル製剤であるので、再度の使用は避けること。
14.2 薬剤投与時の注意
14.2.1 使用前にカートリッジの頭部(アルミキャップ)メンブランをアルコールで軽く消毒すること。
14.2.2 本剤は、金属を侵す性質があるので、長時間注射針に接触させないことが望ましい。
14.2.3 強圧をかけずにできるだけゆっくり注射すること。骨膜下への強圧注射は組織の損傷又はガラスチューブの破折につながるおそれがある。
16. 薬物動態
16.1 血中濃度
健康成人に2%リドカイン液2mL又は4mL(リドカイン塩酸塩40mg又は80mg)を単独あるいはアドレナリンを添加(1:80,000)して下顎孔伝達麻酔・頬側浸潤麻酔に用いたとき、アドレナリン添加時の血漿中濃度は、単独投与時に比べ最高濃度の有意な低下、最高濃度到達時間の有意な延長が認められた1)。
| 投与群(リドカイン塩酸塩80mg)\パラメータ | Cmax(μg/mL) | Tmax(min) |
| アドレナリン非添加 | 0.93±0.10 | 11.4±1.4 |
| アドレナリン添加 | 0.56±0.05 | 18.9±2.2 |
16.3 分布
リドカイン2μg/mLの血漿蛋白結合率は約65%で、α1-酸性糖蛋白及びアルブミンと結合する。血液/血漿中濃度比は約0.8であることから、血球への分布は少ないと考えられる。妊婦にリドカイン塩酸塩を硬膜外投与したとき、臍帯静脈血液中濃度と母体血漿中濃度の比は0.5〜0.7で、胎盤を通過する2)。
16.4 代謝
リドカインは、主として肝臓でN-脱エチル体monoethylglycinexylidide(MEGX)に代謝された後、glycinexylidide(GX)、2,6-xylidineに代謝され、約70%が4-hydroxy-2,6-xylidineとして尿中に排泄される3)。
16.5 排泄
リドカイン塩酸塩250mg注1)を健康人に経口投与注2)したとき、24時間後までの尿中放射能排泄率は投与量の83.8%、未変化体は投与量の2.8%であった3)(外国人データ)。
16.6 特定の背景を有する患者
18. 薬効薬理
18.1 作用機序
リドカイン塩酸塩は、神経膜のナトリウムチャネルをブロックし、神経における活動電位の伝導を可逆的に抑制し、知覚神経及び運動神経を遮断する局所麻酔薬である6)。
18.2 麻酔効果・作用時間
19. 有効成分に関する理化学的知見
19.1. リドカイン
19.2. アドレナリン
20. 取扱い上の注意
20.1 凍結するとゴム栓の飛び出し又はカートリッジの破損が起こることがあるので注意すること。
20.2 外箱開封後は遮光して保存すること。
20.3 廃棄の際は感染防止に配慮すること。
22. 包装
<エピリド配合注歯科用カートリッジ1.0mL>
1.0mL×50管[カートリッジ]
<エピリド配合注歯科用カートリッジ1.8mL>
1.8mL×50管[カートリッジ]
23. 主要文献
- 伊東哲ほか, 日本歯科麻酔学会雑誌, 7 (2), 212-234, (1979)
- Burm,A.G.L., Clin.Pharmacokinet., 16, 283-311, (1989) »PubMed
- Keenaghan,J.B.et al., J.Pharmacol.Exp.Ther., 180, 454-463, (1972) »PubMed
- Thomson,P.D.et al., Ann.Intern.Med., 78, 499-508, (1973) »PubMed
- Nation,R.L.et al., Br.J.Clin.Pharmacol., 4, 439-448, (1977) »PubMed
- 第十八改正日本薬局方解説書, C-6065-C-6069, (2021)
- Wiedling,S., Anaesthesist., 1 (4), 119-126, (1952) »PubMed
- Wiedling,S., Acta Pharmacol.Toxicol., 8, 117-133, (1952) »PubMed
- 円谷福男, 麻酔, 6 (5), 357-366, (1957)
- 植木昭和ほか, 福岡医学雑誌, 51 (12), 1361-1374, (1960)
- Krantz,J.C., J.Pharmacol.Exp.Ther., 111, 224-228, (1954) »PubMed
- Truant,A.P., Arch.Int.Pharmacodyn., 115 (4), 483-497, (1958) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ニプロ株式会社
ファーマパッケージング事業部
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:06-6310-6571
FAX:050-3204-7012
製品情報問い合わせ先
ニプロ株式会社
ファーマパッケージング事業部
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:06-6310-6571
FAX:050-3204-7012
26. 製造販売業者等
26.1 製造販売元
ニプロ株式会社
大阪府摂津市千里丘新町3番26号