医薬品情報
| 総称名 | ヨビパス |
|---|---|
| 一般名 | パロペグテリパラチド |
| 欧文一般名 | Palopegteriparatide |
| 製剤名 | パロペグテリパラチド注射剤 |
| 薬効分類名 | 副甲状腺機能低下症治療剤 |
| 薬効分類番号 | 2439 |
| KEGG DRUG |
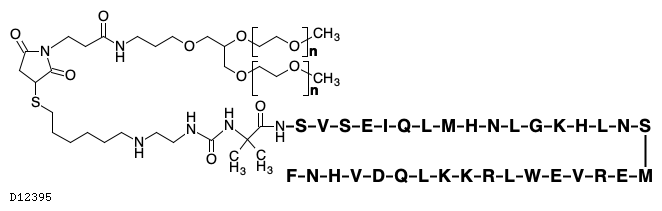
D12395
パロペグテリパラチド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年11月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ヨビパス皮下注168μgペン | YORVIPATH Subcutaneous Injection | 帝人ファーマ | 2439404G1028 | 571509円/キット | 処方箋医薬品注) |
| ヨビパス皮下注294μgペン | YORVIPATH Subcutaneous Injection | 帝人ファーマ | 2439404G2024 | 584139円/キット | 処方箋医薬品注) |
| ヨビパス皮下注420μgペン | YORVIPATH Subcutaneous Injection | 帝人ファーマ | 2439404G3020 | 596310円/キット | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 活性型ビタミンD製剤やカルシウム剤による治療を受けている患者に対して、本剤の投与を検討すること。[7.1参照]
5.2 副甲状腺ホルモン分泌不全の患者に対して、本剤の投与を検討すること。偽性副甲状腺機能低下症の患者では、副甲状腺ホルモンに対する反応性が低下しており本剤の効果が期待できないため、本剤の投与前に血中PTH濃度を測定する等、適切に鑑別診断を行うこと。
6. 用法及び用量
通常、成人には、パロペグテリパラチドを、PTH(1-34)として1回18μgを開始用量とし、1日1回、皮下注射する。以後、患者の血清カルシウム濃度の十分な管理のもとに、1日1回6〜60μgの範囲で適宜用量を増減して皮下投与するが、増量又は減量は3μgずつ行うこと。
7. 用法及び用量に関連する注意
7.1 活性型ビタミンD製剤やカルシウム剤による治療により患者の血清カルシウム濃度が基準範囲内又はわずかに下回る状態(目安として7.8〜10.6mg/dL)となっていることを確認した上で、本剤を投与すること。[5.1参照]
7.2 本剤の投与開始時には、以下を参考に活性型ビタミンD製剤及びカルシウム剤の投与量を調節すること。
7.2.1 投与開始時に活性型ビタミンD製剤を投与している場合
・血清カルシウム濃度が8.3mg/dL以上の場合、本剤の初回投与時に活性型ビタミンD製剤の投与の中止を検討すること。
・血清カルシウム濃度が8.3mg/dL未満の場合、本剤の初回投与時に活性型ビタミンD製剤を本剤の投与開始前の用量の50%を下限に減量すること。
・カルシウム剤を投与している場合、カルシウム剤の用量は維持すること。
7.2.2 投与開始時に活性型ビタミンD製剤を投与しておらず、カルシウム剤を投与している場合
・カルシウム剤の用量が1500mg/日超の場合、本剤の初回投与時にカルシウム剤を1500mg/日を下限に減量すること。
・カルシウム剤の用量が1500mg/日以下の場合、本剤の初回投与時にカルシウム剤の投与を中止すること。ただし、食事から十分なカルシウムを摂取できない場合は、カルシウム剤を600mg/日以下の用量で投与することを検討すること。
7.3 本剤の初回投与後、及び本剤、活性型ビタミンD製剤又はカルシウム剤の投与量を変更した後は、7〜14日後を目安に血清カルシウム濃度を測定し、下図を参考に、血清カルシウム濃度が正常範囲内に維持されるように、本剤、活性型ビタミンD製剤又はカルシウム剤の投与量を調節すること。[8.1、11.1.1参照]
図1 本剤、活性型ビタミンD製剤及びカルシウム剤の投与量調節方法
・血清カルシウム濃度8.3mg/dL未満
・血清カルシウム濃度8.3mg/dL以上〜10.6mg/dL以下
・血清カルシウム濃度10.7mg/dL以上〜12.0mg/dL未満
7.4 本剤の用量調節にあたっては、以下の点に留意すること。
・血清カルシウム濃度が12.0mg/dL以上となった場合は、本剤を2〜3日間を目安に休薬すること。その後、治療を再開する場合は、血清カルシウム濃度が12.0mg/dL未満となったことを確認した上で、7.3の図を参考に、患者の血清カルシウム濃度及び休薬前の本剤の用量に基づき、本剤、活性型ビタミンD製剤及びカルシウム剤の用量を調節すること。[8.1、11.1.1参照]
・投与を忘れた場合には、気付いた時点で直ちに投与すること。ただし、1日に2回の投与は行わないこと。
・本剤の投与を3日以上休薬した場合は、低カルシウム血症の徴候・症状がないか確認し、血清カルシウム濃度の測定を検討すること。本剤による治療を再開する場合は、休薬前の用量から投与を開始し、その後は7.3の図を参考に、患者の血清カルシウム濃度に基づき、本剤、活性型ビタミンD製剤及びカルシウム剤の用量を調節すること。
7.5 低アルブミン血症(血清アルブミン濃度が4.0g/dL未満)がある場合には、補正カルシウム濃度注3)を指標に用量を調節すること。
注3)補正カルシウム濃度(mg/dL)=血清カルシウム濃度(mg/dL)−血清アルブミン濃度(g/dL)+4.0
8. 重要な基本的注意
8.2 本剤の効果を十分に発揮させるため、ビタミンDが欠乏していない状態で本剤を投与することが望ましい。本剤の投与前及び投与期間中にビタミンD欠乏が疑われる場合は、ビタミンDに関する栄養指導や生活指導等の実施を考慮すること。
8.3 起立性低血圧、めまい、立ちくらみ等があらわれることがあるので、高所での作業、自動車の運転等危険が伴う作業に従事する場合には注意させること。
8.4 本剤の自己注射にあたっては、以下の点に留意すること。
・投与法について十分な教育訓練を実施したのち、患者自ら確実に投与できることを確認した上で、医師の管理指導の下で実施すること。
・全ての器具の安全な廃棄方法について指導を徹底すること。
・添付されている取扱説明書を必ず読むよう指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨肉腫発生のリスクが高いと考えられる患者
9.2 腎機能障害患者
9.2.1 重度の腎機能障害患者(eGFRが30mL/min/1.73m2未満)
特に投与開始時に高カルシウム血症を起こす可能性があることから、投与開始後は血清カルシウム濃度や患者の状態を十分に観察すること。重度の腎機能障害を有する又は透析中の副甲状腺機能低下症患者を対象とした臨床試験は実施していない。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[15.2.3参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤の乳汁中への移行に関するデータはない。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| ジギタリス製剤 ジゴキシン [8.1、11.1.1参照] | 高カルシウム血症に伴い不整脈があらわれることがある。 | 血清カルシウム値が上昇すると、ジギタリスの作用が増強される。 |
| ビスホスホネート系製剤 アレンドロン酸ナトリウム水和物 イバンドロン酸ナトリウム水和物 リセドロン酸ナトリウム水和物等 デノスマブ ロモソズマブ等 [8.1、11.1.1参照] | 本剤による血清カルシウム濃度の正常化が阻害され、本剤の治療効果に影響を与える可能性がある。 | これらの薬剤は血清カルシウムや骨代謝に影響を及ぼし、本剤の治療効果に影響を与える可能性がある。 |
| テリパラチド製剤 [8.1、11.1.1参照] | 本剤による血清カルシウム濃度の正常化が阻害され、本剤の治療効果に影響を与える可能性がある。 | これらの薬剤は血清カルシウムや骨代謝に影響を及ぼし、本剤の治療効果に影響を与える可能性がある。 |
| アバロパラチド酢酸塩製剤 [8.1、11.1.1参照] | 本剤による血清カルシウム濃度の正常化が阻害され、本剤の治療効果に影響を与える可能性がある。 | これらの薬剤は血清カルシウムや骨代謝に影響を及ぼし、本剤の治療効果に影響を与える可能性がある。 |
| ループ系利尿薬 フロセミド アゾセミド トラセミド等 サイアザイド系利尿薬 トリクロルメチアジド ヒドロクロロチアジド等 サイアザイド系類似利尿薬 インダパミド等 [8.1、11.1.1参照] | 本剤による血清カルシウム濃度の正常化が阻害され、本剤の治療効果に影響を与える可能性がある。 | これらの薬剤は血清カルシウムや骨代謝に影響を及ぼし、本剤の治療効果に影響を与える可能性がある。 |
| 全身性コルチコステロイド薬 プレドニゾロン デキサメタゾン ベタメタゾン等 [8.1、11.1.1参照] | 本剤による血清カルシウム濃度の正常化が阻害され、本剤の治療効果に影響を与える可能性がある。 | これらの薬剤は血清カルシウムや骨代謝に影響を及ぼし、本剤の治療効果に影響を与える可能性がある。 |
| リチウム製剤 炭酸リチウム [8.1、11.1.1参照] | 本剤による血清カルシウム濃度の正常化が阻害され、本剤の治療効果に影響を与える可能性がある。 | これらの薬剤は血清カルシウムや骨代謝に影響を及ぼし、本剤の治療効果に影響を与える可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 高カルシウム血症(9.5%)
11.2 その他の副作用
| 10%以上 | 3〜10%未満 | 3%未満 | |
| 神経系障害 | 頭痛 | 浮動性めまい、体位性めまい | |
| 心臓障害 | 動悸 | ||
| 一般・全身障害および投与部位の状態 | 注射部位反応(紅斑、内出血、発疹等)(33.8%) | ||
| 胃腸障害 | 下痢、悪心 |
13. 過量投与
13.1 症状
高カルシウム血症、起立性低血圧、悪心、嘔吐、めまい、頭痛等が起こる可能性がある。
13.2 処置
特異的な解毒薬はない。血清カルシウム濃度を測定し、輸液等の適切な処置を行うこと。
14. 適用上の注意
14.1 薬剤投与前の注意
14.1.1 本剤はJIS T 3226-2に適合するA型専用注射針を用いて使用すること。注射針は毎回新しいものを、必ず注射直前に取り付けること。
14.1.2 本剤とA型専用注射針との装着時に液漏れ等の不具合が認められた場合には、新しい注射針に取り替える等の処置方法を患者に十分指導すること。
14.1.3 カートリッジにひびが入っている場合又は液が変色している場合は使用しないこと。
14.2 薬剤投与時の注意
14.2.1 投与部位
(1)腹部又は大腿前部に皮下注射すること。注射部位は毎回変更し、同一部位に短期間に繰り返し注射しないこと。
(2)本剤の1日用量が30μgを超える場合は、2本のペン型注入器を用いて、異なる注射部位に1回ずつ計2回投与すること。
14.2.2 投与時
注射時は注入ボタンを5秒間押し続けること。
14.2.3 その他
(1)1本のペン型注入器の本剤を複数の患者に使用しないこと。
(2)他の薬剤と混合しないこと。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 雌雄ラットに本薬を皮下投与した反復投与毒性試験において、2μg/kg/日及び5μg/kg/日(5μg/kg/日投与時の遊離PTHのAUC比はヒトに本剤60μg/日を投与した場合の約2倍)で骨吸収作用を示唆する変化(鼻骨の空隙率の増加等)が、10μg/kg/日以上(遊離PTHのAUC比は、ヒトに本剤60μg/日を投与した場合の約5倍以上)では骨形成作用を示唆する変化(大腿骨・胸骨の骨増加等)が認められた。また、20μg/kg/日(遊離PTHのAUC比はヒトに本剤60μg/日を投与した場合の約9倍)で骨端線の異常(異形成)が認められた1)。[9.1.1参照]
15.2.2 本薬のがん原性試験は実施されていない。テリパラチド製剤(骨粗鬆症治療剤)では、雌雄ラットに皮下投与したがん原性試験において、骨肉腫を含む骨腫瘍性病変の発生頻度が増加したとの報告がある。[9.1.1参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人男性に本剤50、75、100μgを単回皮下投与したときの血漿中遊離PTH(1-34)の薬物動態パラメータは以下のとおりであった3)。
| 用量(μg) | Cmax(pg/mL) | AUC0-120h(pg・h/mL) | tmax(h) |
| 50(n=7) | 7.19(10.6) | 340(17.8) | 8.00(4.00-16.17) |
| 75(n=7) | 10.3(20.6) | 484(9.3) | 8.00(1.97-16.05) |
| 100(n=7) | 14.1(22.5) | 621(19.2) | 4.00(2.00-7.98) |
16.1.2 反復投与
(1)健康成人
外国人健康成人に本剤12〜24μgを1日1回 10日間反復皮下投与したときの血漿中遊離PTH(1-34)の薬物動態パラメータは以下のとおりであった3)4)。
| 用量(μg) | 評価時点 | Cmax(pg/mL) | AUCtau(pg・h/mL) | tmax(h) | t1/2(h) |
| 12(n=8) | 1日目 | − | − | − | − |
| 10日目 | 3.78(18.6) | 68.0(21.4) | 4.00(4.00-16.02) | 63.7(27.0) | |
| 16(n=8) | 1日目 | 2.45(19.3) | 46.2(14.2) | 8.00(4.00-16.00) | − |
| 10日目 | 4.46(20.3) | 87.7(23.5) | 4.00(4.00-12.00) | 34.8(40.7) | |
| 20(n=8) | 1日目 | 3.05(17.7) | 54.7(17.4) | 4.00(3.75-16.00) | − |
| 10日目 | 5.77(19.0) | 112(20.5) | 6.07(4.03-16.05) | 51.3(9.6) | |
| 24(n=8) | 1日目 | 3.81(15.4) | 66.8(15.9) | 8.00(4.00-16.00) | − |
| 10日目 | 7.43(22.6) | 150(19.1) | 7.88(4.00-12.00) | 46.9(13.2) |
(2)副甲状腺機能低下症患者
外国人副甲状腺機能低下症の成人患者12例に本剤12〜45μg(平均24.5μg)を1日1回反復皮下投与したときの定常状態における血漿中遊離PTH濃度推移は以下のとおりであり、投与後24時間を通じて正常範囲内注4)を維持した5)。
図2 反復皮下投与したときの血漿中遊離PTH濃度推移
平均値±標準誤差(各測定ポイントにおける例数n=7〜12)
遊離PTH:遊離PTH(1-34)濃度と遊離PTH(1-33)濃度を合算
注4)遊離PTHの正常範囲(約4〜26pg/mL)は、血漿中の内因性PTH(1-84)濃度の正常範囲(10〜65pg/mL)と、内因性PTH(1-84)に対するPTH(1-34)の分子量の比から算出された。
16.3 分布
健康成人、腎機能障害者及び副甲状腺機能低下症患者281例から得られたデータに基づく母集団薬物動態解析により、体重70kgの外国人健康成人女性に本剤を皮下投与したときの遊離PTHの見かけの分布容積(平均値(CV%))は8.7(18)Lと推定された6)。
16.4 代謝
パロペグテリパラチドは生理的条件下でリンカー部位が加水分解され、PTH(1-34)及びPTH(1-34)の活性代謝物であるPTH(1-33)を放出する。PTH(1-34)及びPTH(1-33)は同様の活性を有する。[18.1参照]
16.6 特定の背景を有する患者
16.6.1 腎機能障害者
腎機能障害の程度が異なる被験者に本剤50μgを単回皮下投与したときの遊離PTH(1-34)、総PTH及びmPEGの薬物動態パラメータを、腎機能が正常(eGFR 90mL/min/1.73m2以上)な被験者(13例)と比較した結果は以下のとおりであった3)。重度腎機能障害を有する被験者では、内因性PTH(1-84)濃度が高いことに起因し、遊離PTH(1-34)の曝露量が適切に評価されていない可能性がある7)。[9.2.1参照]
| 腎機能障害の程度 eGFR(mL/min/1.73m2) | 遊離PTH(1-34) | 総PTH | mPEG | |||
| Cmax 幾何平均値の比 [90%信頼区間] | AUClast 幾何平均値の比 [90%信頼区間] | Cmax 幾何平均値の比 [90%信頼区間] | AUClast 幾何平均値の比 [90%信頼区間] | Cmax 幾何平均値の比 [90%信頼区間] | AUClast 幾何平均値の比 [90%信頼区間] | |
| 軽度 (60≦eGFR<90) (n=9) | 1.13 [0.956-1.33] | 1.43 [1.01-2.03] | 1.19 [0.716-1.97] | 1.29 [0.764-2.16] | 1.31 [0.820-2.09] | 1.59 [0.874-2.88] |
| 中等度 (30≦eGFR<60) (n=8) | 1.17 [0.859-1.60] | 1.34 [0.712-2.50] | 0.741 [0.408-1.35] | 0.834 [0.484-1.44] | 0.942 [0.543-1.64] | 1.18 [0.788-1.78] |
| 重度 (eGFR<30) (n=8) | 2.83 [1.82-4.40] | 13.80 [5.83-32.50] | 0.718 [0.394-1.31] | 0.740 [0.339-1.62] | 1.01 [0.646-1.57] | 1.25 [0.579-2.71] |
16.6.2 高齢者
母集団薬物動態解析の結果、年齢(19〜76歳)は遊離PTHの曝露量に影響を及ぼさないことが示唆された6)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第III相試験
活性型ビタミンD製剤及びカルシウム剤による治療を受けている副甲状腺機能低下症患者82例を対象に、プラセボ対照無作為化二重盲験並行群間比較試験を実施した(本剤群61例、プラセボ群21例)。用法は、プラセボ又は本剤を1日1回皮下投与とされた。本剤の開始用量は18μgとされ、その後は患者ごとに、血清カルシウム値が正常となり、かつ活性型ビタミンD製剤及びカルシウム剤からの離脱が可能となるよう、6〜60μgの範囲で用量が調節された8)。
主要評価項目は盲検期終了時(投与26週時)のレスポンダーの割合とされ、レスポンダーはアルブミン補正血清カルシウム濃度が正常範囲(8.3〜10.6mg/dL)、活性型ビタミンD製剤からの離脱、カルシウム剤からの離脱、投与26週時より4週間以内に治験薬を増量していない、のすべてを満たす場合とされた9)。
盲検期終了時のレスポンダーの割合について、本剤群は78.7%(48/61例)、プラセボ群は4.8%(1/21例)、群間差[95%信頼区間]は73.9%[52.8,85.4]であり、プラセボに対する本剤の優越性が示された(p<0.0001、副甲状腺機能低下症の成因(術後、その他)で層別化したCochran-Mantel-Haenszel検定、有意水準両側5%)。試験期間中の本剤群の投与量(中央値[範囲])は、投与4週時では21.0[12,30]μg、投与26週時では21.0[9,39]μgであった。
盲検期終了時までの副作用の発現割合は本剤群で49.2%(30/61例)、プラセボ群で38.1%(8/21例)であり、本剤群の主な副作用は、注射部位反応31.1%(19/61例)、頭痛9.8%(6/61例)、高カルシウム血症9.8%(6/61例)、悪心8.2%(5/61例)であった。
主要評価項目は盲検期終了時(投与26週時)のレスポンダーの割合とされ、レスポンダーはアルブミン補正血清カルシウム濃度が正常範囲(8.3〜10.6mg/dL)、活性型ビタミンD製剤からの離脱、カルシウム剤からの離脱、投与26週時より4週間以内に治験薬を増量していない、のすべてを満たす場合とされた9)。
盲検期終了時のレスポンダーの割合について、本剤群は78.7%(48/61例)、プラセボ群は4.8%(1/21例)、群間差[95%信頼区間]は73.9%[52.8,85.4]であり、プラセボに対する本剤の優越性が示された(p<0.0001、副甲状腺機能低下症の成因(術後、その他)で層別化したCochran-Mantel-Haenszel検定、有意水準両側5%)。試験期間中の本剤群の投与量(中央値[範囲])は、投与4週時では21.0[12,30]μg、投与26週時では21.0[9,39]μgであった。
盲検期終了時までの副作用の発現割合は本剤群で49.2%(30/61例)、プラセボ群で38.1%(8/21例)であり、本剤群の主な副作用は、注射部位反応31.1%(19/61例)、頭痛9.8%(6/61例)、高カルシウム血症9.8%(6/61例)、悪心8.2%(5/61例)であった。
17.1.2 国内第III相試験
活性型ビタミンD製剤及びカルシウム剤による治療を受けている副甲状腺機能低下症患者13例を対象に、非盲検非対照試験を実施した。用法は、本剤を1日1回皮下投与、本剤の開始用量は18μgとされ、その後は患者ごとに、血清カルシウム値が正常となり、かつ活性型ビタミンD製剤及びカルシウム剤からの離脱が可能となるよう、6〜60μgの範囲で用量が調節された10)。
主要評価項目は有効性評価期終了時(投与26週時)のレスポンダーの割合とされ、レスポンダーはアルブミン補正血清カルシウム濃度が正常範囲(8.3〜10.6mg/dL)、活性型ビタミンD製剤からの離脱、カルシウム製剤からの離脱、のすべてを満たす場合とされた10)。
有効性評価期終了時のレスポンダーの割合は、92.3%(12/13例)、投与52週時のレスポンダーの割合は、91.7%(11/12例)であった。試験期間中の投与量(中央値[範囲])は、投与4週時では21.0[12,27]μg、投与26週時では21.0[12,30]μg、投与52週時では22.5[12,33]μgであった。
副作用は投与52週時までに30.8%(4/13例)に認められ、認められた副作用は、注射部位紅斑、投薬過誤、高カルシウム血症、高カルシウム尿症が各7.7%(1/13例)であった。
なお、国内第III相試験において、本剤の1日投与量が30μgを超える場合、下表のとおりに2本のペンを組み合わせて投与された。
主要評価項目は有効性評価期終了時(投与26週時)のレスポンダーの割合とされ、レスポンダーはアルブミン補正血清カルシウム濃度が正常範囲(8.3〜10.6mg/dL)、活性型ビタミンD製剤からの離脱、カルシウム製剤からの離脱、のすべてを満たす場合とされた10)。
有効性評価期終了時のレスポンダーの割合は、92.3%(12/13例)、投与52週時のレスポンダーの割合は、91.7%(11/12例)であった。試験期間中の投与量(中央値[範囲])は、投与4週時では21.0[12,27]μg、投与26週時では21.0[12,30]μg、投与52週時では22.5[12,33]μgであった。
副作用は投与52週時までに30.8%(4/13例)に認められ、認められた副作用は、注射部位紅斑、投薬過誤、高カルシウム血症、高カルシウム尿症が各7.7%(1/13例)であった。
なお、国内第III相試験において、本剤の1日投与量が30μgを超える場合、下表のとおりに2本のペンを組み合わせて投与された。
| 用量 | 用法 | ペン型注入器の組み合わせ |
| 33μg/日 | 18μg/日+15μg/日 | 294μg/0.98mLペン2本(オレンジ色の押しボタン付き) |
| 36μg/日 | 18μg/日+18μg/日 | |
| 39μg/日 | 21μg/日+18μg/日 | |
| 42μg/日 | 21μg/日+21μg/日 | |
| 45μg/日 | 24μg/日+21μg/日 | 420μg/1.4mLペン1本(赤紫色の押しボタン付き) + 294μg/0.98mLペン1本(オレンジ色の押しボタン付き) |
| 48μg/日 | 24μg/日+24μg/日 | 420μg/1.4mLペン2本(赤紫色の押しボタン付き) |
| 51μg/日 | 27μg/日+24μg/日 | |
| 54μg/日 | 27μg/日+27μg/日 | |
| 57μg/日 | 30μg/日+27μg/日 | |
| 60μg/日 | 30μg/日+30μg/日 |
18. 薬効薬理
18.1 作用機序
パロペグテリパラチドは、PTH(1-34)にリンカーを介してメトキシポリエチレングリコールを結合させたプロドラッグであり、皮下投与後、リンカー部分が加水分解することにより、PTH(1-34)が持続的に遊離する11)。
PTH(1-34)及び主な代謝物であるPTH(1-33)は、内因性PTH(1-84)と同様にPTH受容体に作用し、骨組織からのカルシウムの動員や腎臓の尿細管からのカルシウム再吸収の促進、小腸における活性型ビタミンD合成亢進を介した間接的なカルシウム輸送の促進により、血中カルシウム濃度を上昇させる。また、腎臓のリン再吸収を抑制すること等により、血中リン濃度を低下させる。[16.4参照]
PTH(1-34)及び主な代謝物であるPTH(1-33)は、内因性PTH(1-84)と同様にPTH受容体に作用し、骨組織からのカルシウムの動員や腎臓の尿細管からのカルシウム再吸収の促進、小腸における活性型ビタミンD合成亢進を介した間接的なカルシウム輸送の促進により、血中カルシウム濃度を上昇させる。また、腎臓のリン再吸収を抑制すること等により、血中リン濃度を低下させる。[16.4参照]
18.2 副甲状腺機能低下症の動物モデルでの薬理作用
副甲状腺機能低下症モデルラットにおいて、パロペグテリパラチドを28日間反復皮下投与した結果、試験期間を通じて血中カルシウム濃度が上昇し、血中リン濃度が低下した。また、骨形成マーカー及び骨吸収マーカーの上昇、海綿骨の骨密度の低下が認められた11)。
19. 有効成分に関する理化学的知見
19.1. パロペグテリパラチド
20. 取扱い上の注意
使用開始後はキャップにより遮光して室温(30℃以下)に保管し、2週間以内に使用すること。残った場合は廃棄すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ヨビパス皮下注168μgペン>
1筒
<ヨビパス皮下注294μgペン>
1筒
<ヨビパス皮下注420μgペン>
1筒
23. 主要文献
- 社内報告:反復投与毒性試験(ラット)(2025年8月25日承認、CTD2.6.6.3.1), (2025)
- 社内報告:生殖発生毒性試験(マウス、ラット、ウサギ)(2025年8月25日承認、CTD2.6.6.6), (2025)
- 社内報告:海外第I相試験(健康成人)(2025年8月25日承認、CTD2.7.6.3、5.3.3.1、5.3.3.3), (2025)
- Karpf DB,et al., J Bone Miner Res., 35 (8), 1430-40, (2020) »PubMed
- 社内報告:海外第II相試験(副甲状腺機能低下症患者)(2025年8月25日承認、CTD5.3.5.1), (2025)
- 社内報告:母集団薬物動態解析(健康成人、腎機能障害者、副甲状腺機能低下症患者)(2025年8月25日承認、CTD2.7.2.3、5.3.3.5), (2025)
- 社内報告:海外第I相試験(腎機能障害患者)(2025年8月25日承認、CTD5.3.3.3), (2025)
- 社内報告:海外第III相試験(副甲状腺機能低下症)(2025年8月25日承認、CTD2.7.3.2、2.7.4.2、2.7.6.6、5.3.5.1), (2025)
- Khan AA,et al., J Bone Miner Res., 38 (1), 14-25, (2023)
- 社内報告:国内第III相試験(副甲状腺機能低下症)(2025年8月25日承認、CTD2.7.3.2、2.7.6.7、5.3.5.2), (2025)
- Holten-Andersen L,et al., J Bone Miner Res., 34 (11), 2075-86, (2019) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
製品情報問い合わせ先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
25. 保険給付上の注意
本剤は新医薬品であるため、厚生労働省告示第107号(平成18年3月6日付)に基づき、2026年10月末日までは、投薬は1回14日分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
帝人ファーマ株式会社
東京都千代田区霞が関3丁目2番1号