医薬品情報
| 総称名 | ネクセトール |
|---|---|
| 一般名 | ベムペド酸 |
| 欧文一般名 | Bempedoic Acid |
| 製剤名 | ベムペド酸錠 |
| 薬効分類名 | ATPクエン酸リアーゼ阻害剤 |
| 薬効分類番号 | 2189 |
| KEGG DRUG |
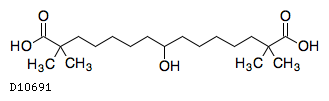
D10691
ベムペド酸
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年11月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ネクセトール錠180mg | NEXLETOL tablets 180mg | 大塚製薬 | 2189022F1023 | 371.5円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
5. 効能または効果に関連する注意
5.1 適用の前に十分な診察及び検査を実施し、高コレステロール血症又は家族性高コレステロール血症であることを確認した上で本剤の適用を考慮すること。
5.2 HMG-CoA還元酵素阻害剤で効果不十分、又は以下に示すHMG-CoA還元酵素阻害剤による治療が適さない患者に使用すること。
・副作用の既往等によりHMG-CoA還元酵素阻害剤の使用が困難な患者
・HMG-CoA還元酵素阻害剤の使用が禁忌とされる患者
5.3 家族性高コレステロール血症のうちホモ接合体については使用経験がないので、治療上やむを得ないと判断される場合のみ、LDLアフェレーシス等の非薬物療法の補助として本剤の適用を考慮すること。
6. 用法及び用量
通常、成人にはベムペド酸として180mgを1日1回経口投与する。
7. 用法及び用量に関連する注意
HMG-CoA還元酵素阻害剤による治療が適さない場合を除き、HMG-CoA還元酵素阻害剤と併用すること。[8.3参照]
8. 重要な基本的注意
8.1 本剤投与にあたっては、あらかじめ高コレステロール血症治療の基本である食事療法を行い、更に運動療法、禁煙、他の虚血性心疾患のリスクファクター(糖尿病、高血圧症等)の軽減等も十分考慮すること。
8.2 本剤投与中は血中脂質値を定期的に検査し、本剤に対する反応が認められない場合には投与を中止すること。
8.3 HMG-CoA還元酵素阻害剤及び他の脂質異常症治療薬と併用する場合は、併用する薬剤の電子添文の2.禁忌、8.重要な基本的注意、9.特定の背景を有する患者に関する注意及び11.1重大な副作用の記載を必ず確認すること。[7.参照]
8.4 本剤はHMG-CoA還元酵素阻害剤の血中濃度を上昇させることから、横紋筋融解症等の副作用があらわれるおそれがある。本剤とHMG-CoA還元酵素阻害剤を併用する場合は、定期的にCKを測定するなど患者の状態を十分に観察すること。また、これらの副作用の症状又は徴候があらわれた場合には速やかに医師に相談するよう患者に指導すること。[16.7.2参照]
8.5 本剤投与により尿酸値が上昇し、高尿酸血症又は高尿酸血症の悪化があらわれるおそれがあるため、血清尿酸値の測定等の観察を十分行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 痛風の既往歴のある患者又は高尿酸血症の患者
症状が悪化し痛風を引き起こすおそれがある。
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者(Child-Pugh分類C)
本剤の非結合形の血中濃度が上昇するおそれがある。重度の肝機能障害患者を対象とした臨床試験は実施していない。[16.6.2参照]
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び最終投与後1週間において避妊する必要性及び適切な避妊法について説明すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 血液 | 貧血、ヘモグロビン減少 | |||
| 代謝 | 高尿酸血症 | 痛風 | ||
| 肝臓 | 肝機能異常、肝機能検査値上昇 | AST上昇、ALT上昇 | ||
| 腎臓・泌尿器 | 血中クレアチニン増加、血中尿素増加、糸球体濾過率減少 | |||
| その他 | 四肢痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人に本剤180mgを空腹時に単回経口投与した時の、血漿中ベムペド酸濃度推移及び薬物動態パラメータを図16-1及び表16-1に示す2)。
図16-1 健康成人における本剤単回経口投与時の血漿中ベムペド酸濃度推移
| 用量 | 例数 | tmax(h) | Cmax(μg/mL) | AUCinf(μg・h/mL) | t1/2(h) |
| 180mg | 6 | 2.00 (1.00-2.00) | 17.8 (2.99) | 280 (59.3) | 20.1 (4.18) |
16.1.2 反復投与
健康成人に本剤180mgを空腹時に1日1回14日間反復経口投与した時の、血漿中ベムペド酸の薬物動態パラメータを表16-2に示す。14日間反復経口投与後のAUCtauと単回経口投与後のAUC24の比により算出したベムペド酸の累積係数の平均値は2.35であった2)。
| 用量 | 例数 | tmax(h) | Cmax(μg/mL) | AUCtau(μg・h/mL) | t1/2(h) |
| 180mg | 6 | 2.00 (2.00-3.00) | 30.7 (6.57) | 391 (118) | 25.2 (4.83) |
16.2 吸収
16.2.1 食事の影響
健康成人17例に本剤180mgを単回経口投与した時、空腹投与時に対する食後投与時のベムペド酸のCmax及びAUCinfの幾何平均比はそれぞれ0.88及び0.98であった3)(外国人データ)。
16.3 分布
16.4 代謝
ベムペド酸の代謝へのCYPの寄与は小さく、主にNADPH依存性の酸化及びUGT2B7によるグルクロン酸抱合により代謝される6)(in vitro)。
16.5 排泄
健康成人6例に14C-ベムペド酸240mg注)を単回経口投与した時、投与放射能量の62.1%が尿中から、25.4%が糞便中から回収された。糞便中及び尿中にそれぞれ投与量の5%未満が未変化体として排泄された7)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
本剤180mgを単回経口投与した時、正常な腎機能を有する被験者(Ccr:90mL/min以上、6例)と比較し、軽度(eGFR:60〜89mL/min/1.73m2、6例)、中等度(eGFR:30超〜59mL/min/1.73m2、6例)及び重度(eGFR:30mL/min/1.73m2以下、6例)の腎機能障害のある被験者では、ベムペド酸のCmaxはそれぞれ1.23倍、1.15倍及び0.97倍、AUCはそれぞれ1.18倍、1.76倍及び1.90倍であった8)(外国人データ)。透析中の末期腎不全の被験者(eGFR:15mL/min未満、11例)に本剤180mgを透析1時間前及び透析23時間後に単回経口投与した時、正常な腎機能を有する被験者(10例)と比較し、ベムペド酸のCmaxはそれぞれ0.84倍及び0.83倍、AUCはそれぞれ1.47倍及び1.75倍であった9)(外国人データ)。
本剤を投与された2,403例(日本人159例を含む)を対象とした母集団薬物動態解析の結果より、正常な腎機能を有する患者と比較し、軽度及び中等度の腎機能障害のある患者では、ベムペド酸の定常状態におけるAUCはそれぞれ1.39倍及び1.88倍であった10)。
本剤を投与された2,403例(日本人159例を含む)を対象とした母集団薬物動態解析の結果より、正常な腎機能を有する患者と比較し、軽度及び中等度の腎機能障害のある患者では、ベムペド酸の定常状態におけるAUCはそれぞれ1.39倍及び1.88倍であった10)。
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 プロベネシド
健康成人20例において、プロベネシド(UGT阻害剤)500mg1日2回投与と併用して本剤180mgを単回経口投与した時、ベムペド酸単独投与時と比較して、ベムペド酸のCmax及びAUCはそれぞれ1.23倍及び1.74倍であった12)(外国人データ)。
16.7.2 HMG-CoA還元酵素阻害剤
以下の[1]〜[4]の4試験において、本剤とHMG-CoA還元酵素阻害剤の薬物相互作用が検討された。
[1]健康成人11〜12例にベムペド酸240mg注)とシンバスタチン20mg、プラバスタチン40mg又はロスバスタチン10mgを併用投与した。[2]健康成人12例に本剤180mgとアトルバスタチン80mg、シンバスタチン40mg、プラバスタチン80mg又はロスバスタチン40mgを併用投与した。[3]高コレステロール血症患者40例にベムペド酸120mg注)又は240mg注)とアトルバスタチン10mgを併用投与した。[4]高コレステロール血症患者41例に本剤180mgとアトルバスタチン80mgを併用投与した。
16.7.3 エゼチミブ
健康成人40例において、本剤180mg1日1回投与と併用してエゼチミブ10mgを単回経口投与した時、エゼチミブ単独投与時と比較して、エゼチミブのCmax及びAUCはそれぞれ1.16倍及び1.11倍、エゼチミブのグルクロン酸抱合体のCmax及びAUCはそれぞれ1.80倍及び1.67倍であった。エゼチミブ10mg1日1回投与と併用して本剤180mgを単回経口投与した時、ベムペド酸単独投与時と比較して、ベムペド酸のCmax及びAUCはそれぞれ1.08倍及び1.05倍であった17)(外国人データ)。
16.7.4 メトホルミン
2型糖尿病被験者19例に本剤180mg及びメトホルミン500mgを併用投与した時、メトホルミン単独投与時と比較して、メトホルミンのCmax及びAUCはそれぞれ1.04倍及び0.97倍であった18)(外国人データ)。
16.7.5 経口避妊薬
健康成人16例に本剤180mg及び経口避妊薬(ノルエチンドロン1mg及びエチニルエストラジオール0.035mg)を併用投与した時、経口避妊薬単独投与時と比較して、ノルエチンドロンのCmax及びAUCはそれぞれ1.22倍及び1.03倍、エチニルエストラジオールのCmax及びAUCはそれぞれ1.09倍及び0.96倍であった19)(外国人データ)。
注)本剤の承認された用量は、1日1回180mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
HMG-CoA還元酵素阻害剤及び/又はHMG-CoA還元酵素阻害剤以外の高コレステロール血症治療薬を投与中注1)のコントロールが不十分又は不耐の高LDLコレステロール血症患者注2)96例(家族性高コレステロール血症患者を含む)を対象に、プラセボ対照無作為化二重盲検並行群間比較試験を実施した。本剤180mgを1日1回12週間投与した結果、主要評価項目である投与12週時におけるLDL-コレステロールのベースラインからの変化率は表17-1のとおりであった。また、LDL-コレステロールの平均変化率の推移は図17-1のとおりであった20)。
注1)同一の用法・用量で4週間以上の高コレステロール血症治療薬(フィブラート系薬剤及び選択的PPARαモジュレーターは6週間以上)による治療を受けている患者
注2)以下のいずれかに該当する患者
・冠動脈疾患の既往を有する又は家族性高コレステロール血症ヘテロ接合体を有し、LDL-コレステロール値が100mg/dL以上の患者
・以下に該当する動脈硬化性疾患予防ガイドライン2017年版で「高リスク」に分類され、LDL-コレステロール値が120mg/dL以上の患者
・非心原性脳梗塞の既往又は末梢動脈疾患を有する
・慢性腎臓病
・2型糖尿病
・吹田スコア56点以上
・動脈硬化性疾患予防ガイドライン2017年版で「中リスク」に分類され、LDL-コレステロール値が140mg/dL以上の患者
| プラセボ群 | 本剤群 | |
| ベースライン値(mg/dL)a | 137.67±21.661 (48例) | 134.50±25.134 (48例) |
| 12週時(mg/dL)a | 130.91±21.528 (45例) | 99.89±21.579 (46例) |
| 変化率(%)b,d | −3.46±1.901 | −25.25±1.864 |
| 群間差(%)c,d | − | −21.78 [−26.71,−16.85] |
| p値d | − | <0.001 |
図17-1 LDL-コレステロールの平均変化率の推移(FAS、MMRM解析)
副作用発現頻度は、48例中3例(6.3%)であり、副作用は関節痛、筋痙縮及び四肢不快感が各1例(2.1%)であった。
17.1.2 国内長期投与試験
HMG-CoA還元酵素阻害剤及び/又はHMG-CoA還元酵素阻害剤以外の高コレステロール血症治療薬を投与中注3)のコントロールが不十分又は不耐の高LDLコレステロール血症患者注4)130例(国内第III相試験からの継続例29例及び新たに組み入れられた101例、家族性高コレステロール血症患者を含む)を対象に、非盲検非対照長期試験を実施した。本剤180mgを1日1回52週間投与した結果、最終評価時におけるLDL-コレステロールのベースラインからの変化率は表17-2のとおりであった。また、LDL-コレステロールの平均変化率の推移は図17-2のとおりであった21)。
注3)同一の用法・用量で4週間以上の高コレステロール血症治療薬(フィブラート系薬剤及び選択的PPARαモジュレーターは6週間以上、PCSK9阻害剤は3箇月以上)による治療を受けている患者
注4)以下のいずれかに該当する患者
・冠動脈疾患の既往を有する又は家族性高コレステロール血症ヘテロ接合体を有し、LDL-コレステロール値が100mg/dL以上の患者
・以下に該当する動脈硬化性疾患予防ガイドライン2017年版で「高リスク」に分類され、LDL-コレステロール値が120mg/dL以上の患者
・非心原性脳梗塞の既往又は末梢動脈疾患を有する
・慢性腎臓病
・2型糖尿病
・吹田スコア56点以上
・動脈硬化性疾患予防ガイドライン2017年版で「中リスク」に分類され、LDL-コレステロール値が140mg/dL以上の患者
| 継続例 29例 | 新規例 101例 | |
| ベースライン値a(mg/dL) | 119.1±24.51 | 136.9±25.12 |
| 最終評価時a,b(mg/dL) | 104.9±20.72 | 99.5±23.85 |
| 変化率c(%) | −9.52±3.614 | −26.32±1.691 |
図17-2 LDL-コレステロールの平均変化率の推移(有効性解析対象集団)
副作用発現頻度は、130例中19例(14.6%)であり、主な副作用は高尿酸血症8例(6.2%)、血中尿酸増加3例(2.3%)であった。
18. 薬効薬理
18.1 作用機序
ベムペド酸は肝臓においてETC-1002コエンザイムA(ETC-1002-CoA)へと活性化されてから、アデノシン三リン酸クエン酸リアーゼ(ACL)を阻害する。ACLはコレステロール生合成経路の3-ヒドロキシ-3-メチルグルタリルコエンザイムA(HMG-CoA)還元酵素の上流酵素である。ETC-1002-CoAによってACLが阻害されると、肝臓のコレステロール合成が低下し、低比重リポ蛋白質受容体(LDLR)の発現誘導によって血中の低比重リポ蛋白コレステロール(LDL-C)が低下する。
18.2 ACL阻害作用
ベムペド酸のCoA活性体であるETC-1002-CoAは、ヒトACL活性阻害作用を発揮した22)(in vitro)。
18.3 脂質合成阻害作用とLDLR誘導作用
18.4 血中脂質低下作用
18.5 動脈硬化進展抑制作用
19. 有効成分に関する理化学的知見
19.1. ベムペド酸
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
PTP
100錠(10錠×10)
23. 主要文献
- 社内資料:毒性試験(2025年9月19日承認、CTD2.6.6)
- 社内資料:単回及び反復投与試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:食事の影響試験(2025年9月19日承認、CTD2.7.6.1)
- 社内資料:In vitro血漿蛋白結合試験(2025年9月19日承認、CTD2.7.2.2)
- 社内資料:乳汁移行性試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:In vitro代謝試験(2025年9月19日承認、CTD2.7.2.2)
- 社内資料:マスバランス試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:腎障害患者を対象とした単回投与試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:透析中の末期腎不全患者を対象とした単回投与試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:母集団薬物動態及び薬力学解析(2025年9月19日承認、CTD2.7.2.3)
- 社内資料:肝障害患者を対象とした単回投与試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:プロベネシドとの薬物相互作用試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:スタチンとの薬物相互作用試験1(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:スタチンとの薬物相互作用試験2(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:スタチンとの薬物相互作用試験3(2025年9月19日承認、CTD2.7.6.3)
- 社内資料:スタチンとの薬物相互作用試験4(2025年9月19日承認、CTD2.7.6.3)
- 社内資料:エゼチミブとの薬物相互作用試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:メトホルミンとの薬物相互作用試験(2025年9月19日承認、CTD2.7.6.3)
- 社内資料:経口避妊薬との薬物相互作用試験(2025年9月19日承認、CTD2.7.6.2)
- 社内資料:高コレステロール血症患者を対象とした国内プラセボ対照二重盲検試験(2025年9月19日承認、CTD2.7.6.4)
- 社内資料:高コレステロール血症患者を対象とした国内長期投与試験(2025年9月19日承認、CTD2.7.6.4)
- 社内資料:作用機序;ACL阻害作用、脂質合成阻害作用、及びLDLR誘導作用(2025年9月19日承認、CTD2.6.2.2)
- 社内資料:高コレステロール血症モデルマウスにおける肝LDLR誘導作用と動脈硬化進展抑制作用(2025年9月19日承認、CTD2.6.2.2)
- 社内資料:高コレステロール血症モデルハムスターにおける血漿脂質低下作用(2025年9月19日承認、CTD2.6.2.2)
- 社内資料:高コレステロール血症モデルマウスにおける血清脂質低下作用(2025年9月19日承認、CTD2.6.2.2)
- 社内資料:高コレステロール血症モデルミニブタにおける動脈硬化進展抑制作用(2025年9月19日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
製品情報問い合わせ先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
25. 保険給付上の注意
本剤は新医薬品であるため、平成18年3月6日付 厚生労働省告示第107号に基づき、2026年11月末日までは、投薬は1回14日分を限度とされています。
26. 製造販売業者等
26.1 製造販売元
大塚製薬株式会社
東京都千代田区神田司町2-9